Муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа № 4 с.Коноково
муниципального образования Успенский район

Автор: Каменецкая С.С.
учитель химии, биологии, информатики
МБОУСОШ№4
2015 г.
Предмет: химия
Класс: 9 «А»
Тема: «Кислотные дожди».
Эпиграф: «Жить счастливо и жить согласно с природой – одно и то же».
Сенека, римский философ, I век
Цель: Познакомить учащихся в свете изучения свойств соединений серы, азота с понятием «Кислотные дожди», основными естественными и антропогенными источниками кислотообразующих выбросов, влиянием кислотных осадков на окружающий мир.
Задачи:
Образовательные:
Продолжить развитие знаний о соединениях серы, азота;
Познакомиться с влиянием соединений серы, азота на окружающий мир;
Использовать полученные знания для объяснения причин возникновения экологических проблем и путей их решения;
Развивающие:
Развивать навыки научно-исследовательской работы учащихся, их деловой активности, интереса к предмету.
Развивать умение
владеть химической терминологией
четко формулировать и высказывать мысли, интерес к предмету
Работать с лабораторным оборудованием
Обобщать полученные знания и делать самостоятельные выводы
Воспитательные:
Формировать ответственное отношение к делу, воспитывать бережное отношение к природе;
Подвести учащихся к осознанию важной роли каждого человека в решении экологических проблем.
Форма организации:
Комбинированный урок.
Методы:
фронтальная и индивидуальная формы оценки знаний;
решение практических задач
беседа в сочетании с самостоятельной работой, лабораторным экспериментом, исследовательской работой.
Оборудование:
мультимедийный проектор
компьютер
интерактивная доска Smart Board
презентация Smart Notebook
приложение 1
видеофрагмент «Кислотные дожди»
реактивы: вода, растворы лимонной кислоты, серной кислоты, универсальная индикаторная бумажка, образец снега, штатив, пробирки.
План урока.
I. Организационный момент.
II. Проверка знаний учащихся.
III. Изучение нового материала.
IV. Закрепление.
V. Подведение итогов урока.
VI. Домашнее задание.
VII. Выставление оценок за работу на уроке.
VIII. Рефлексия
Ход урока:
Организационный момент.
Приветствие гостей и учащихся.
Проверка знаний учащихся.
Проверка домашнего задания. У доски 2 учащихся, один работает на интерактивной доске, второй - на обычной доске.
Осуществление цепочек превращений на интерактивной доске. Остальные учащиеся осуществляют цепочки превращений в тетрадях.
S → SO2 → SO3 → H2SO4→ ВаSO4 (интерактивная доска)
N2→ NO → NO2 →HNO3→NaNO3 (доска)
Из набора химических знаков и цифр необходимо составить уравнения реакций по цепочкам превращений.
Первая цепочка превращений:
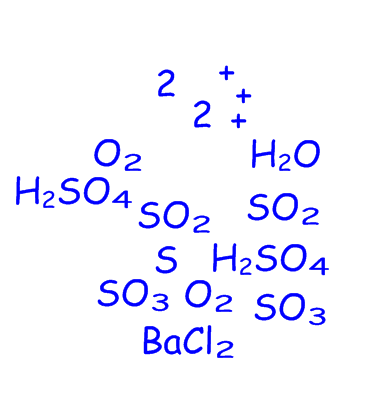
1) ….. + ….. = ……
2) ….. + ….. = ……
3) ….. + ….. = ……
4) ….. + ….. = …… + ……
Ответы:
1) S +O2 = SO2 при t0
2) 2SO2 + O2 = 2SO3 катализатор
3) SO3 + H2O ↔ H2SO4 при t0
4) H2SO4 + BaCl2 = BaSO4↓ + 2HCl
Вторая цепочка превращений.
N2 + O2 = 2NO при t0
2NO+ O2 = 2NO2
NO2 + O2 + H2O = HNO3
HNO3 + NaOH = NaNO3 + H2O
Учитель:
В каких реакциях образуются кислоты? (Ответ: в реакциях №3 первой цепочки и №3 во второй цепочке)
Назовите эти кислоты? (Ответ: серная кислота и азотная кислота)
Учитель: Реакции образования кислот являются основными стадиями механизма образования «кислотных дождей».
Постановка темы и целей урока
Учитель: Кислотные дожди - эта тема и станет предметом нашего обсуждения сегодня. На сегодняшний день это одна из самых очевидных проблем загрязнения воздуха, стоящая перед человечеством. Ей уделяется большое внимание общественности. А что вы знаете о кислотных дождях?
Учитель ставит цель урока – углубить знания учащихся о кислотных дождях.
Задачи: - Выяснить источники и причины образования кислотных дождей
- Определить химические реакции, лежащие в основе их образования
- Установить вред, наносимый кислотными дождями окружающей среде
- Дать представление о средствах, предотвращающих выбросы загрязнителей
III. Изучение нового материала.
Учитель: Причиной возникновения кислотных дождей является массовые промышленные выбросы оксида серы (IV) и оксидов азота (II) и (IV). Диоксид серы хорошо растворим в воде, ядовит; вдыхание воздуха, содержащего 0,2% этого газа, вызывает заболевание дыхательных путей. Оксиды азота: NO – бесцветный газ и NO2 – бурый газ со специфическим запахом, ядовит (вызывает отек легких). Они обладают общетоксическим и раздражающим действием.
Учитель предлагает просмотреть видеофрагмент на тему «Кислотные дожди», состоящий из мультика про кислотный дождь, видеоряда и фрагмента телепередачи про кислотные дожди Первого канала.
Содержание видеофрагмента:
«Из этого видео вы узнаете, что такое кислотные дожди. Грозы, вулканы, лесные пожары, взрывы, заводы, выхлопные газы. Вы только, что просмотрели ряд факторов, влияющих на кислотность дождей. Все они выделяют окиси серы и азота. Ядовитые соединения, которые ступают в контакт с водой и возвращаются на землю в виде осадков.
Кислотные дожди приносят немало вреда нашей Земле… Окисление водоемов приводит к их заболачиванию и гибели водных обитателей. Так разрывается пищевая цепь, начинающаяся в водной экосистеме. Закисление почв приводит к растворению питательных веществ, растения гибнут или деградируют. Кислотные дожди разрушают архитектурные сооружения. Исторические памятники «тают» прямо на глазах. Возможно скоро мы лишимся культурного наследия?
И конечно же страдает здоровье человека. Кислотные дожди высвобождают из горных пород ртуть, алюминий и свинец, которые с грунтовыми водами попадают в наш организм, накапливаются и вызывают серьезные болезни: болезни печени, почек, органов дыхания, ЦНС, болезнь Альцгеймера.
Но все же у кислотных дождей есть и свой плюс! Новое исследование показывает, что эти дожди уменьшают выбросы парникового газа, производимые болотами, тем самым ослабляя парниковый эффект.
Так ли страшны кислотные дожди? На этот вопрос ответят наши коллеги с Первого канала…
Так что дождь не всегда так страшен. Для того, чтобы исправить проблему с дождями… Необходимо устанавливать на вредных производствах газоочистное оборудование. Необходимо принятие строгих законов, контролирующих деятельность всех загрязняющих атмосферу производств. Необходимо использование альтернативных источников энергии. Необходимо перестать собственноручно жечь мусор. Его нужно нести в утиль! И вообще, необходимо снизить количество кислотообразующих выбросов в атмосферу.
И под конец, добавим, не стоит ходить под дождем с непокрытой головой. Это вредно, и теперь вы знаете почему.»
После просмотра фильма учитель задает вопросы для первичного закрепления:
Откуда берутся ядовитые газы, порождающие кислотные дожди? Назовите природные источники?
Ответ: Вулканы, лесные пожары, грозы.
Назовите антропогенные источники?
Ответ:
Природное топливо, сжигаемое на электростанциях
Топливо, сжигаемое на промышленных предприятиях
Выхлопные газы автомобилей
Топливо, сжигаемое для приготовления пищи и обогрева домов.
Какие газы являются «виновниками» появления «кислотных дождей»?
Ответ: Оксиды серы и азота.
В каких районах наиболее вероятно выпадение «кислотных дождей»?
Ответ: В районах сосредоточения промышленных производств.
Что страдает от «кислотных дождей»?
Ответ: Растения, животные, человек, архитектурные сооружения и т.д.
Учитель: Кстати, 60% кислотности дождевой воды дает серная кислота, 30% - азотная, 5% - соляная кислота. Кислотный дождь - это дождь, подкисленный до рН
Кислоты концентрируются в снежном покрове. По мере нарастания снежного покрова во время зимы его кислотность увеличивается; верхние слои снега тают, и кислотные загрязняющие вещества опускаются вниз. Чем больше выпадает и тает снег, тем больше кислоты в нижнем слое. В результате стоит только снегу окончательно растаять, как почва испытывает настоящий «кислотный шок», который разрушает её структуру и убивает все живое в ней.
А теперь перейдем к практической части нашего урока.
IV. Закрепление.
Лабораторные опыты. (Приложение 1.)
Лабораторный опыт №1.
«Определение силы различных кислот»
Цель: определить силу кислот по значению pH.
Ход работы
В три пробирки наливаем воду и растворы лимонной и серной кислот. С помощью универсальной индикаторной бумажки определите рН растворов и результаты запишите в таблицу. Также в таблице сделайте вывод о силе кислот.
| Жидкость | Цвет индикатора | Значение рН | Вывод |
| Вода |
|
|
|
| Лимонная кислота |
|
|
|
| Серная кислота |
|
|
|
Вывод: обнаружить кислоту можно с помощью универсальной индикаторной бумажки, она в растворе кислоты _______________;
Лабораторный опыт №2
«Качественная реакция на серную кислоту».
Цель: провести качественную реакцию на сульфат-ионы.
Ход работы
В пробирку добавим 2-3 мл раствора хлорида бария BaCl2, выпал осадок __________ цвета, следовательно, в пробирке серная кислота.
Напишите уравнение реакции:________________________________________________
Вывод: обнаружить кислоту можно с помощью не только универсальной индикаторной бумажки, но и с помощью раствора хлорида бария BaCl2 - выпадет осадок __________ цвета.
Лабораторный опыт №3
«Исследование снега или дождевой воды на наличие кислотных осадков»
Ответьте на вопрос: возможны ли кислотные осадки на территории нашего района?
Цель: провести химический анализ образцов снега или дождевых вод, взятых около школы МБОУСОШ №4 с.Коноково.
Ход работы
В стакан с образцом снега или дождевой воды, взятого около школы, опустите универсальную индикаторную бумажку, она ______________(краснеет/синеет/ничего не происходит). Отлейте немного воды в пробирку и добавьте несколько капель раствора хлорида бария BaCl2, белый осадок ____________(образуется/не образуется).
Вывод: сульфат-ионы в образцах снега или дождевой воды, взятых около школы МБОУСОШ №4 с.Коноково, (присутствуют/отсутствуют)__________________________________________.
V. Подведение итогов. Работа в паре, взаимопроверка.
Закончите предложения:
Из списка SiO2, SO2, CO, NO2, SO3 выберите оксиды, которые приводят к образованию кислотных осадков.
2. В результате взаимодействия оксидов серы и азота с водой образуются . . . . . .
3. От кислотных дождей страдают . . . . . , . . . . . , . . . . . . и . . . . .
4. Что каждый из нас может сделать, чтобы уменьшить влияние кислотных дождей на природу?____________________________________________________________________________________________________________________________
VI. Домашнее задание. Осуществите цепочки превращений:
1. H2S →SO2 → H2SO3
2. C→ CO2 → H2CO3 → CaCO3 →Ca(HCO3)2 → CaCO3
VII. Выставление оценок.
VIII. Рефлексия.
Оцените свою работу на уроке___________________________________________
Что вам особенно понравилось на уроке?__________________________________
В чем польза этого урока для вас?_________________________________________
С какими трудностями вы столкнулись на уроке?___________________________



















