Формирование ключевых компетенций на уроках химии.
Одно из перспективных направлений модернизации образования – разработка идей компетентностного подхода в обучении. При этом подходе, помимо знаний и умений учащихся, важным показателем качества обучения становится наличие у них опыта решения жизненных проблем, социальных функций, практических навыков деятельности, т. е. сформированность того, что мы называем ключевыми компетенциями.
В свете современных требований к выпускнику, которые складываются под влиянием ситуации на рынке труда и таких процессов, как ускорение темпов развития общества и повсеместной информатизации среды, авторитарно-репродуктивная система обучения устарела. Образование, ориентированное только на получение знаний, означает в настоящее время ориентацию на прошлое. Будущий профессионал должен обладать стремлением к самообразованию на протяжении всей жизни, владеть новыми технологиями и понимать возможности их использования, уметь принимать самостоятельные решения, адаптироваться в социальной и будущей профессиональной сфере, разрешать проблемы и работать в команде, быть готовым к перегрузкам, стрессовым ситуациям и уметь быстро из них выходить.
Воспитание такой социально и профессионально активной личности требует от педагогов современной школы применения совершенно новых методов, приемов и форм работы. Чтобы сформировать компетентного выпускника во всех потенциально значимых сферах профессионального образования и собственно жизнедеятельности, необходимо применять активные методы обучения, технологии, развивающие, прежде всего, познавательную, коммуникативную и личностную активность нынешних школьников.
Одним из перспективных направлений в плане решения этой задачи является осуществление компетентностного подхода средствами технологии развития критического мышления.
Данный подход позволяет решить задачи по формированию компетенций у школьников, а именно:
– учебно-познавательной (определять цели и порядок работы, применять освоенные способы в новых ситуациях, осуществлять самоконтроль);
– коммуникативной (владеть способами взаимодействия с окружающими, владеть разными видами речевой деятельности);
– информационной (владеть навыками работы с различными источниками информации, самостоятельно перерабатывать информацию, ориентироваться в информационных потоках);
– личностного самосовершенствования (владение самоанализом, самоконтролем и коррекцией достигнутых результатов)
Цель и задачи мастер – класса:
- ознакомить (обзорно) коллег с основными принципами компетентностного обучения
- продемонстрировать эффективность компетентностного обучения на примере урока в 9классе «Кремний и его соединения»,
-показать практическое применение методов и приемов, форморганизации учебной деятельности, которые наиболее эффективнообеспечивают развитие учащихся
Урок по теме “Кремний и его соединения” (9-й класс)
с применением приемов технологии развития критического мышления, позволяющих формировать ключевые компетенции учащихся.
Цели урока: рассмотреть строение атома и аллотропию кремния, ознакомить учащихся с химическими свойствами кремния и его соединений; продолжить формирование информационных и коммуникативных компетенций.
Задачи урока:
Образовательные:
Сформировать представления учащихся о кремнии как о химическом элементе
Продолжить формирование умений давать характеристику химическому элементу по положению его в периодической системе, составлять схему строения атома.
Ознакомить учащихся с физическими и химическими свойствами кремния.
Ознакомить учащихся с наиболее значимыми соединениями кремния и их применением.
Развивающие:
Развивать умение определять закономерность между составом, строением, свойствами и применением веществ.
Продолжить формирование умений учащихся анализировать, сравнивать, делать выводы.
Воспитательные:
Воспитывать умения аккуратно вести записи в тетради.
Формировать у учащихся познавательной активности к изучаемому предмету путем привлечения их в творческий процесс
Ход урока
Урок начинается со стадии вызова.
Представьте себе - встает человек утром с постели, подходит к зеркалу, а вместо него - пустая рамка, ищет очки, а от них лишь одна оправа; вдруг он ощущает порывы ветра, так как в доме нет ни одного окна; от ужаса человек хочет выпить глоток воды, но не может найти ни одной чашки, стакана - вообще нет никакой в доме посуды - все бесследно исчезло! И это только начало ужаса: Далее треск, грохот - рушатся потолок, стены, они летят и рассыпаются, превращаясь в пыль и песок: Параллельно с этим выделяется огромное количество кислорода, который меняет состав воздуха, то есть земной атмосферы! А самое страшное, что впоследствии почти целиком исчезает земная кора, испаряются океаны и не существует больше жизнь на Земле. Что это за элемент и почему его исчезновение могло вызвать такие катастрофические изменения? Чтобы ответить на этот вопрос и сформулировать тему этого урокадемонстрируем слайд 1 презентации с изображениями скалы, кристалла аметиста, компьютера, фигурки из фарфора, стеклянной вазы.
- Что объединяет эти объекты между собой?
Ответ: Все они состоят из веществ, в состав которых входит кремний.
- Какие ассоциации у вас возникают при слове « кремний»?
Ответ: Прочный, твердый, камень.
Есть выражение «Не человек, а кремень».
Учитель говорит: тема нашего урока « Кремний и его соединения».
Название этого элемента произошло от латинского “ляпис креманс”, что значит – камень, дающий огонь. Так назывался твердый камень, дававший при ударе искру и долгое время служивший человеку вместо спичек для получения огня. Открыт Ж. Гей-Люссаком и Л. Тенаром в 1811г. Новому элементу было дано название “силиций” ( от лат. silex – кремень ). Русское название “кремний” введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе с греческогоkremnos – “утес, гора. Кремень по латыни «силекс», от этого слова происходит научное название элемента- «силициум».
Почему кремний незаменимый элемент? Почему все изображения на слайде относятся к теме урока? На эти вопросы предстоит ответить на данном уроке.
Блеф-игра«Верите ли вы, что…» (некоторые высказывания)
В эпоху палеолита, т.е. 800 тысяч лет тому назад, кремний помог человеку в борьбе за жизнь. Этот твердый камень, от которого легко отбить кусок с острыми краями, послужил материалом для первого оружия (наконечником копий и стрел) и первых орудий труда (топоров, ножей и т.д.).
Позднее, когда на смену камню пришли медь, бронза, железо, кремень нашел использование в виде огнива.
Мировые компьютерные компании находятся в «Кремниевой долине». Именно кремний служит материалом для изготовления современных процессоров.
Современный процессор является самым сложным готовым продуктом на Земле. Инженеры-технологи научились изготавливать процессоры из песка.
Используя прием “Мозговой штурм”, предлагаем учащимся ответить на вопрос:
Расскажите о положении кремния в Периодической системе химических элементов Д. И. Менделеева?
Составьте химические формулы известных вам соединений кремния?
Учащиеся работают в тетрадях, затем проверяем выполнение задания (один учащийся у доски).
Используя прием “Корзина идей, понятий, имен”, предлагаем учащимся ответить на вопрос:
Что вам известно о кремнии и его соединениях?
Каждый учащийся вспоминает и записывает в своей тетради все, что знает по данному вопросу (1 – 2 минуты). Затем идет обмен информацией в парах, рабочих группах, при этом вырабатываются сведения в виде тезисов. После этого каждая группа называет один факт, не повторяя идеи, высказанные другими группами. Учитель заносит все тезисы на доску, в “корзину идей”.
В результате обмена мнениями получается список идей:
Кремний – неметалл.
Кремний – твердое вещество.
Оксид кремния – кислотный оксид.
Оксид кремния – это песок.
Кремниевая кислота – нерастворима в воде.
Кремний содержится во многих минералах.
Кремний и его соединения имеют широкое применение.
На стадии осмысления используем прием “Зигзаг”. Предлагаем учащимся разойтись в экспертные группы (четыре группы по количеству текстов “Кремний и его свойства”; “Оксид кремния(IV)”; “Кремниевая кислота”; “Соли кремниевой кислоты”) и прочитать учебные тексты (тексты составляет сам учитель, исходя из уровня класса, имеющихся знаний, целей учебного занятия), обсудить информацию, разработать алгоритм ее презентации для членов рабочей группы.
В ходе работы с учебным текстом каждая группа составляет информации по плану:
1. Особенности строения.
2. Физические свойства.
3. Нахождение в природе.
4. Химические свойства.
5. Применение.
Завершает урок стадия рефлексии. Предлагаем учащимся обменяться информацией, полученной от участников других групп заполнить опорную схему “Кремний и его соединения”.
По окончанию данной работы от каждой рабочей группы представляется один из блоков опорной схемы. В конце урока выполняем рефлексивный тест
ТЕСТ:
+ «Я согласен» ─ «Я не согласен»
1. Я узнал (а) много нового.
2. Мне это пригодится в жизни.
3. На уроке было над чем подумать.
4. На все возникшие у меня в ходе урока вопросы я получил (а) ответы.
5. На уроке я поработал (а) добросовестно и цели урока достиг (ла).
«Кремний и его свойства»
Кремний (лат. silicium) во многом похож на углерод. По распространенности в земной коре кремний занимает второе место после кислорода ( 28% по массе). В природе существует только в связанном виде, в основном в виде оксида кремния или кремнезема SiO2. Применяют кремний в основном для получения сплавов, восстановления металлов из оксидов, для изготовления полупроводниковых приборов.
В небольших количествах кремний получают восстановлением из кремнезема различными металлами:
SiO2 + 2Mg = 2MgO + Si
В промышленности кремнезем восстанавливают углем в электрических печах:
SiO2 + 2C= Si + 2CO
Структура свободного кремния аналогична алмазу. Кремний - типичный полупроводник. Электронная конфигурация внешнего электронного слоя атома кремния 3s23p2. Кремний, как и углерод, четырехвалентен, валентные электроны находятся на s- и р-орбиталях. Однако в отличие от углерода атомы кремния p-связей, т.е. двойных и тройных связей друг с другом образовывать не могут. Поэтому для кремния не характерна аллотропия, он образует только одну модификацию.
В химическом отношении кремний, особенно кристаллический, мало активен, но активнее углерода. Во всех соединениях кремний четырехвалентен. При обычной температуре он непосредственно реагирует только с фтором:
Si + 2F2 = SiF4
Реакционная способность аморфного кремния выше, чем кристаллического. Например, при высокой температуре он взаимодействует с кислородом:
Si + O2 = SiO2
Кремний энергично реагирует с растворами щелочей:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Кремний образует также соединение с водородом - силан SiH4.
С углеродом кремний образует карборунд SiC
Кремний в организме находится в виде различных соединений, участвующих главным образом в образовании твердых скелетных частей и тканей. Особенно много кремния могут накапливать некоторые морские растения (например, диатомовые водоросли) и животные (например, кремнероговые губки, радиолярии), образующие при отмирании на дне океана мощные отложения оксида кремния (IV). Среди наземных растений много кремния накапливают злаки, осоки, пальмы, хвощи. В наибольших количествах кремний обнаружен в плотной соединительной ткани, почках, поджелудочной железе.
“Оксид кремния (IV)”.
“Наиболее распространенным соединением кремния является его диоксид SiO2 – оксид кремния (IV), другое его название – кремнезем. В природе он образует минерал кварц и многие разновидности (горный хрусталь, аметист, агат, опал, яшма, халцедон, сердолик), которые известны как поделочные и полудрагоценные камни. Диоксид кремния – это также обычный и кварцевый песок.
Оксид кремния (IV), как и углекислый газ, является кислотным оксидом. Однако в отличие от CO2 имеет не молекулярную, а атомную кристаллическую решетку такого строения:
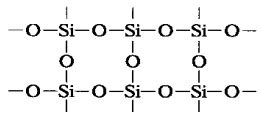
Поэтому SiO2 твердое и тугоплавкое вещество. Он не растворяется в воде и кислотах (кроме плавиковой), но взаимодействует при высоких температурах со щелочами с образованием солей кремниевой кислоты – силикатов:
SiO2 + 2NaOH = Na2SiO3 + H2O
Силикаты можно получить также сплавлением диоксида кремния с оксидами металлов или с карбонатами:
SiO2 + CaO = CaSiO3
SiO2 + CaCO3 = CaSiO3 + CO2
При сплавлении кварцевого песка с углем при высоких температурах образуется карбид кремния SiC, который по твердости уступает только алмазу. Поэтому его используют для затачивания резцов металлорежущих станков и шлифовки драгоценных камней. Из расплавленного кварца изготавливают кварцевую химическую посуду, которая выдерживает высокую температуру и не трескается при резком охлаждении. Диоксид кремния служит основой силикатной промышленности – для производства стекла и цемента.
Диоксид кремния необходим для жизни растений и животных. Он придает прочность стеблям растений и защитным покровам животных”
Кремниевая кислота
Кремний может образовывать несколько кислот, но все они называются кремниевыми кислотами.Они могут иметь разное расположение атомов в молекуле и разные химические формулы: H2Si2F2, H4SiO4 и др. Чаще всего состав кремниевой кислоты обозначается формулой H2SiO3.
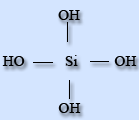
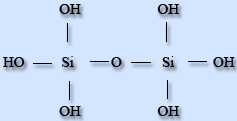
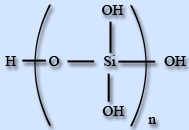
H4SiO4H6Si2O7H2SiO3
В природе находятся в основном в виде солей, в свободной форме выделены немногие, например, HSiO (ортокремниевая) и H2SiO3 (кремниевая или метакремниевая).Так как диоксид кремния с водой не взаимодействует, то кремниевая кислота получается косвенным путем - взаимодействием растворимых силикатов щелочных металлов с кислотами:
Na2SiO3 + 2 HCl = 2NaCl + H2SiO3
В момент получения это прозрачное студневидное вещество, практически нерастворимое в воде. Такой студень имеет и другое название - гель. Кремниевая кислота - самая слабая из минеральных кислот, она почти не диссоциирует в растворах, не окрашивает индикаторов. Также оно неспособно разъедать ткани или вызывать ожоги на коже, как другие кислоты. Это очень неустойчивое вещество — частичное разложение кремниевой кислоты может произойти даже при невысокой температуре.
H2SiO3 = H2O + SiO2
Взаимодействует с растворами щелочей, образуя соли-силикаты:
H2SiO3 + 2NaOH = Na2SiO3 + 2H2O
Гель кремниевой кислоты можно высушить, он при этом приобретает пористое строение с большой внутренней поверхностью, способной поглощать (адсорбировать) пары воды и многих органических веществ. Поэтому силикагель используется для осушения газов, разделения смесей. Он может быть и носителем мелко раздробленных катализаторов - это считается одним из важнейших его качеств. Кроме того, и сам силикагель может быть катализатором. Выпускаются и силикагели специального назначения: индикаторы влажности, гели для холодильников и др. Кремниевую кислоту легко получить в домашних условиях. Для этого в пробирку нужно налить вдвое разбавленный силикатный клей - раствор силиката натрия или калия, а потом добавить к нему при перемешивании раствор соляной или серной кислоты. Жидкость на глазах начнет превращаться в прозрачный густой студень. Если перевернуть пробирку, то из него выльется жидкость - раствор полученной соли, а сама кремниевая кислота останется в пробирке, и ее можно будет внимательно рассмотреть.
Соли кремниевой кислоты
Соли кремниевой кислоты называются силикатами. Их состав обычно изображают формулой в виде соединений оксидов элементов. Например, силикат кальция СаSiО3 можно выразить так: СаО*SiО2 .
Силикаты состава R2 О*nSiO2 , где R2 О — оксиды натрия или калия, называются растворимым стеклом ,а их концентрированные водные растворы — жидким стеклом . Наибольшее значение имеет натриевое растворимое стекло. В технике его получают как сплавлением кварцевого песка с содой, так и обработкой аморфного кремнезема концентрированным раствором щелочи:
SiO2 + Na2 CO3 = Na2 SiO3 + CO2
SiO2 + 2NaOH = Na2 SiO3 + H2 O
Жидкое стекло применяется в качестве связующего при изготовлении кислотоупорных бетонов, а также для изготовления замазок, конторского клея. Им пропитывают ткани, дерево и бумагу для придания им огнестойкости и водонепроницаемости.
Силикаты широко распространены в природе.Земная кора состоит из оксида кремния (IV) и различных силикатов. Свойства силикатов различны в зависимости от их состава и строения, очень часто они имеют красивую окраску, некоторые из них используются в ювелирном деле (гранат, топаз, изумруд).Природные силикаты имеют сложный состав и строение.Вот состав некоторых природных силикатов:
Полевой шпат K 2 O * Al 2 O 3 *6 SiO 2 Асбест 3 MgO *2 SiO 2 *2 H 2 O
Слюда К2 O *3 Al 2 O 3 *6 SiO 2 *2 H 2 O Каолинит Al 2 O 3 *2 SiO 2 *2 H 2 O
Силикаты, содержащие в своем составе также оксид алюминия, называются алюмосиликатами . Из названных выше силикатов алюмосиликатами являются полевой шпат, каолинит и слюда. В природе наиболее распространены именно алюмосиликаты, например полевые шпаты. Распространены также смеси различных силикатов. Так, горные породы — граниты и гнейсы — состоят из кристалликов кварца, полевого шпата и слюды.
Горные породы и минералы, находясь на поверхности Земли, вступают во взаимодействие с водой и воздухом, что вызывает их изменение и разрушение. Этот процесс называется выветриванием. Процесс выветривания полевого шпата можно выразить уравнением реакции
K2 O*Al2 O3 *6SiO2 +2H2 O+ CO2 = Al2 O3 *2SiO2 *2H2 O+ K2 CO3 + 4SiO2
Основным продуктом разрушения является минерал каолинит — главная составная часть белой глины. В результате выветривания горных пород образовались залежи глины, песка и солей.
Рефлексивный тест:
+ «Я согласен» ─ «Я не согласен»
1. Я узнал (а) много нового.
2. Мне это пригодится в жизни.
3. На уроке было над чем подумать.
4. На все возникшие у меня в ходе урока вопросы я получил (а) ответы.
5. На уроке я поработал (а) добросовестно и цели урока достиг (ла).




















