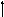Подробный конспект образовательного мероприятия
| Организационная информация |
| Автор/ы урока/занятия/мероприятия (ФИО) | Минакова Алла Петровна |
| Должность | Учитель химии |
| Образовательное учреждение | МБОУ «Гимназия №44» |
| Город/поселение | Г. Курск |
| Предмет | химия |
| Класс, профиль класса/ коллектив/ группа | 9 А класс, общеобразовательный |
| Продолжительность урока/мероприятия | 45 минут |
| Методическая информация |
| Тема урока /занятия/мероприятия
| «Реакции ионного обмена и условия их протекания» |
| Тип урока | Урок изучения и первичного закрепления новых знаний |
| Методы | исследование с использованием элементов проблемной ситуации |
| Формы организации работы обучающихся | Работа в парах, индивидуальная |
| Цели урока/ занятия/ мероприятия
| Углубить изучение реакции обмена, заложенные в курсе 8 класса; сформировать понятие необратимых реакций ионного обмена. Выяснить условия протекания реакций ионного обмена в растворах электролитов до конца. |
| Задачи урока/ занятия/ мероприятия
| Образовательные: повторить типы химических реакций, признаки их протекания; формировать знания о реакциях ионного обмена, протекающих с образованием конечного продукта; формировать умения составления полного и сокращенного ионного уравнений на основе молекулярного; Воспитательные: воспитание активной личности: умения проявлять инициативу, отстаивать собственную позицию, быть коммуникативным; активизация познавательной деятельности учащихся в групповой работе по разрешению проблемной ситуации; способствование формирования коммуникативных способностей учащихся; создание ситуации успеха. воспитывать толерантные отношения в группе, классе. Развивающие: развитие мышления, речи, творческих способностей, познавательного интереса к предмету; развитие навыков работы с химическими реактивами; соблюдая правила безопасной работы с ними; развитие умения выдвигать гипотезы, анализировать полученные результаты, делать выводы. развивать умение логично излагать свою точку зрения; учить приемам рефлексии, развивать адекватную самооценку; развивать умение получать информацию, в том числе и с помощью информационных технологий. |
| Знания, умения, навыки и качества, которые актуализируют/приобретут/закрепят/др. ученики/коллектив в ходе урока / занятия/ мероприятия
| Учащиеся должны знать: · Обратимые и необратимые реакции обмена. · Правила составления ионных уравнений реакций . · Правила Бертолле. · Признаки химических реакций обмена. Учащиеся должны уметь: Составлять ионные уравнения реакции на основе молекулярных. Пользоваться таблицей растворимости кислот, солей и оснований. Проводить лабораторный опыт. Должно появиться в тетрадях ученика(цы): · Уравнения реакций ионного обмена. · Правила составления ионных уравнений реакций · Наблюдения по демонстрационным опытам.
Основные понятия и термины урока: Ионы, катионы, анионы, электролит, ионное уравнение реакции, правило Бертолле. |
| Учебный материал, подлежащий усвоению, актуализации, закреплению
| Молекулярное уравнение реакции обмена, полное ионное уравнение реакции обмена, сокращенное уравнение реакции обмена, правило составление ионных уравнений, признаки реакций обмена. |
| Необходимое оборудование, материалы и другие условия для качественного проведения урока | Мультимедийный проектор, учебник Рудзитиса Г.Е., Фельдмана Ф.Г. «Химия 9», М.:Просвещение, 2010-13 г. г., таблица растворимости кислот, солей оснований, инструктивная карта урока, рабочая тетрадь. Реактивы: карбонат натрия, хлорид бария, хлорид калия, нитрат натрия, сульфат меди (II), соляная кислота, серная кислота, гидроксид натрия, фенолфталеин. Оборудование: пробирки, лабораторный штатив.
|
Технологическая карта урока
| Этапы урока | Содержание деятельности учителя | Деятельность обучающихся | УУД, которые формируются на данном этапе | Ключевые компетентности, которые формируются на данном этапе урока |
| 1.Организационный момент | Приветствие, проверка готовности к уроку, вступительное слово учителя. Мотивация учебной деятельности на успешную работу. | Настраиваются на урок |
|
|
| 2. Актуализация знаний |
|
|
|
|
|
|
|
|
|
|
Конспект урока.
I. Организационный момент.
II. Актуализация знаний.
-Скажите, ребята, какую тему мы начали изучать с вами на прошлых уроках? (Теория электролитической диссоциации)
-А кто из ученых внес наибольший вклад в создание ТЭД? (Шведский ученый С. Аррениус)
-Сегодняшний урок мы с вами начнем с письма этого великого ученого к вам, потомкам 21 века
«Дорогие ученики ! Приветствую вас на любимом мною уроке химии. Я жил и сделал свое открытие о диссоциации веществ в конце 19 века, за этот труд получил Нобелевскую премию. Признаюсь вам, что это было нелегко. Мне очень интересно, как потомки в 21 веке понимают процессы диссоциации. Поэтому предлагаю разрешить следующие противоречия:
1) Почему между сухими солями ВаСl2 и Na2SO4 нет реакции, а между их растворами реакция идет?
2) Почему нет реакции между растворами NaOH и КNО3?
Буду рад всем вашим мыслям и идеям! Успехов в изучении науки!»
-Прежде чем мы попытаемся найти ответы на вопросы С. Аррениуса, давайте выясним, какого типа реакции предлагает рассмотреть нам ученый? (Реакции обмена)
-Как и любые другие реакции, реакции обмена характеризуются определенными признаками, давайте их вспомним.
(Выпадение осадка, выделение газа, образование воды).
- До изучения ТЭД реакции обмена рассматривались как взаимодействие молекул кислот, оснований и солей. Теперь вам известно, что в растворах этих веществ молекул практически нет, а имеются ионы водорода, гидроксид-ионы, ионы металлов и кислотных остатков. Отсюда следует логический вывод. Реакции между растворами этих веществ сводятся к взаимодействию ионов.
-Как можно объяснить с позиции ТЭД отсутствие реакции между сухими солями? (В сухом состоянии электролиты не образуют ионы)
-Но почему же тогда не происходит реакция между растворами гидроксида натрия и нитрата калия? Ведь оба эти вещества являются сильными электролитами, значит в растворе они практически полностью распадаются на ионы. На этот вопрос и некоторые другие нам и предстоит ответить на сегодняшнем уроке. Но так мы выяснили, что реакции обмена идут между ионами, то такие реакции называют ионными, а уравнения их описывающие – ионными уравнениями.
Обучающиеся записывают определение ионных уравнений.
Реакции между ионами называют ионными реакциями, а уравнения таких реакций – ионными уравнениями.
III. Целеполагание.
-Давайте с вами попробуем сформулировать цель нашего урока. (Научиться проводить и записывать реакции ионного обмена)
IV. Изучение нового материала.
СТАДИЯ «ВЫЗОВА»
-В изучении реакций ионного обмена особый след оставил другой великий французский ученый – Клод Луи Бертолле.
-Скажите, кому-нибудь из вас знакомо это имя? (-В честь этого ученого названа бертолетова соль, которую он впервые получил)
-Верно. Из всех хлоратов бертолетова соль находит самое широкое применение. Она используется в производстве красителей, спичек (делают горючее вещество спичечной головки, сырьем является увлажненный хлорат калия по ТУ 6-18-24-84), фейерверков, дезинфицирующих средств, диоксида хлора. Из-за высокой опасности составов с хлоратом калия они практически не применяются в производстве взрывчатых веществ для промышленных и военных целей. Очень редко хлорат калия применяется в качестве инициирующего взрывчатого вещества. Иногда используется в пиротехнике, в результате получают цветнопламенные составы. Раньше соль применяли в медицине: слабые растворы этого вещества (KClO3) некоторое время применялись как антисептик для наружного полоскания горла. Соль в начале 20 века использовали для получения кислорода в лабораторных условиях, но из-за опасности экспериментов они были прекращены.
-Бертолле изучал условия протекания реакций ионного обмена и вывел три правила при которых эти реакции идут до конца.
Реакции ионного обмена идут до конца при условии:
Выпадения осадка в ходе реакции
Выделении газа.
Образовании малодиссоциирующего вещества, например, воды.
-Теперь вы можете приступить к выполнению экспериментальной части нашего урока.
СТАДИЯ «ОСМЫСЛЕНИЕ»
-Перед началом работы внимательно прочтите все рекомендации по выполнению эксперимента и правила ТБ
Экспериментальная часть.
Эксперимент №1.
В пустую пробирку налить около 1 мл раствора карбоната натрия и прилить к нему такое же количество соляной кислоты.
-Что наблюдали? -Запишите свои наблюдения в таблицу.
Эксперимент №2.
В пробирку налейте 1 мл раствора гидроксида натрия, добавьте к раствору 1 каплю фенолфталеина и около 1 мл раствора соляной кислоты.
-Запишите свои наблюдения в таблицу.
Эксперимент №3.
-В пробирку налейте 1 мл хлорида бария и добавьте к нему такое же количество сульфата натрия. Запишите свои наблюдения в таблицу.
-В пробирку налейте 1 мл сульфата меди и добавьте к нему несколько капель NaOH. Запишите свои наблюдения в таблицу.
--В пробирку налейте 1 мл хлорида железа (III) добавьте к нему несколько капель NaOH. Запишите свои наблюдения в таблицу.
Эксперимент №4.
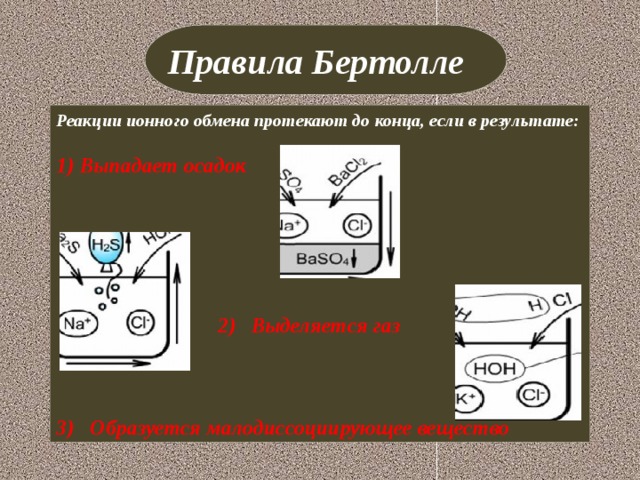
-Четвертый эксперимент мы проведем с реактивами, предложенными С. Аррениусом.
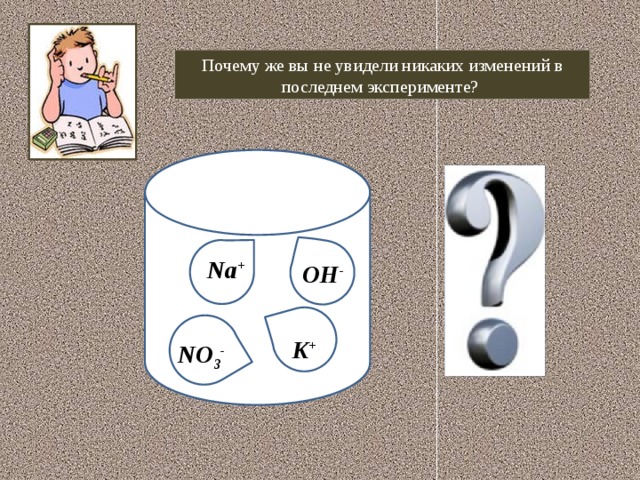
- В пробирку налейте 1 мл нитрата калия и добавьте к нему несколько капель NaOH. Запишите свои наблюдения в таблицу.
-Почему в последнем опыте вы не увидели никаких изменений, давайте разберемся, составив уравнения проведенных реакций ионного обмена.
Учитель знакомит обучающихся с алгоритмом составления реакций ионного обмена
Правила:
Простые вещества, оксиды, а также нерастворимые кислоты, основания и соли не диссоциируют.
Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
Если малорастворимое вещество образуется в результате реакции , то при записи ионного уравнения его считают нерастворимым.
Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
| Алгоритм составления ионного уравнения реакции | Пример |
| 1. Записать молекулярное уравнение реакции. 2. С помощью таблицы растворимости определить растворимость каждого вещества. 3. Составить полное ионное уравнение. 4. Составить сокращенное ионное уравнение (найти одинаковые ионы и сократить их слева и справа) Оставшиеся ионы выписать в сокращенное ионное уравнение. |  Na2CO3 + 2HCl = 2NaCl+H2O+CO2  Р Р Р Р Р Р 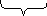 Na2CO3 + 2HCl = 2NaCl+H2O+CO2 Na2CO3 + 2HCl = 2NaCl+H2O+CO2  Оксиды не электролиты и на ионы не расписываются Оксиды не электролиты и на ионы не расписываются 2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl-+ H2O+CO2      2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl-+ H2O+CO2 2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl-+ H2O+CO2 
CO32- + 2H+= H2O+CO2 |
Пользуясь алгоритмом обучающиеся записывают ионные уравнения проделанных реакций, делают выводы.
- Так почему же вы не увидели никаких изменений в последнем эксперименте? (Потому что эта реакция не протекает до конца, т.к. в ней не соблюдается ни одно из правил Бертолле)
V. Рефлексия.
|
1.На уроке я работал |
активно / не очень/пассивно |
| 2.Своей работой на уроке я | доволен / не доволен |
| 3.Урок для меня показался | интересным / не интересным |
| 4.Материал урока мне был | понятен / не понятен |
| 5. Полученные на уроке знания | Пригодятся/ не пригодятся в повседневной жизни |
| 6.Мое настроение |    |
VI. Домашнее задание.
Творческие задачи.
Карбонат кальция входит в состав зубных паст. Его готовят химическим взаимодействием карбоната натрия и какой-либо растворимой соли кальция. Напишите уравнение этой реакции в молекулярном, полном ионном и сокращенном ионном виде.
Иодид серебра используют для уничтожения градовых облаков. Мелкие кристаллы этой соли, попадая в облако, служат центрами кристаллизации воды, и вместо крупных градин на землю выпадает мелкая снежная крупа или дождь. Напишите молекулярное, полное ионное и сокращенное ионное уравнения реакции получения иодида серебра взаимодействием двух солей.
Для улучшения внешнего вида жемчужин их помещают в раствор кислоты. Верхний потускневший или поцарапанный слой растворяется, и открывается свежий, блестящий слой. Предложите кислоту для осуществления этого процесса. Запишите уравнение химической реакции в молекулярном, полном ионном и сокращенном ионном виде, зная, что жемчуг на 86% состоит из карбоната кальция.
Материал для отработки темы
В молекулярном уравнение – расставьте коэффициенты. Составьте полные и сокращенные ионные уравнения реакции. Укажите причину протекания каждой реакции
| Вариант 1, 11, 21 1. KCl+AgNO3→KNO3+AgCl 2. NaOH+FeCl2→Fe(OH)2+NaCl 3. K2CO3+HNO3→KNO3+H2O+CO2 4. Ca(OH)2+H2SO4→CaSO4+H2О 5. HCl+Na2SO4→NaCl+H2SO4 | Вариант 2, 12, 22 1. NaOH+HNO3→NaNO3+H2O 2. KOH+Fe(NO3)2→Fe(OH)2+KNO3 3. Na2CO3+HCl→NaCl+H2O+CO2 4. Ba(OH)2+HNO3→Ba(NO3)2+H2O 5. NaOH+KCl→KOH+NaCl |
| Вариант 3, 13, 23 1. KCl+Pb(NO3)2→KNO3+PbCl2 2. NaOH+CuCl2→Cu(OH)2+NaCl 3. K2CO3+HCl→KCl+H2O+CO2 4. NaOH+H2SO4→Na2SO4+H2О 5. HCl+K2SO4→KCl+H2SO4 | Вариант 4, 14, 24 1. KOH+H2SO4→K2SO4+H2O 2. KOH+Zn(NO3)2→Zn(OH)2+NaNO3 3. Na2SO3+HCl→NaCl+H2O+SO2 4. KOH+HNO3→KNO3+H2O 5. KOH+NaCl→NaOH+KCl |
| Вариант 5, 15, 25 1 Na2SO4+BaCl2→BaSO4+NaCl 2. NaOH+AlCl3→Al(OH)3+NaCl 3. K2SO3+HNO3→KNO3+H2O+SO2 4. Ca(OH)2+H2SO4→CaSO4+H2О 5. HCl+Na2SO4→NaCl+H2SO4 | Вариант 6, 16, 26 1. KOH+HNO3→NaNO3+H2O 2. KOH+Al(NO3)3→Al(OH)3+KNO3 3. K2CO3+HCl→NaCl+H2O+CO2 4. Ca(OH)2+HNO3→Ca(NO3)2+H2O 5. NaOH+KCl→KOH+NaCl |
| Вариант 7, 17 1. CuCl2+Pb(NO3)2→Cu(NO3)2+PbCl2 2. NaOH+ZnCl2→Zn(OH)2+NaCl 3. CaCO3+HCl→CaCl2+H2O+CO2 4. KOH+H2SO4→K2SO4+H2О 5. HCl+K2SO4→KCl+H2SO4 | Вариант 8, 18 1. NaOH+H2SO4→Na2SO4+H2O 2. KOH+Cu(NO3)2→Cu(OH)2+NaNO3 3. K2SO3+HCl→KCl+H2O+SO2 4. NaOH+HNO3→KNO3+H2O 5. KOH+NaCl→NaOH+KCl |
| Вариант 9, 19 1. H2SO4+BaCl2→BaSO4+HCl 2. KOH+AlCl3→Al(OH)3+KCl 3. Na2SO3+HCl→NaCl+H2O+SO2 4. Ca(OH)2+HNO3→Ca(NO3)2+H2О 5. HCl+Na2SO4→NaCl+H2SO4 | Вариант 10, 20 1. KOH+H2SO4→K2SO4+H2O 2. KOH+Fe(NO3)3→Fe(OH)3+KNO3 3. K2CO3+HNO3→NaNO3+H2O+CO2 4. Ba(OH)2+HNO3→Ba(NO3)2+H2O 5. NaOH+KCl→KOH |