Bochegova@
14.01.23
- Азот и фосфор- элементы V группы, главной подгруппы.
- Заряд ядра атома N равен +7 , атома P - +15 ,
- На последнем энергетическом уровне атомов азота и фосфора находится по 5 электронов. Электронная конфигурация валентного уровня - ns 2 np 3 .
- Радиус атома азота меньше радиуса атома фосфора.
- От азота к фосфору уменьшаются неметалличность, электроотрицательность, окислительная способность, а восстановительная способность возрастает .
- До устойчивого состояния атомы этих элементов могут присоединять по 3 электрона или отдавать по 5 электронов. Отсюда для азота и фосфора характерна высшая степень окисления +5 , низшая степень окисления -3 .
- Формулы высших оксидов: оксид азота (V) N 2 О 5 , оксид фосфора ( V) Р 2 О 5 . Высшие оксиды и гидроксиды азота и фосфора имеют кислотный характер.
8. Азот образует летучее водородное соединение NH 3 аммиак , фосфор – РН 3 фосфин .

14.01.23
Bochegova@
В 1787 г. А.Лавуазье установил, что «жизненный» и «удушливый» газы, входящие в состав воздуха, это простые вещества.
Он предложил название «азот».
«азот» -«безжизненный»
(греч. «а» – отрицание, «зоэ» – жизнь)
«фосфор» -«светоносец»
(греч. «фос» – свет и «феро» – несу)
Фосфор открыт гамбургским алхимиком Хеннингом Брандом в 1669 г.
1772 г. – открытие азота
Д.Резерфорд, сжигая фосфор и другие вещества в стеклянном колоколе, показал, что остающийся газ не поддерживает дыхания и горения. Д.Резерфорд назвал его «удушливым воздухом».

Bochegova@
14.01.23
Урок химии в 9 классе
Бочегова Ольга Александровна,
учитель химии МБОУ СОШ № 14, г. Полевской, Свердловская область
2012год

14.01.23
Bochegova@

14.01.23
Bochegova@
азот
фосфор
ковалентная неполярная связь, молекулярная кристаллическая решетка
Аллотропные модификации
- бесцветный газ
- без запаха
- малорастворим в Н 2 О
- T кип. = -196 0 C
- T пл. =-210 0 С
Не ядовит, не
поддерживает
дыхания, не горюч.
БЕЛЫЙ ФОСФОР
КРАСНЫЙ ФОСФОР

14.01.23
Bochegova@
- воскообразное вещество бледно-желтого цвета
- чесночный запах
- растворим в сероуглероде, не растворим в Н 2 О
- ядовит!
- светится в темноте!
- Т воспламенения = +40 0 С
- T пл. =+44 °С
Р 4
ковалентная неполярная связь, молекулярная кристаллическая решетка

14.01.23
Bochegova@
Р n
Ковалентная неполярная связь, атомная кристаллическая решетка
- твердое вещество темно-красного цвета
- без запаха
- нерастворим в Н 2 О и сероуглероде
- не светится
- безвреден
- Т воспламенения = +260 0 С
- Тпл.=600 °С
ОПЫТ

14.01.23
Bochegova@
Просмотрите фрагмент. Прокомментируйте его с химической точки зрения .
«Да! Это была собака, огромная черная, как
смоль. Но такой собаки еще никто из нас,
смертных, не видывал. Из ее отверстой пасти
вырывалось пламя, глаза метали искры, по
морде и загривку переливался мерцающий
огонь. Ни в чьем воспаленном мозгу не
Могло возникнуть видение более страшное,
более омерзительное, чем это адское
существо, выскочившее на нас из тумана...
… .Я дотронулся до этой светящейся головы и,
отняв руку, увидел, что мои пальцы тоже
засветились в темноте.
-Фосфор- сказал я".
Артур Конан-Дойл.
"Собака Баскервилей"
Bochegova@
14.01.23
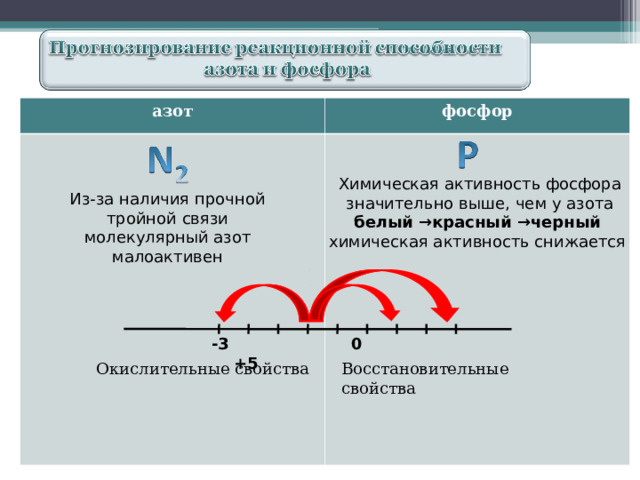
азот
фосфор
Химическая активность фосфора значительно выше, чем у азота
белый →красный →черный
химическая активность снижается
Из-за наличия прочной тройной связи молекулярный азот малоактивен
- 3 0 +5
Восстановительные свойства
Окислительные свойства

14.01.23
Bochegova@
азот
фосфор
Н 2 + N 2
При обычных условиях реагирует только с литием, образуются нитриды:
Li + N 2 =
Фосфор реагирует с металлами с образованием фосфидов:
Li + P =
Са + N 2 =
Н 2 + Р =
Ca + P =
Взаимодействие с металлами
-
-
3 е
6 е
+1 -3
+1 -3
Li N
0
t o c
0
3
Li P
0
0
2
6
3
3
фосфид лития
нитрид лития
-
-
6 е
6 е
+ 2 -3
t o c
+2 -3
t o C
0
Са Р
0
0
0
Ca N
3
3
2
2
3
2
3
фосфид кальция
нитрид кальция
-
Взаимодействие с водородом
6 е
-3 +1
p, t o , Fe
0
0
3
NH
2
3
аммиак

Bochegova@
14.01.23
Только под действием электрического разряда азот реагирует с O 2 :
N 2 + О 2
Фосфор легко окисляется
кислородом:
Азот непосредственно не взаимодействует
с галогенами и сер ой
Р + С l 2 =
Р + О 2 =
Взаимодействие с кислородом
-
-
4 е
20 е
2
+2 -2
+ 5 - 2
NO
3 000 o C
0
0
0
0
4
P О
t o c
2
5
5
2
оксид азота (II)
ок-тель
в-тель
o ксид фосфора ( V )
в-тель
ок-тель
Взаимодействие с галогенами, серой
-
10 е
+5 -1
t o c
0
0
Р Cl
2
2
5
5
хлорид фосфора (V)

Bochegova@
14.01.23
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль
0 +5 -1 + 5
P + KClO 3 = KCl + P 2 O 5
-1
-
+5
Cl
Cl
+ 6 e =
∙ 5 восстановление
5
5
ок-тель
+5
0
-
∙ 6 окисление
P
6
P
3
- 5 e =
в-тель

14.01.23
Bochegova@
Сырье: апатиты или фосфориты, кокс, песок
Процесс: восстановление фосфата кальция коксом в электропечи при температуре 1500°С.
фосфорит
- Сырье: воздух
- Процесс: перегонка сжиженного воздуха
- Первым отгоняется азот так сжижается при более низкой температуре, чем кислород:
- tкипN 2 = - 196 0 С
- tкипО 2 = - 183 0 С
Са 3 (РО 4 ) 2 + 5 С + 3SiO 2 =2P + 5CO +3CaSiO 3
кокс
песок
шлак

14.01.23
Bochegova@

Bochegova@
14.01.23
Белый фосфор используют в военном деле для зажигательных бомб, а также для дымообразующих снарядов, шашек и гранат, дающих дымовые завесы.
Красный и белый фосфор используют при получении йодистоводородной и бромистоводородной, фосфорной кислот.
Красный фосфор применяют в спичечном производстве.
Фосфид цинка Zn 3 Р 2 применяют для борьбы с грызунами.
Bochegova@
14.01.23
Верны ли следующие суждения о фосфоре?
А. Белый фосфор ядовит и дает труднозаживающие ожоги
Б. Фосфор – необходимый элемент в организме человека
Фосфор проявляет степень окисления +5 в соединении
Электронная конфигурация внешнего энергетического уровня атома азота
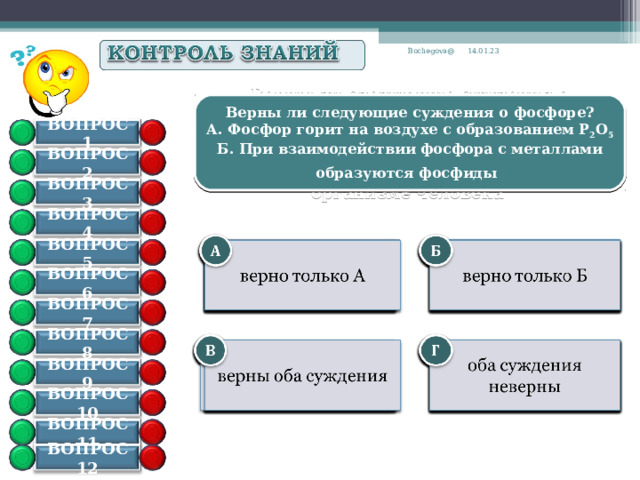
Верны ли следующие суждения о фосфоре?
А. Фосфор горит на воздухе с образованием P 2 O 5
Б. При взаимодействии фосфора с металлами образуются фосфиды
Фосфор не реагирует с веществом, формула которого:
Азот проявляет свойства восстановителя
в реакции с
Верны ли следующие суждения о свойствах азота?
А. Азот является более слабым восстановителем, чем фосфор
Б. Азот является окислителем в реакции с водородом
Химическая активность аллотропных форм фосфора увеличивается в ряду
В твердом состоянии кристаллическая решетка белого фосфора
Число нейтронов в атоме фосфора равно
Тремя общими электронными парами образована связь в молекуле
Азот проявляет степень окисления -3 в соединении
ВОПРОС 1
ВОПРОС 2
ВОПРОС 3
ВОПРОС 4
ВОПРОС 5
ВОПРОС 6
ВОПРОС 7
ВОПРОС 8
ВОПРОС 9
ВОПРОС 10
ВОПРОС 11
ВОПРОС 12

14.01.23
Bochegova@
Домашнее задание
- §15,16,21
- Задача: Вычислите массу фосфора, образующегося из 1 кг фосфата кальция, содержащего 5% примесей.
- Стр.52, №2
- Стр. 70 №2,4,5
Использованные ресурсы
14.01.23
Bochegova@
- Периодическая система http://theodoregray.com/PeriodicTableDisplay/Elements/015/index.s9.html
- История открытия аллотропных модификаций фосфора В. А. Красицкий . Журнал «Химия и химики» №6, 2010
- Единая коллекция цифровых образовательных ресурсов http://school-collection.edu.ru/catalog/
1.Белый фосфор (N 125289) Иллюстрация
2.Красный фосфор (N 125287) Иллюстрация
3.Сравнение температур воспламенения белого и красного фосфора (N 54483) Видеофрагмент
4.Превращение красного фосфора в белый (N 54480) Видеофрагмент
5.Получение фосфида кальция (N 54904) Видеофрагмент
- ФЦИОР http://fcior.edu.ru/
Физические и химические свойства азота mmlab.chemistry.418i
- Анимация: схема электропечи для получения фосфора . CD «Библиотека наглядных электронных пособий. Химия.» ООО «Кирилл и Мефодий», 2006