Предельные углеводороды. Алканы.
ХИМИЯ, 10 КЛАСС

C n H 2n+2
- Алканы (предельные, насыщенные, парафины) – органические вещества, состоящие из атомов углерода и водорода, связанных между собой одинарными (сигма) связями.
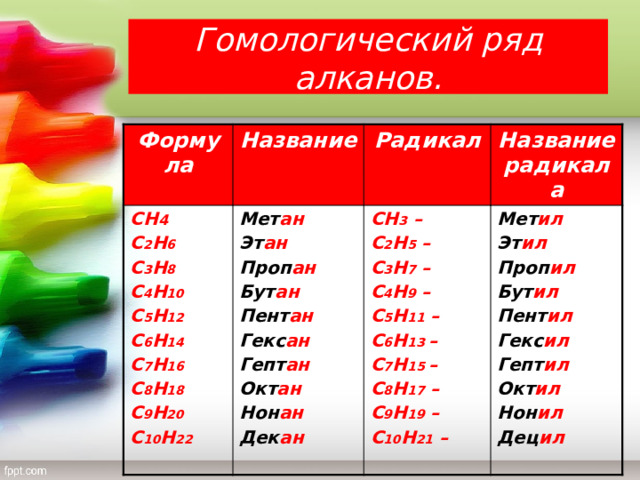
Гомологический ряд алканов.
Формула
Название
СН 4
Мет ан
С 2 Н 6
Радикал
Эт ан
Название радикала
С 3 Н 8
СН 3 –
С 4 Н 10
С 2 Н 5 –
Мет ил
Проп ан
Бут ан
Эт ил
С 3 Н 7 –
С 5 Н 12
Пент ан
Проп ил
С 6 Н 14
С 4 Н 9 –
Бут ил
Гекс ан
С 5 Н 11 –
С 7 Н 16
Пент ил
С 6 Н 13 –
С 8 Н 18
Гепт ан
Гекс ил
Окт ан
С 9 Н 20
С 7 Н 15 –
Гепт ил
Нон ан
С 8 Н 17 –
С 10 Н 22
Дек ан
Окт ил
С 9 Н 19 –
С 10 Н 21 –
Нон ил
Дец ил

СЛОВАРЬ
- Гибридизация АО - это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей

Строение молекулы
- Все атомы углерода в молекулах алканов находятся в состоянии sp 3 -гибридизации, т.е. все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены к вершинам равносторонней треугольной пирамиды – тетраэдра.
- Угол между направлениями связей составляет 109°28´, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг), хотя молекулы алканов могут приобретать самую разнообразную форму, потому что вокруг одинарной углерод-углеродной связи возможно практически свободное вращение.

Строение молекулы
- Связи углерод-углерод я вляются неполярными и плохо поляризуемыми , длина связи C–C равна 0,154 нм. Связи C–H несколько короче и являются слабополярными .
С*
s 1
↑
p 3
↑
↑
↑

Строение алканов
- ковалентная полярная связь .
- 109° 28’ – угол между связями
C-C 0.154 нм

Изомерия
- Изомерия углеродного скелета
СН 3 – СН 2 – СН 2 – СН 2 – СН 3
н-пентан СН 3
СН 3 – СН – СН 2 – СН 3 І
l СН 3 ─ С ─ СН 3
СН 3 І
2-метилбутан СН 3
2,2-диметилпропан
С 5 Н 12 :
Пространственная: не характерна

Строение алканов
- Отсутствие в молекулах алканов полярных связей приводит к тому, что они плохо растворимы в воде, не вступают во взаимодействие с ионами. Наиболее характерными для алканов являются реакции, протекающие по свободно-радикальному механизму.

Физические свойства
- С 1 – С 4 – газ без цвета и запаха
- С 5 – С 17 – бесцветные жидкости с запахом бензина
- С 18 … -твердые вещества, белого цвета, жирные на ощупь
- По мере увеличения числа атомов углерода в цепи возрастает температура кипения, плавления и плотность
- Молекулы с разветвленным скелетом кипят и плавятся при более низкой температуре, чем молекулы с нормальным строением
- Газообразные и жидкие алканы образуют взрывоопасные смеси с воздухом
- Алканы практически не растворимы в воде, но растворяются в неполярных органических растворителях (бензол,тетрахлорметан)
- Жидкие и твердые алканы смешиваются друг с другом

Химические свойства
Для алканов характерны следующие реакции:
- Реакции замещения
- Реакции элиминирования (отщепления)
- Реакции изомеризации
- Реакции окисления

- Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода
1) Реакция галогенирования
СН 4 + Сl 2 → СН 3 Сl + НСl
СН 4 + Сl 2 → СН 2 Сl 2 + 2НСl
СН 4 + 3Сl 2 → СНСl 3 + 3НСl
СН 4 + 4Сl 2 → ССl 4 + 4НСl
ЗАПОМНИ: Реакция начинается при освещении и носит радикально-цепной
характер, т.е. идет через образование свободных радикалов.

- Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода
2) Реакция нитрования (реакция М.И.Коновалова).
Реакция Коновалова М. И.: взаимодействие с разбавленной азотной кислотой при 140°С и при повышенном или нормальном давлении – образуется смесь изомерных нитросоединений (легче всего замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного).
СН 4 + HO-NO 2 = CH 3 -NO 2 + H 2 O

II. Реакции отщепления
При пропускании нагретого алкана над платиновым или никелевым катализатором может отщепиться водород. Этот процесс называется дегидрированием
C 3 H 8 C 3 H 6 + H 2
2СН 4 Н─С≡С─Н + 3Н 2
СН 3 ─СН 3 Н 2 С═СН 2 + Н 2

II. Реакции отщепления
При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами углерода.
C 10 H 22 C 5 H 12 +C 5 H 10
C 10 H 22 C 4 H 10 +C 6 H 12
Этот процесс называется термическим крекингом ( от англ. tocrack – «колоть, расщеплять»).

II. Реакции отщепления
2) пиролиз
При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды – полностью разлагаются на углерод и водород. Такой процесс называется пиролизом .
СН 4 С+2Н 2
2СН 4 С 2 Н 2 + 3Н 2

II. Реакции отщепления
3) ароматизация
Алканы с 6 и более атомами углерода вступают в реакции дегидрирования с образованием цикла (дегидроциклизации)
С 6 Н 14 С 6 Н 6 + 4Н 2

III. Реакции изомеризации
Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения.
CH 3 -CH 2 -CH 2 -CH 3 AlCl 3 CH 3 -CH-CH 3
CH 3
n-бутан 2-метил пропан

IV. Реакции окисления
1) Горение
СН 4 +2О 2 →СО 2 + 2Н 2 О
2) Каталитическое окисление
При мягком окислении СН 4 в присутствии катализатора кислородом при 200 °C могут образоваться:
- Метиловый спирт: 2СН 4 + О 2 → 2СН 3 ОН;
- формальдегид: СН 4 + О 2 → СН 2 О + Н 2 O;
- Муравьиная кислота :
2СН 4 + 3О 2 → 2НСООН + 2Н 2 O .

V. конверсия
СН 4 +Н 2 O CO+3H 2
Так называют взаимодействия алканов, из которых чаще всего используют природный газ с парами воды. При высокой температуре около 1000 образуется смесь оксида углерода – угарного газа и водорода. Эту смесь называют синтез- газ.
Часто ее не разделяют, а используют для получения разных органических веществ.

Отношение алканов к растворам перманганата калия и бромной воды.
Чтобы отличить предельные углеводороды от непредельных используют растворы бромной воды и перманганата калия
Алканы не обесцвечивают раствор перманганата калия и бромную воду

Нахождение в природе
- Основные источники алкано в – нефть и природный газ . Метан составляет основную массу природного газа , в нем присутствуют также в небольших количествах этан, пропан и бутан. Метан содержится в выделениях болот и угольных пластов. Наряду с легкими гомологами метан присутствует в попутных нефтяных газах. Эти газы растворены в нефти под давлением и находятся также над ней. Алканы составляют значительную часть продуктов переработки нефти. Содержатся в нефти и циклоалканы – они называются (от греч. naphtha – нефть). нафтенами

Нахождение в природе
В природе широко распространены также газовые гидраты алканов, в основном метана, они залегают в осадочных породах на материках и на дне океанов. Их запасы, вероятно, превышают известные запасы природного газа и в будущем могут случить источником метана и его ближайших гомологов.

Нахождение в природе
Твердые алканы встречаются в природе в виде залежей горного воска – озокерита, в восковых покрытиях листьев, цветов и семян растений, входят в состав пчелиного воска.

Способы получения алканов
1) Промышленные способы
- природные источники;
- крекинг алканов;
- Метод Фишера- Тропша
2) Лабораторные способы
- реакция Вюрца,
- реакция Дюма,
- реакция Кольбе.
- гидролиз реактива Гриньяра,
- восстановление галогеноалканов и
непредельных соединений

ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ

Способы получения алканов
- Получение из природных источников :
а) метан, этан, пропан, бутан выделяют из природного газа, причем метана в нем 95-98 %об.
б) Алканы от С5 до С11 выделяют из бензиновой фракции нефти
в) алканы от С12 до С16 из средней фракции нефти
г) высшие алканы, от С16 и выше, получают вакуумной перегонкой неперегоняемого остатка нефти .

Способы получения алканов
реакция идет при условиях:
T- 400-600 С ,
P- 250атм .
Kat- FeO-Fe 2 O 3
С + 2H 2 = CH 4 – частный случай для метана

Способы получения алканов
Р еакции расщепления углеродного скелета крупных молекул при нагревании и в присутствии катализаторов.
При температуре 450 – 700 ° С алканы распадаются за счет разрыва связей С – С (более прочные связи С – Н при этом сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомо в.
СН 3 -СН 2 -СН 2 -СН 2 -СН 2 - СН 2 -СН 2 -СН 2 -СН 2 -СН 3
СН 3 -СН 2 -СН 2 -СН 2 -СН 2 - + -СН 2 -С Н 2 -СН 2 -СН 2 -СН 3
СН 3 -СН 2 -СН 2 -СН 2 -С Н 3 + СН 2 =СН-СН 2 -СН 2 -СН 3
С n H 2n+2 C m H 2m+2 + C n-m H 2n-2m

Способы получения алканов
Синтез Фишера-Тропша , на основе синтез-газа (CO + H2):
Kat - Ni или Co
T- 200 С
3 CO + 7H 2 =C 3 H 8 + 3H 2 O –
частный случай для пропана.

- ЛАБОРАТОРНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ

Способы получения алканов
1 . Реакция Вюрца - взаимодействие натрия с галогенпроизводными алканов:
Приводит к увеличению углеводородной цепи.
Если в реакцию вступают различные галогеналканы, то образуется смесь алканов.

Способы получения алканов
2) Реакция Дюма - сплавление солей карбоновых кислот со щелочью.

Способы получения алканов
3) РЕАКЦИЯ КОЛЬБЕ
Протекает при прохождении электрического тока через расплав или раствор соли карбоновой кислоты .
2 R COONa → R-R + 2CO 2 + 2Na
2 R COONa + 2H 2 O =
R-R + 2CO 2 +H 2 + 2 NaOH

РЕАКЦИЯ КОЛЬБЕ
Na +
COO
R
R-COO
Na
2NaOH
R-COO -
Na +
R - R + 2CO 2
Na +
COO
R
H 2 0
H 2 0
H 2
2OH -
H 2 0
H 2 0

Способы получения алканов
- Гидролиз карбидов металлов .
Al 4 C 3 + 12H 2 O → 4Al(OH) 3 + 3CH 4 ↑
карбид
алюминия

Способы получения алканов
- СИНТЕЗ С ИСПОЛЬЗОВАНИЕМ РЕАКТИВА ГРИНЬЯРа Реактив Гриньяра имеет формулу RMgX и общее название алкилмагний-галогенид. Считается, что связь углерод — магний является ковалентной, но сильно полярной; связь магний — галоген по существу ионная.
R Hal + Mg → R MgHal R MgHal + H Cl → RH + MgClHal

Способы получения алканов
- Восстановление алкенов, алкинов:
, при условии, что
T- 200 С
Kat – платина, палладий, никель, смесь оксидов меди(II) и хрома(III)).
R-CH=CH-R + H 2 → R-CH 2 -CH 2 -R R-C≡C-R + 2H 2 → R-CH 2 -CH 2 -R

Способы получения алканов
- ВОССТАНОВЛЕНИЕ ГАЛОГЕНАЛКАНОВ И НЕПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ :
- Восстановление галогеналканов: R Hal + H 2 → RH + Hhal
Катализатор: палладий на карбонате бария.
- Восстановление иодалканов иодоводородной кислотой: R I + H I → RH + I 2

ПРИМЕНЕНИЕ АЛКАНОВ
- Значение алканов для человечества огромно! Представить нашу жизнь без алканов очень и очень сложно… Но тот факт, что нефть на земле довольно скоро закончится ставит под вопрос столь простой и выгодный для человечества способ получения энергии, как сжигание алканов. Количество энергии, полученное человечеством от этих соединений очень велико. Как и области применения алканов.

ПРИМЕНЕНИЕ АЛКАНОВ
- Высшие алканы входят в состав смазочных масел, вазелина и парафина .

ПРИМЕНЕНИЕ АЛКАНОВ
- Газообразные алканы - ценное топливо
- Жидкие алканы – основа в изготовлении косметики, медикаментов; разные растворители, моторное и ракетное топливо и т. д.
- Твердые алканы – изготовление свечей, пропитка бумаги и т. д. Сырье для нефтехимических производств

ПРИМЕНЕНИЕ АЛКАНОВ
- Алканы в составе бензина, керосина, солярового масла, мазута используются в качестве топлива.

ПРИМЕНЕНИЕ АЛКАНОВ
- Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров (капрон, найлон).