Окислительно –восстановительные
Реакции

ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
Выполним задание « Найди родственников»
Из перечня формул составьте генетический ряд.(вопросы…)
Ca(OH) 2, CI 2, HCI, Ca, P, CaCO 3, NaOH, CaO, CO 2
Решим…

Общий вывод:
Признаки которые характеризуют генетический ряд:
- Вещества разных классов;
- Разные вещества образованные одним химическим элементом, т.е. представляют собой разные формы существование одного элемента;
- Разные вещества одного химического элемента связаны взаимопревращениями.

Вспомним …
1.Валентность.
2.Степень окисления.
3.Восстановитель.
4.Окислитель.
5.Типы химических реакций .

Окислительно –восстановительные
Реакции

Цель урока:
1.Сформировать понятие об окислительно-восстановительных реакциях.
2.Научиться уравнивать записи ОВР
методом электронного баланса.

Реакции , в резултате которых изменяются степени окисления атомов всех или некоторых элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными .
Пример:
2Cu 0 + O 2 =2 Cu 2+ O 2-
2H + CL - + Zn 0 = Zn 2+ CL 2 - + H 2 0
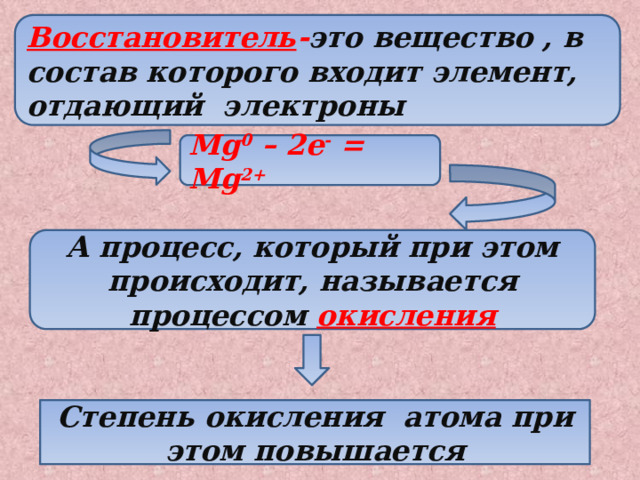
Восстановитель - это вещество , в состав которого входит элемент, отдающий электроны
Mg 0 – 2e - = Mg 2+
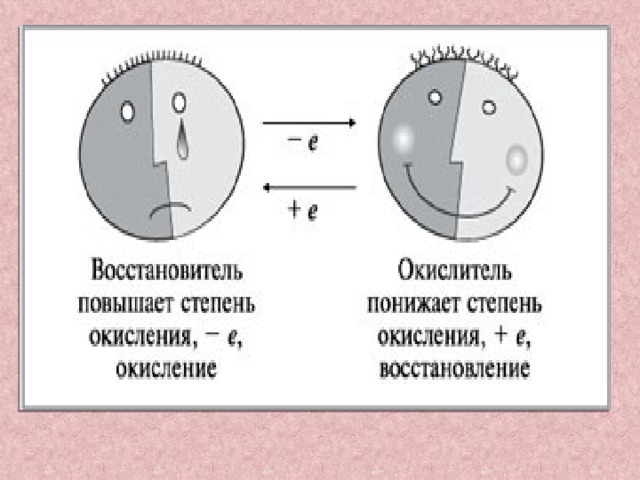
А процесс, который при этом происходит, называется процессом окисления
Степень окисления атома при этом повышается
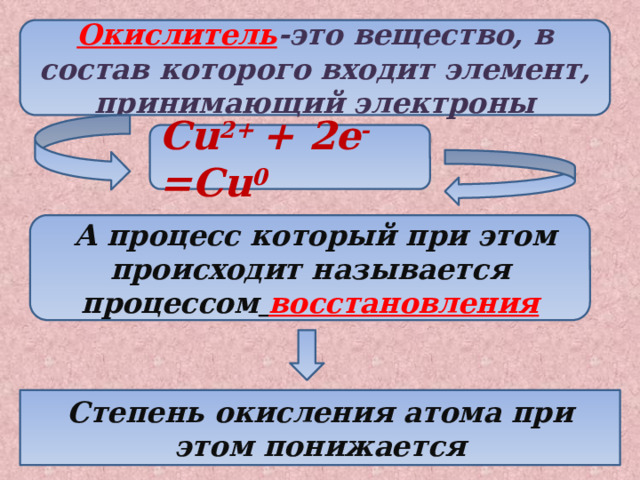
Окислитель -это вещество, в состав которого входит элемент, принимающий электроны
Cu 2+ + 2e - =Cu 0
А процесс который при этом происходит называется процессом восстановления
Степень окисления атома при этом понижается

Восстановителями могут быть
Окислителями могут
быть
Простые вещества-металлы.
Простые вещества –неметаллы - только кислород и фтор
Сложные вещества - восстановители, если в их состав входит атом элемента в минимальной степени окисления . Например:
(кроме реакции кислорода с фтором):
H +1 2 S -2 ; N -3 H +1 3
Сложные вещества-окислители, если в их состав входит атом элемента в максимальной степени окисления. Например:
H +1 N +5 O -2 3 ; H +1 2 S +6 O -2 4

Различают :
минимальную (низшую) степень окисления
S -2 2e - 8e - 8e -
промежуточную степень окисления
S 0 2e - 8e - 6e -
максимальную (высшую) степень окисления
S +6 2e - 8e - 0e - в минимальной степени окисления, може
- Атом, находящийся т быть только восстановителем.
S -2 -2е = S 0 S -2 - 6е = S +4 S -2 -8е = S +6
- Атом, находящийся в максимальной степени окисления, может быть только окислителем.
S +6 +2е = S +4 S +6 + 6е = S 0 S +6 - 8е =S -2
- Атом, находящийся в промежуточной степени окисления может быть как восстановителем, так и окислителем.
S 0 +2е = S -2 S 0 - 4е = S +4

Закрепление…
Итог….

Д/З п.43 до стр.232
Стр.235№1,3.

План составления окислительно -восстановительной реакции
- Записываем схему химической реакции
Ca + O 2
2. Расставляем степени окисления атомов,
у частвующих в химической реакции
Ca 0 + O 2 0 Ca 2+ O 2-
3.Находим атомы, которые изменяют свою
степень окисления
Ca 0 и O 2 0
Далее

4.Составляем электронный баланс,записывая
процесс отдачи и присоединения электронов
Ca 0 – 2e - = Ca 2+
O 2 0 + 4e - = 2O 2-
восстановитель
4
2
5 . Ca 0 – 2e - =Ca 2+
O 2 0 + 4e - = 2O 2-
2
окислитель
1
6 . Расставляем цифры, полученные в электронном балансе в химическое уравнение
2Ca + O 2 = 2CaO

Используя метод электронного баланса, допишите схемы и составьте уравнения,
расставив коэффициенты
- Mg + O 2
- HCL + Zn
- SO 2 + O 2
- S + HNO 3 NO 2 + H 2 SO 4 + H 2 O
- Mg + H 2 SO 4 H 2 S + MgSO 4 + H 2 O

Д/З п.43
Стр.236 №7.