Физические свойства :
1) газ без цвета, с характерным запахом гниющего белка, сладковатым вкусом;
2)немного тяжелее воздуха;
3) Ткип = –60,3°C, Тпл= –85,6°C;
4) на воздухе сероводород горит голубоватым пламенем;
5) очень ядовит;
6) растворяется в воде (сероводородная вода);
7) зрывоопасны его смеси с воздухом.

Получение :
- S + H 2 = H 2 S
- FeS + 2HCl = FeCl 2 + H 2 S ↑
Химические свойства :
1) 2H 2 S + 3O 2 = 2H 2 O + 2SO 2
2H 2 S + O 2 = 2H 2 O + 2S
2) 4Ag + 2H 2 S + O 2 = 2Ag 2 S + 2H 2 O
3)Хороший восстановитель
t
t
(при избытке кислорода)
(при недостатке кислорода)

Оксид серы ( IV) диокси́д се́ры, серни́стый газ, серни́стый ангидри́д
Оксид серы ( VI ) триокси́д се́ры, серный газ, серный ангидри́д
Строение молекулы

Оксид серы ( IV)
Получение
В промышленности : обжиг сульфидов:
ZnS + O 2 = ZnO + SO 2
4FeS 2 + 11O 2 →
2Fe 2 O 3 + 8SO 2 ↑
Оксид серы ( VI )
1) Окисление SO 2
2SO 2 + O 2 2SO 3
2) Разложение сульфатов (для металлов средней активности):
Fe 2 (SO 4 ) 3 → Fe 2 O 3 + 3SO 3
t
t
t

Оксид серы ( IV)
Оксид серы ( VI )
Получение
В лаборатории : действием сильных кислот на сульфиты и гидросульфиты:
Na 2 SO 3 + H 2 SO 4 →
Na 2 SO 4 + H 2 O + SO 2 ↑

Оксид серы ( IV)
Оксид серы ( VI )
Физические свойства
1) бесцветный газ с характерным резким удушливым запахом (запах загорающейся спички);
2) хорошо растворяется в воде с образованием нестойкой сернистой кислоты;
3) под давлением сжижается при комнатной температуре;
4) ядовит;
5) обесцвечивает многие красители, убивает микроорганизмы.
1) в обычных условиях легколетучая бесцветная жидкость с удушающим запахом;
2) при температурах ниже 16,9 °C застывает;
3) гигроскопичен.

Оксид серы ( IV)
Химические свойства
Проявляет как свойства окислителя, так и восстановителя:
SO 2 + 2H 2 S = 3S + 2H 2 O
Оксид серы ( VI )
1) Проявляет только свойства окислителя:
3SO 3 + H 2 S → 4SO 2 + H 2 O
2) Растворяется в 100%-й серной кислоте, образуя олеум:
H 2 SO 4 (100 %) + SO 3 → H 2 S 2 O 7
олеум
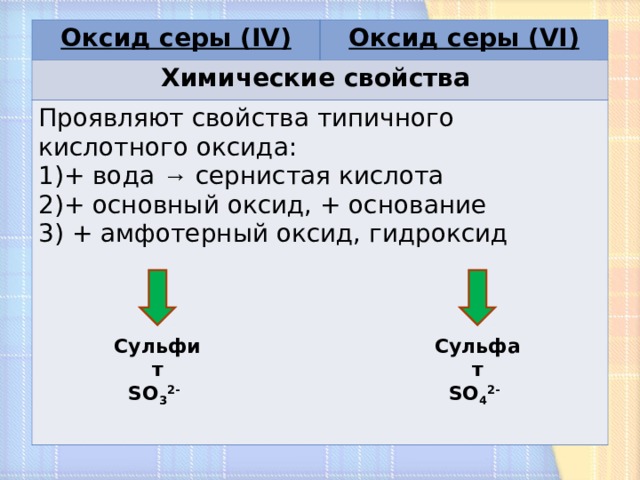
Оксид серы ( IV)
Оксид серы ( VI )
Химические свойства
Проявляют свойства типичного кислотного оксида:
- + вода → сернистая кислота
- + основный оксид, + основание
- + амфотерный оксид, гидроксид
Сульфит
SO 3 2-
Сульфат
SO 4 2-


Серная кислота(раз)
Серная кислота(конц). Специфические
1) разб. H 2 SO 4 + Ме = соль + H 2
1) конц. H 2 SO 4 + Me
Взаимодействие H2SO4 (конц.) с металлами
2 ) + основный оксид
+ основание
2) конц. H 2 SO 4 + неМе
С + 2 H 2 SO 4 ( конц. ) = 2SO 2 + CO 2 + 2H 2 O
S + 2 H 2 SO 4 ( конц. ) = 3SO 2 + 2H 2 O
2P + 5H 2 SO 4 ( конц. ) = 2H 3 PO 4 + 5SO 2 + 2H 2 O
3) + амфотерный оксид
+ амфотерный гидроксид
3) обугливание органических веществ конц. H 2 SO 4
С 12 Н 22 О 11 + 2 H 2 SO 4 ( конц. ) = 11С + 2 SO 2 + CO 2 + 13H 2 O
4) + соль
4) Качественная реакция на H 2 SO 4 и ее соли – взаимодействие с растворимыми солями бария
Ba 2+ + SO 4 2- = BaSO 4 ↓ ( белый)


S
FeS 2 SO 2 SO 3 H 2 SO 4
H 2 S
Напишите уравнения реакций, с помощью которых можно осуществить данную схему превращений.