

Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле !

Демокрит
- В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Неделимость атома аналогична неделимости «бытия» .

атомно-
молекулярная
теория
М.В. Ломоносов
(1711-1765 гг.)
Джон Дальтон
(1766-1844 гг.)
- Материя состоит из мельчайших первичных частиц, или атомов.
- Атомы неделимы и не могут создаваться и разрушаться.
- Атомы характеризуются определенным размером и массой.
- Молекулы состоят из атомов, как из одинаковых, так и различных.
- При физических явлениях молекулы сохраняются, при химических – разрушаются.
- Химические реакции заключаются в образовании новых молекул из тех же самых атомов, из которых состояли исходные вещества.
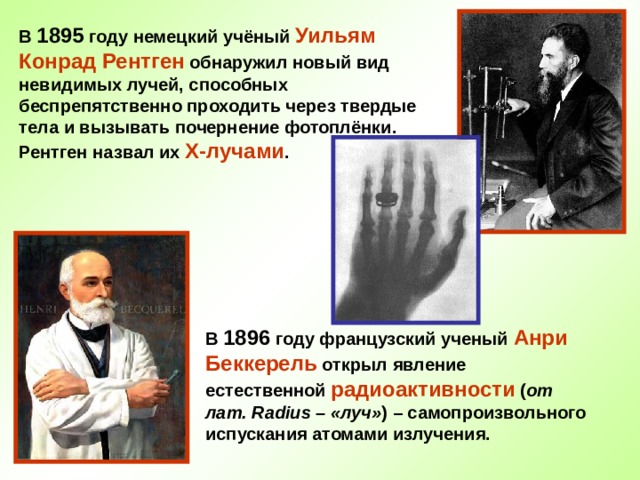
В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый вид невидимых лучей, способных беспрепятственно проходить через твердые тела и вызывать почернение фотоплёнки. Рентген назвал их Х-лучами .
В 1896 году французский ученый Анри Беккерель открыл явление естественной радиоактивности ( от лат. Radius – «луч» ) – самопроизвольного испускания атомами излучения.

В 1898 году Пьер Кюри и Мария Склодовская – Кюри , изучавшие явление радиоактивности, открыли новые элементы – полоний и радий.

Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома
Опыт Резерфорда : поток ά -частиц, излучаемый радиоактивным источником, через узкую щель направлялся на тонкую золотую фольгу; при помощи флюоресцирующего экрана проводилась регистрация ά -частиц, которые в отсутствии фольги двигались узким пучком, вызывая на экране яркую вспышку
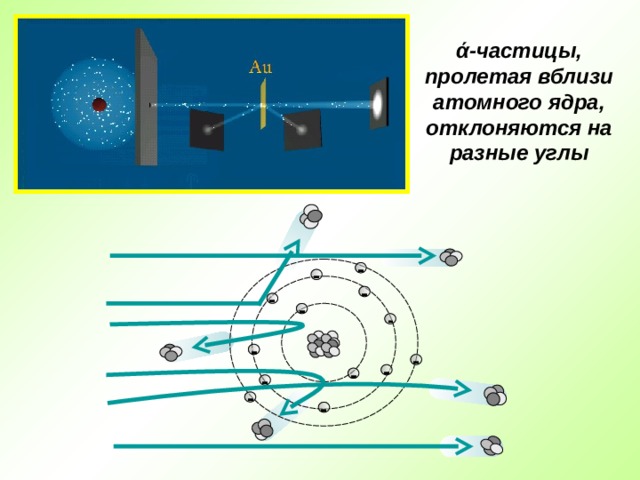
ά -частицы, пролетая вблизи атомного ядра, отклоняются на разные углы
-
-
-
-
-
-
-
-
-
-
-
-
-
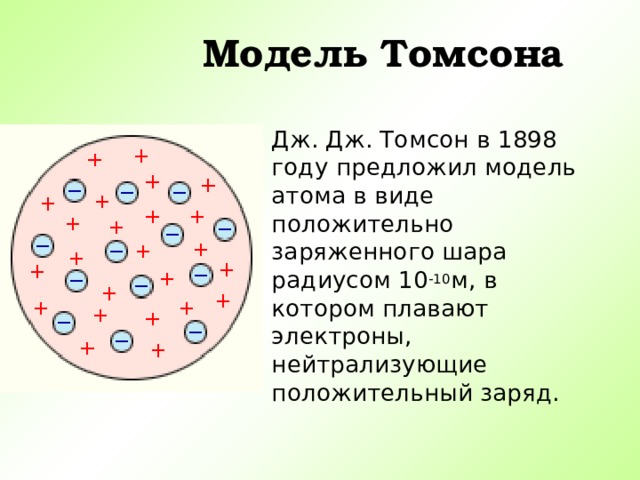
Модель Томсона
Дж. Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара радиусом 10 -10 м, в котором плавают электроны, нейтрализующие положительный заряд.

Э. Резерфорд предложил планетарную модель атома : в центре находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нём заключена почти вся масса атома; вокруг ядра по круговым орбитам движутся отрицательно заряженные электроны, подобно движению планет вокруг солнца.
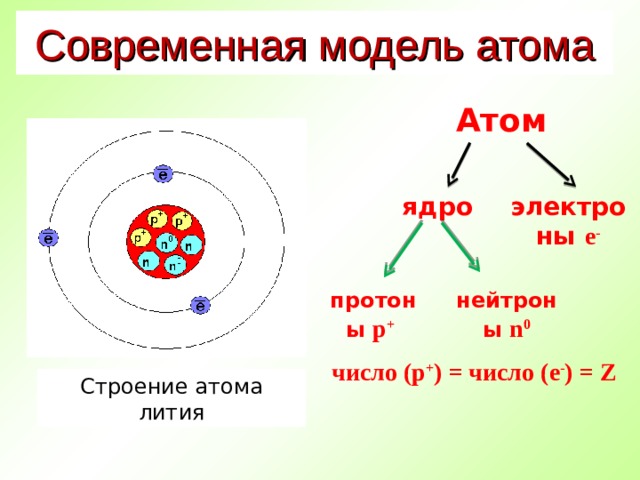
Современная модель атома
Атом
ядро
электроны е -
протоны p +
нейтроны n 0
число (p + ) = число ( е - ) = Z
Строение атома лития
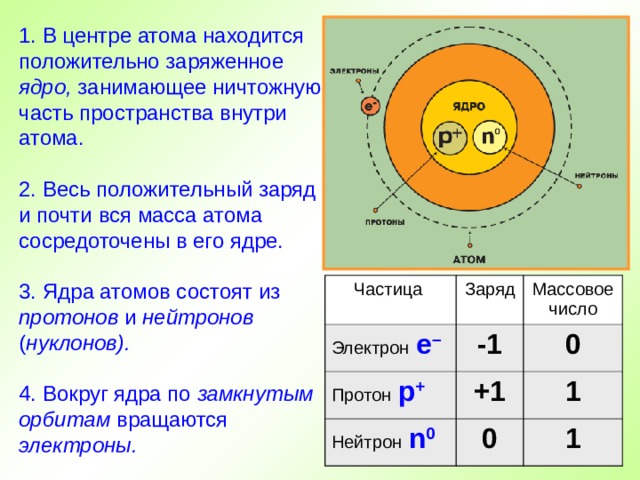
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3. Ядра атомов состоят из протонов и нейтронов ( нуклонов).
4. Вокруг ядра по замкнутым орбитам вращаются электроны.
Частица
Электрон е –
Заряд
Массовое число
-1
Протон р +
0
Нейтрон n 0
+1
1
0
1

Электроны
Электроны (обозначаются е - ) – это частицы с отрицательным зарядом -1 (в условных единицах) и относительной массой, равной 1/1837 массы протона.
Число электронов в атоме
=
число протонов в ядре
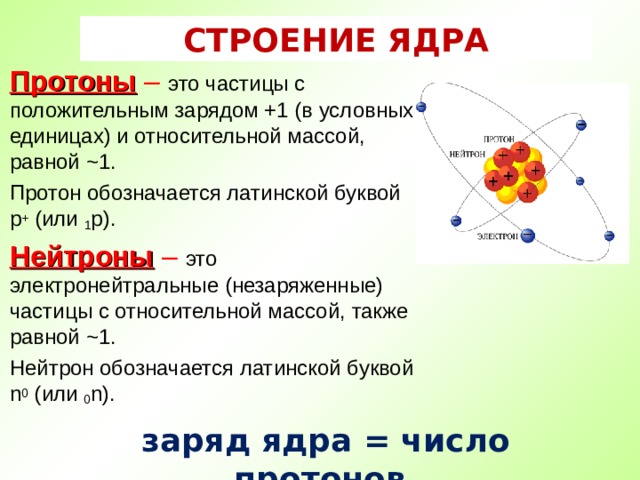
СТРОЕНИЕ ЯДРА
Протоны – это частицы с положительным зарядом +1 (в условных единицах) и относительной массой, равной ~1.
Протон обозначается латинской буквой p + (или 1 р).
Нейтроны – это электронейтральные (незаряженные) частицы с относительной массой, также равной ~1.
Нейтрон обозначается латинской буквой n 0 ( или 0 n).
заряд ядра = число протонов
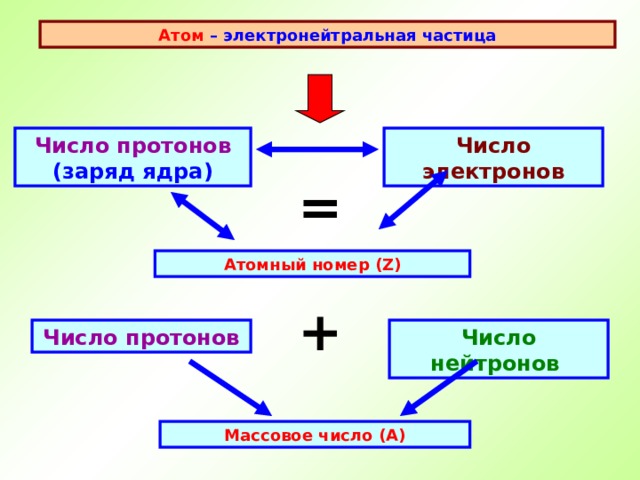
Атом – электронейтральная частица
Число протонов (заряд ядра)
Число электронов
=
Атомный номер ( Z )
+
Число нейтронов
Число протонов
Массовое число (А)
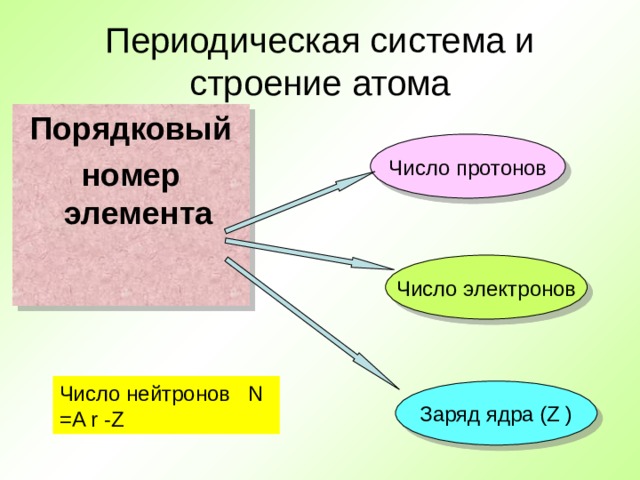
Периодическая система и строение атома
Порядковый
номер элемента
Число протонов
Число электронов
Число нейтронов N =A r -Z
Заряд ядра ( Z )
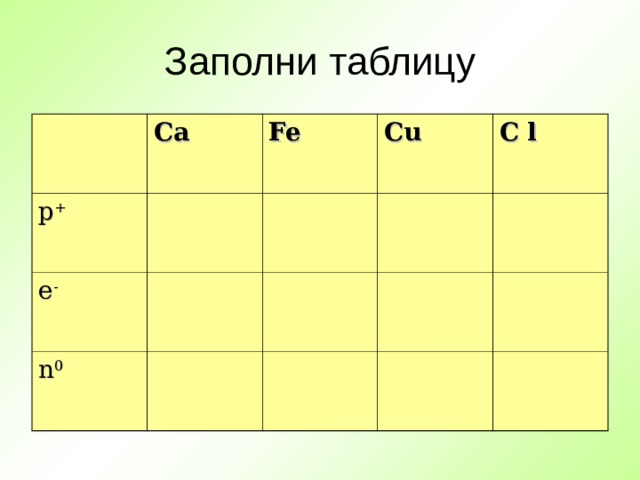
Заполни таблицу
Ca
p +
Fe
e -
Cu
n 0
C l
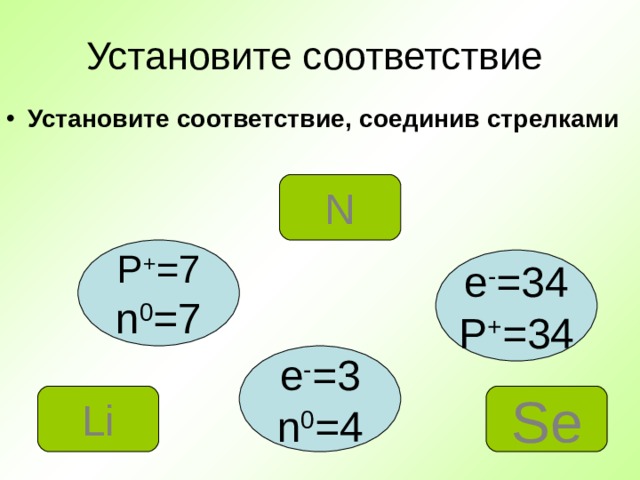
Установите соответствие
- Установите соответствие, соединив стрелками
N
P + =7
n 0 =7
e - =34
P + =34
e - =3
n 0 =4
Se
Li

Современная формулировка Периодического закона
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от зарядов атомных ядер

Тестовые задания
- Заряд ядра атома азота равен :
- а) 7 б) 13 в) 4 г) 29 д) 11
- Число протонов в ядре атома криптона :
- а ) 36 б) 17 в) 4 г) 31 д) 6
- Число нейтронов в ядре атома цинка :
- а) 8 б) 35 в)11 г)30 д)4
- Число электронов в атоме железа :
- а) 11 б)8 в)56 г)26 д)30
- Изотопы водорода отличаются друг от друга :
- а)числом e - б)числом n в) химическим знаком г) числом p д)массовым числом

Тестовые задания
- Заряд ядра атома азота равен :
- а) 7 б) 13 в) 4 г) 29 д) 11
- Число протонов в ядре атома криптона :
- а ) 36 б) 17 в) 4 г) 31 д) 6
- Число нейтронов в ядре атома цинка :
- а) 8 б) 35 в)11 г)30 д)4
- Число электронов в атоме железа :
- а) 11 б)8 в)56 г)26 д)30
- Изотопы водорода отличаются друг от друга :
- а)числом электронов б)числом нейтронов в) химическим знаком г) числом p д)массовым числом
- МОЛОДЦЫ ! ЭТО ВАМ УДАЛОСЬ !!!

МОЛОДЦЫ !!!
Вы справились. Желаю дальнейших успехов в изучении химии!














































