Муниципальное общеобразовательное учреждение
средняя общеобразовательная школа с. Вадинск
Методическая разработка урока по физике 11 класс
Тема: Строение атома.
Опыт Резерфорда.
Подготовила учитель физики
Суляева Л.Н.
с. Вадинск,2020
Тема урока: Строение атома. Опыт Резерфорда.
Тип урока: урок изучения нового материала.
Вид урока: комбинированный урок
Цели урока:
Образовательные: рассмотреть понятие атомного ядра, опыт Резерфорда, планетарную модель строения атома; сравнить модели атома Томсона и Резерфорда, дать некоторые сведения о фактах, подтверждающих сложное строение атома, о работах ученых по созданию модели строения атома; расширить представления учащихся о физической картине мира, о роли физических моделей в объяснении природных процессов; использовать ранее полученные знания из электродинамики для объяснения новых фактов; учить применять вновь полученные знания при решении типовых задач.
Воспитательные: воспитывать научное мировоззрение, формировать интерес к истории развития науки, уважение к труду ученых, стремление к расширению кругозора и углублению знаний по физике, формировать умение излагать свою точку зрения.
Развивающие: развивать логическое и эвристическое мышления на историческом материале; развивать навык сравнения и умения анализировать и обобщать факты, способствовать развитию критического мышления.
Оборудование: компьютер, мультимедийный проектор, графические задания, портреты ученых, презентация.
Ход урока.
Организационный момент:
Проверка готовности учащихся к уроку.
Актуализация знаний:
Что мы знаем о строении вещества?
Что доказывают такие явления как диффузия, броуновское движение, электризация, радиоактивность?
Вспомните основателей атомизма.
Основная часть:
Задача нашего урока – совершить экскурс в историю развития взглядов на строение атома, начиная с древних времен до начала 20-го века, познакомиться с фундаментальными экспериментальными и теоретическими работами конца 19-го – начала 20-го века, которые перевернули представления об атоме и привели к созданию новой квантовой модели атома.
Слово “атом” придумал очень давно более 2500 лет назад древнегреческий философ Демокрит. По легенде, идея о существовании атомов возникла у автора, когда он разрезал яблоко. С греческого “атом” переводится как “неделимый”. Так ли это?
-На какие свойства атома указывают открытия, исследования конца 19 начала 20 века?(слайд 2)
- Первая, достаточно разработанная модель атома, была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. (слайд 3) По мысли Томсона, положительный заряд занимает весь объём атома и распределён он в этом сферическом объёме равномерно. У более сложных атомов в положительно заряжённом шаре есть несколько электронов, так что атом подобен кексу, в котором роль изюма играют электроны. Распространённый термин этой модели - «Пудинг с изюмом» или «Булочка с изюмом». (слайд 4) Первая модель атома сыграла положительную роль. Но она требовала доказательств.
- Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.
- В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов (слайд 5)
- Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом,
(слайд 6) сыграли решающую роль в понимании структуры атома. Он решил проникнуть внутрь атома с помощью α-частиц, которые имели положительный заряд, массу почти в 7300 раз большую чем масса электрона и очень большую скорость (около 20000км/c). С точки зрения Резерфорда α-частицы должны были легко "пробить" атом и тем самым доказать справедливость модели атома Томсона .Если бы атом был устроен так, как предполагал Дж.Томсон, то Э.Резерфорд увидел бы следующую картину: α- частицы пробивают атом и практически не отклоняясь пролетают сквозь него.
- Схему экспериментальной установки Резерфорда вы видите на рисунке. (слайд 7)
 В цилиндрическом сосуде с небольшим отверстием находился радиоактивный препарат, испускавший поток α-частиц. Они попадали на золотую фольгу и, проходя через нее, ударялись о люминесцирующий экран. В местах удара частиц на экране возникали вспышки света.
В цилиндрическом сосуде с небольшим отверстием находился радиоактивный препарат, испускавший поток α-частиц. Они попадали на золотую фольгу и, проходя через нее, ударялись о люминесцирующий экран. В местах удара частиц на экране возникали вспышки света.
То, что некоторые α-частицы отскакивали от фольги назад, противоречило модели Томсона. Результаты эксперимента настолько удивили Резерфорда, что он воскликнул: "... неправдоподобно так же, как если бы вы выстрелили пятнадцатифунтовым снарядом в папиросную бумагу, а снаряд отскочил бы обратно и убил бы вас самих".
Чтобы объяснить результаты опыта, Резерфорд рассуждал так. Известно, что α-частицы имеют положительный заряд. Если некоторые из них отталкиваются фольгой назад, значит, положительный заряд есть и в атомах фольги. Но поскольку бoльшая часть α-частиц пролетает сквозь фольгу, почти не отклоняясь при этом, значит, этот положительный заряд занимает лишь малую часть каждого атома. Так Резерфорд пришел к мысли о существовании атомного ядра. ( слайды 8,9)
Подсчитывая число α-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны). Размер же самого атома 10-8 см, то есть от 10 до 100 тысяч раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра.(слайд 10)
Наблюдавшееся Резерфордом рассеяние заряженных частиц и объясняется таким распределением зарядов в атоме При столкновениях с отдельными электронами α-частицы испытывают отклонения на очень небольшие углы, так как масса электрона мала. Однако в тех редких случаях, когда она пролетает на близком расстоянии от одного из атомных ядер, под действием сильного электрического поля ядра может произойти отклонение на большой угол.
Так как большая часть пространства в атоме пуста, быстрые α-частицы могут почти свободно проникать через значительные слои вещества, содержащие несколько тысяч слоев атомов. (слайд11)
Итак, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны. (слайд
Таким образом, на сегодня известно точно, что... (учитель - на доске, ребята - в тетради составляют схему-таблицу строения атома).
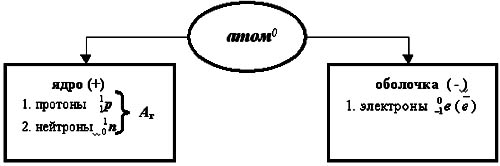
Строение всех атомов зашифровано в периодической системе химических элементов. Порядковый номер химического элемента показывает электрический заряд ядра атома Z , этот заряд численно равен сумме протонов в ядре атома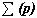 ; т.к. атом в целом электрически нейтральная частица, то суммарный положительный заряд атома равен суммарному отрицательному заряду, следовательно, равен числу электронов в оболочке атома
; т.к. атом в целом электрически нейтральная частица, то суммарный положительный заряд атома равен суммарному отрицательному заряду, следовательно, равен числу электронов в оболочке атома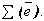 .
.  Чтобы вычислить число нейтронов в ядре из массового числа атома вычитаем заряд ядра:
Чтобы вычислить число нейтронов в ядре из массового числа атома вычитаем заряд ядра: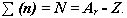
Закрепление.
- С какой целью проводился опыт Резерфорда?
- Пользуясь рисунком расскажите, как проводился опыт Резерфорда по рассеянию α- частиц?
- Какие результаты были получены в ходе опыта?
- Каковы вывода Резерфорда?
- Что представляет атом согласно ядерной модели, выдвинутой Резерфордом?
- Каковы размеры атома и ядра?
- По рисунку расскажите, как проходят α- частицы сквозь атомы вещества? Почему?
Выполнение теста (слайды 12-15)
Домашнее задание § 93.
Закончи предложение:
Если бы не было открыто строение атома, то _______________________
____________________________________________________________________________________________________________________________________
Заполни таблицу:
| химические элементы | ядро | Электроны, 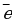 |
| Протоны, p | Нейтроны, n |
| 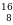 О О
|
|
|
|
| 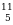 В В
|
|
|
|
| 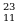 Na Na |
|
|
|
| 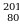 Hg Hg |
|
|
|
| 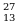 Al Al
|
|
|
|
Подведение итогов урока, выставление оценок.





 В цилиндрическом сосуде с небольшим отверстием находился радиоактивный препарат, испускавший поток α-частиц. Они попадали на золотую фольгу и, проходя через нее, ударялись о люминесцирующий экран. В местах удара частиц на экране возникали вспышки света.
В цилиндрическом сосуде с небольшим отверстием находился радиоактивный препарат, испускавший поток α-частиц. Они попадали на золотую фольгу и, проходя через нее, ударялись о люминесцирующий экран. В местах удара частиц на экране возникали вспышки света.
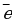
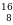 О
О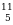 В
В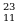 Na
Na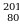 Hg
Hg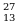 Al
Al




















