Просмотр содержимого документа
«В помощь студенту»

КИСЛОТЫ

Что такое кислоты?
- Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком
- Электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка

Классификация кислот
Признаки
классификации
Наличие кислорода в кислотном остатке
Группы кислот
Примеры
А) кислородные;
Б) бескислородные
Основность
А) H 3 PO 4 , H 2 SO 4 ;
, Б) HBr, H 2 S
А) одноосновные;
Б) многоосновные
Растворимость в воде
Летучесть
А) растворимые;
Б) нерастворимые
А) HNO 3 , HCl ;
Б) H 2 SO 4 , H 3 PO 4
А) летучие;
Б) нелетучие
Степень диссоциации
А) HNO 3 , HCl ;
Б) H 2 SiO 3
А) H 2 S, HNO 3
Б) H 2 SO 4 , H 3 PO 4
А) сильные;
Б) слабые
Стабильность
А) HNO 3 , HCl ;
Б) H 2 SO 3 , H 2 CO 3
А) стабильные;
Б) нестабильные
А) H 2 SO 4 , HCl
Б) H 2 SO 3 , H 2 CO 3

Химические свойства кислот
- Диссоциация;
- Взаимодействие с индикаторами;
- Взаимодействие с металлами;
- Взаимодействие с основными оксидами;
- Взаимодействие с основаниями;
- Взаимодействие с солями .
далее

Диссоциация кислот
Н n Кост → Н + + Кост n-
HCl →
HNO 3 →
H 2 SO 4 →
H 3 PO 4 →
H + + Cl -
H + + NO 3 -
2H + + SO 4 2-
3H + + PO 4 3-
Обратно ко всем свойствам

Взаимодействие с индикаторами
Индикатор
Нейтральная среда
Лакмус
Кислая среда
Фиолетовый
Фенолфталеин
Красный
Бесцветный
Метиловый
оранжевый
Бесцветный
Оранжевый
Розовый
Помни! Нерастворимые кислоты не меняют окраску индикаторов.
Обратно ко всем свойствам

Взаимодействие с металлами
Ме + Н n Кост → Ме n Кост m + Н 2
металл + кислота→соль + водород
2
Al +
3
H 2 SO 4 →
3
H 2
Al 2 (SO 4 ) 3 +
Реакция возможна, если:
- Металл находится в ряду активности до водорода;
- В результате реакции получается растворимая соль;
- Кислота растворима
Обратно ко всем свойствам

Взаимодействие с основными оксидами
Ме x O y + H n Кост → Ме n Кост y + H 2 O
Основный оксид + кислота → соль + вода
MgO +
2
HCl →
MgCl 2 + H 2 O
MgO + 2H + + 2Cl - → Mg 2+ + 2Cl - + H 2 O
MgO + 2H + → Mg 2+ + H 2 O
Реакция возможна, если в результате получается растворимая соль
Обратно ко всем свойствам

Взаимодействие с основаниями
Ме(ОН) m + Н n Кост → Me n Кост m + H 2 O
Основание + кислота → соль + вода
NaOH + H 3 PO 4 →
Na 3 PO 4 +
3
H 2 O
3
3Na + + 3OH - + 3H + + PO 4 3- → 3Na + + PO 4 3- + 3H 2 O
H + + OH - → H 2 O
Реакция между щелочью и кислотой с образованием соли и воды называется реакцией нейтрализации.
Обратно ко всем свойствам

Взаимодействие с солями
Ме x Кост y + H n Кост → H х Кост + Ме n Кост y
Соль + кислота → новая кислота + новая соль
Li 3 PO 4 +
H 2 O +
CO 2
3
Li 2 CO 3 +
H 3 PO 4 →
2
2
3
3
6 Li + + 3CO 3 2- + 6H + + PO 4 3- → 6Li + + 2PO 4 3- + 3H 2 O + 3CO 2
2H + + CO 3 2- → H 2 O + CO 2
Реакция возможна, если в результате образуется осадок, газ или слабый электролит
Обратно ко всем свойствам

Пищевые кислоты
- Лимонная кислота содержится в лимонах.
- Яблочная- в яблоках.
- Щавелевая - в листьях щавеля.
- Муравьиная содержится в выделениях муравьев, пчелином яде и в жгучих волосках крапивы.
- Уксусная кислота образуется при скисании виноградного вина.
- Молочная – при скисании молока, квашении капусты и силосовании кормов для скота.
- Аскорбиновая( витамин С) - в черной смородине,
- малине, лимонах, апельсинах, томатах. Недостаток его в пище вызывает заболевание цынгу.
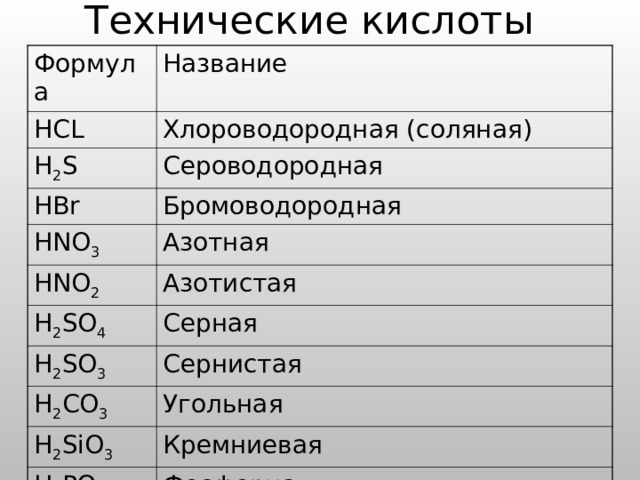
Технические кислоты
Формула
HCL
Название
H 2 S
Хлороводородная (соляная)
Сероводородная
HBr
Бромоводородная
HNO 3
Азотная
HNO 2
H 2 SO 4
Азотистая
H 2 SO 3
Серная
Сернистая
H 2 CO 3
Угольная
H 2 SiO 3
Кремниевая
H 3 PO 4
Фосфорная
HF
Фтороводородная (плавиковая)

Представители кислот
- бесцветная вязкая жидкость, без запаха ,вдвое тяжелее воды, поглощает влагу из воздуха и других газов, обугливает древесину, кожу, ткани, бумагу.
- Для приготовления растворов запомните правило:
- Сначала вода, потом кислота,
Иначе случится большая беда!
- По объему производства серной кислоты можно судить о развитии химической промышленности страны.
- Серную кислоту называют «Хлебом» химической промышленности, ее используют практически во всех отраслях народного хозяйства.

Соляная кислота
- Бесцветная, дымящаяся на воздухе жидкость, имеет специфический запах, несколько тяжелее воды.
- Содержится в желудке и выполняет две функции:
1) Уничтожает микробов, которые попадают в желудок вместе с пищей.
- 2) Помогает перевариванию пищи, так как входит в состав желудочного сока.

Немного загадок) нажмите!
А точнее сказать одна!

- Ну что ему та кислота?
- Как минеральная вода!
- Сто двадцать дней в ней просидел,
- Ни капли он не заржавел.
ответ

ТИТАН

Спасибо!



































