
Валентность элементов в ковалентных соединениях. Гибридизация орбиталей. Направленность ковалентной связи. Пространственное строение молекул
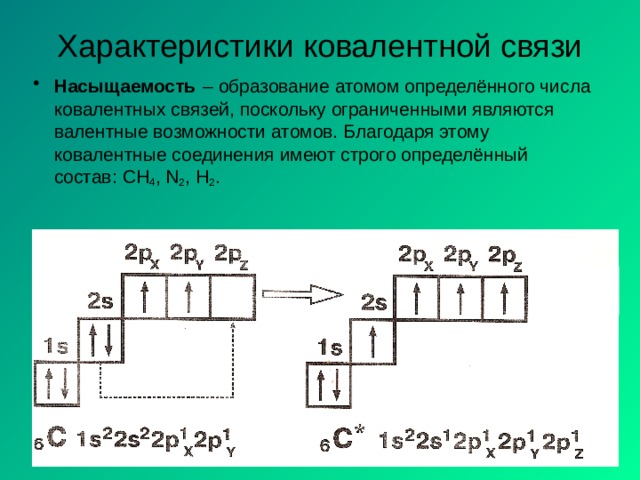
Характеристики ковалентной связи
- Насыщаемость – образование атомом определённого числа ковалентных связей, поскольку ограниченными являются валентные возможности атомов. Благодаря этому ковалентные соединения имеют строго определённый состав: CH 4 , N 2 , H 2 .
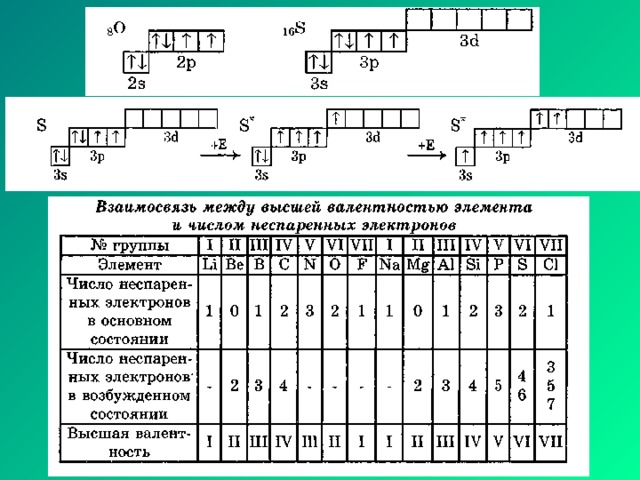
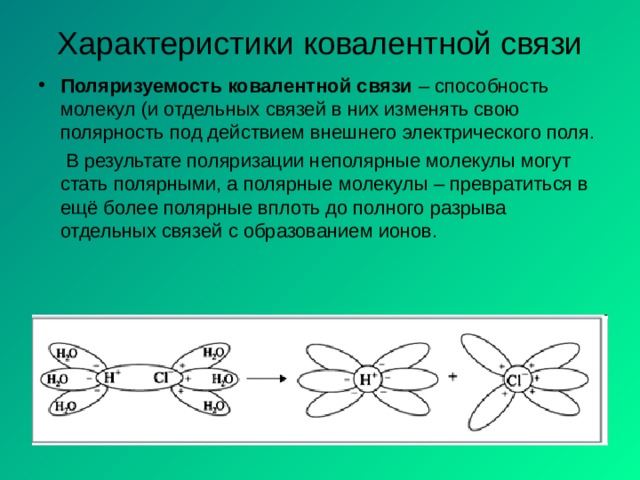
Характеристики ковалентной связи
- Поляризуемость ковалентной связи – способность молекул (и отдельных связей в них изменять свою полярность под действием внешнего электрического поля.
В результате поляризации неполярные молекулы могут стать полярными, а полярные молекулы – превратиться в ещё более полярные вплоть до полного разрыва отдельных связей с образованием ионов.
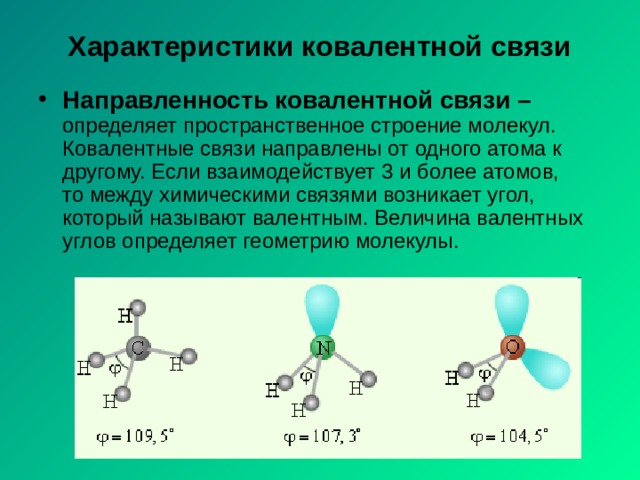
Характеристики ковалентной связи
- Направленность ковалентной связи – определяет пространственное строение молекул. Ковалентные связи направлены от одного атома к другому. Если взаимодействует 3 и более атомов, то между химическими связями возникает угол, который называют валентным. Величина валентных углов определяет геометрию молекулы.
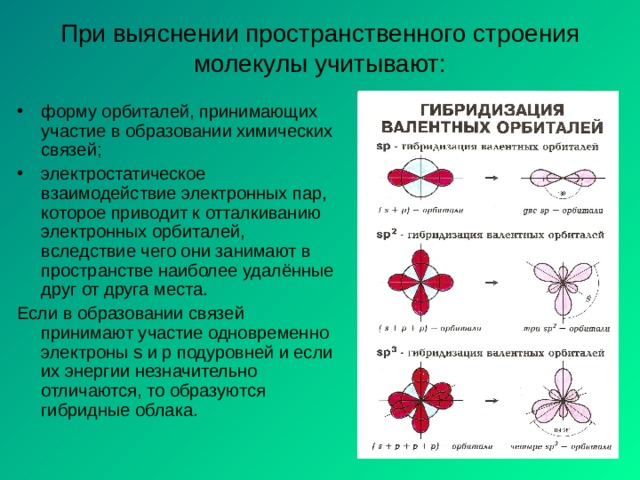
При выяснении пространственного строения молекулы учитывают:
- форму орбиталей, принимающих участие в образовании химических связей;
- электростатическое взаимодействие электронных пар, которое приводит к отталкиванию электронных орбиталей, вследствие чего они занимают в пространстве наиболее удалённые друг от друга места.
Если в образовании связей принимают участие одновременно электроны s и p подуровней и если их энергии незначительно отличаются, то образуются гибридные облака.

Гибридизация - процесс выравнивания электронных облаков по форме и энергии
Основные положения теории гибридизации.
- Гибридизуются только орбитали центрального атома
- Степень гибридизации тем больше, чем ближе АО по энергии , и чем больше их геометрическое перекрывание (наибольшее перекрывание – с участием s-АО)
- Число гибридных орбиталей равно суммарному числу исходных орбиталей
- Гибридные орбитали более вытянуты в пространстве и обеспечивают более полное перекрывание с АО соседних атомов
- Гибридные орбитали участвуют в образовании только σ -связей
- Теория гибридизации объясняет направленность ковалентной связи и геометрическое строение молекул и кристаллов

Лайнус Полинг (американский ученый)
ГИБРИДИЗАЦИЯ - это смешение АО с разными (но близкими) энергетическими состояниями, вследствие которого возникает такое же число одинаковых по форме и энергии орбиталей, симметрично расположенных в пространстве
Если у атома в образовании химических связей участвуют разные по типу АО ( s-, p-, d- или f- ), то химические связи формируются электронами не «чистых», а «смешанных», или гибридных АО.
Перекрывание гибридных АО происходит в большей степени, чем негибридных орбиталей
► химические связи прочнее
► молекула более устойчива
Гибридная орбиталь:
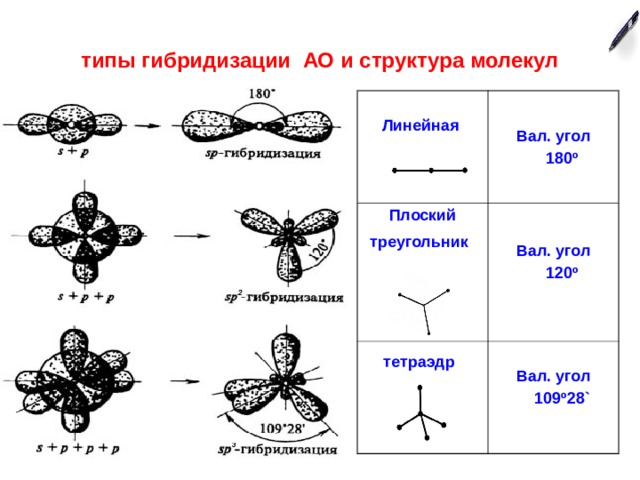
типы гибридизации АО и структура молекул
Линейная
Вал. угол
180 º
Плоский треугольник
Вал. угол
120 º
тетраэдр
Вал. угол
109 º 28 `
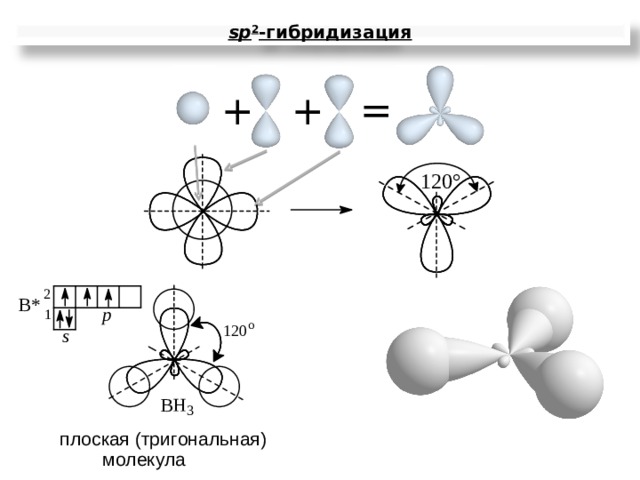
sp 2 -гибридизация
=
+
+
10
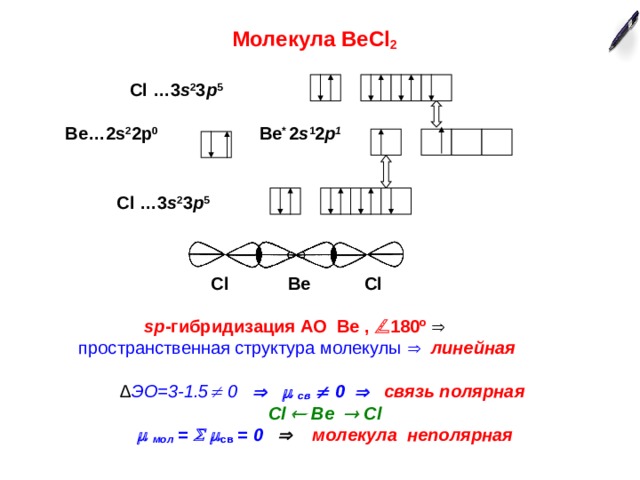
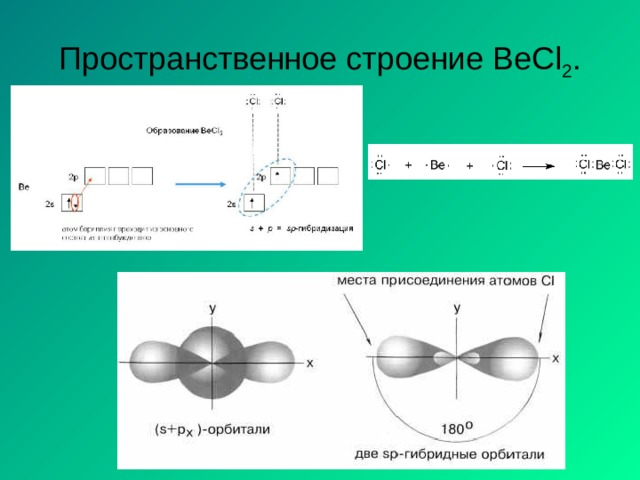
Молекула ВеС l 2
С l …3 s 2 3 р 5
Ве…2 s 2 2р 0
Ве * 2 s 1 2 p 1
С l …3 s 2 3 р 5
Cl Be Cl
sp -гибридизация АО Ве , 180 º
пространственная структура молекулы линейная
∆ ЭО =3-1.5 0 св 0 связь полярная
Cl Be Cl
мол = св = 0 молекула неполярная
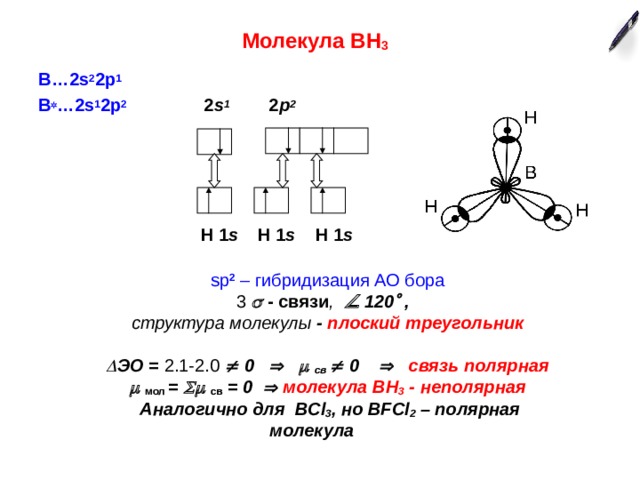
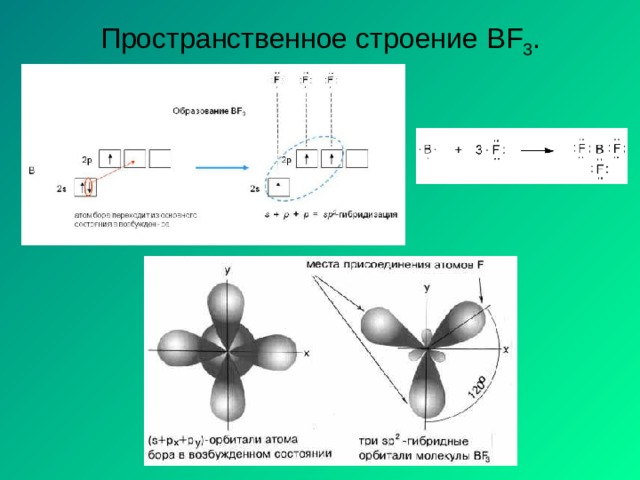
Молекула ВН 3
В…2 s 2 2p 1
В …2 s 1 2p 2 2 s 1 2 p 2
H 1 s H 1 s H 1 s
sp 2 – гибридизация АО бора
3 - связи , 120 ,
структура молекулы - плоский треугольник
ЭО = 2.1-2.0 0 св 0 связь полярная
мол = св = 0 молекула ВН 3 - неполярная
Аналогично для BCl 3 , но BFCl 2 – полярная молекула
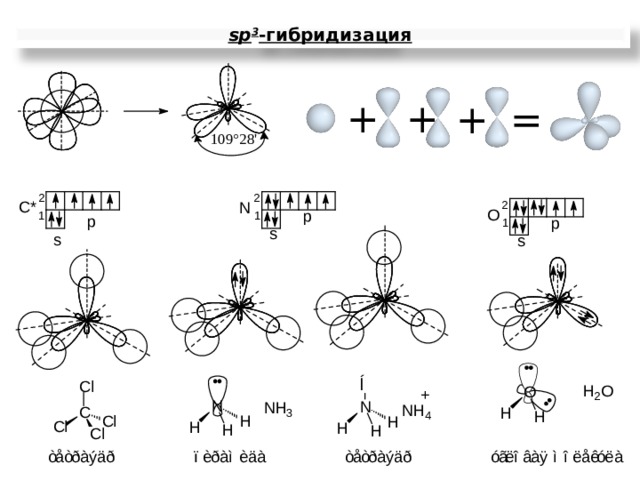
sp 3 - гибридизация
+
+
=
+
13
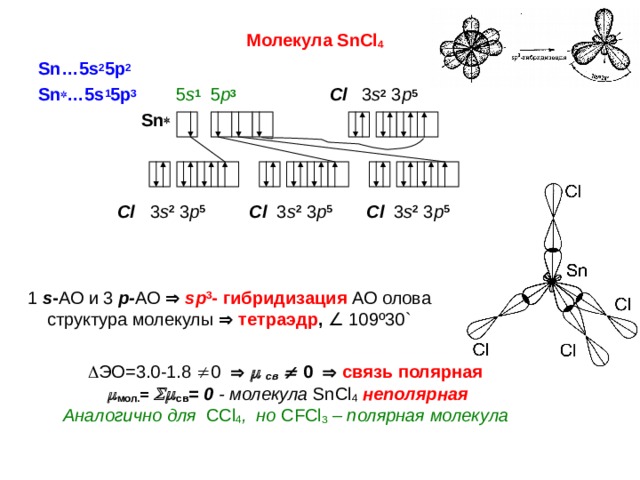
Молекула SnCl 4
Sn…5s 2 5p 2
Sn …5s 1 5p 3 5 s 1 5 p 3 Cl 3 s 2 3 p 5
Sn
Cl 3 s 2 3 p 5 Cl 3 s 2 3 p 5 Cl 3 s 2 3 p 5
1 s - АО и 3 р- АО sp 3 - гибридизация АО олова
структура молекулы тетраэдр , 109 º 30 `
ЭО=3.0-1.8 0 св 0 связь полярная
мол. = св = 0 - молекула SnCl 4 неполярная
Аналогично для С Cl 4 , но С FCl 3 – полярная молекула
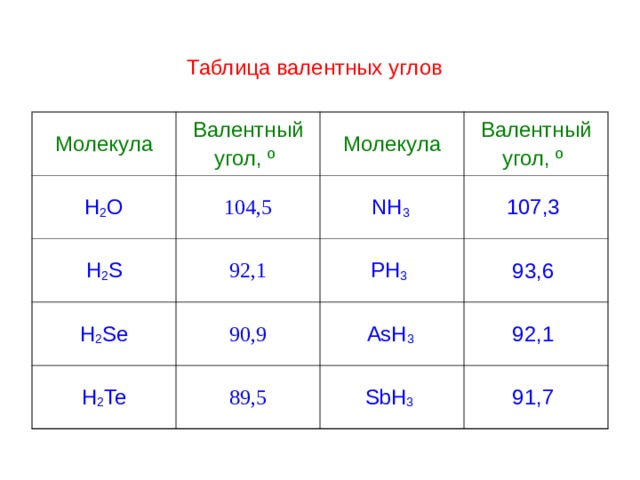
Таблица валентных углов
Молекула
Валентный
угол, º
H 2 O
104,5
H 2 S
Молекула
H 2 Se
92,1
NH 3
Валентный
угол, º
107,3
90,9
PH 3
H 2 Te
93,6
AsH 3
89,5
92,1
SbH 3
91,7
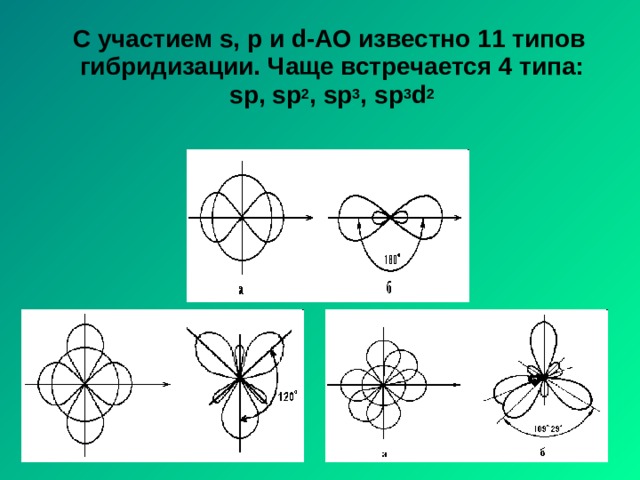
С участием s, p и d-АО известно 11 типов гибридизации. Чаще встречается 4 типа: sp, sp 2 , sp 3 , sp 3 d 2

Определение типа гибридизации на примере молекулы метана.
1.Написать полную структурную формулу вещества.
2.Подсчитать число электронов, предоставляемые центральным атомом.
3.Подсчитать число электронов, предоставляемые соседними атомами.
4.Подсчитать число электронов, приходящихся на пи -связь.
0
5.Полученный результат разделить на два.
-
4
+
4
0
--------------
2
расположение тетраэдр
6.Если 4 –
расположение плоское тригональное
Если 3 -
расположение линейное
Если 2-
Пространственное строение BF 3 .
Пространственное строение BeCl 2 .
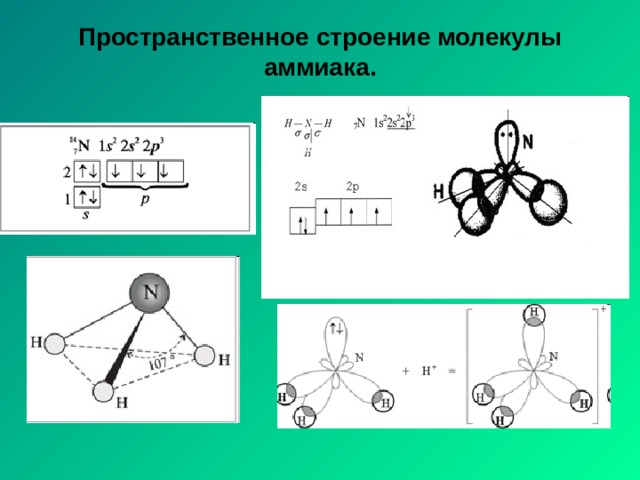
Пространственное строение молекулы аммиака.
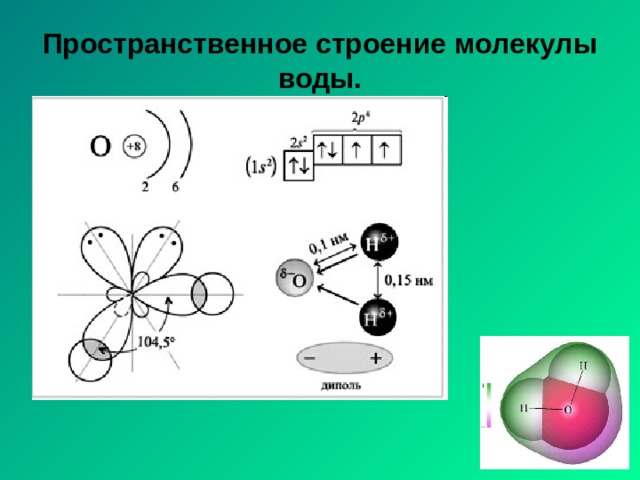
Пространственное строение молекулы воды.
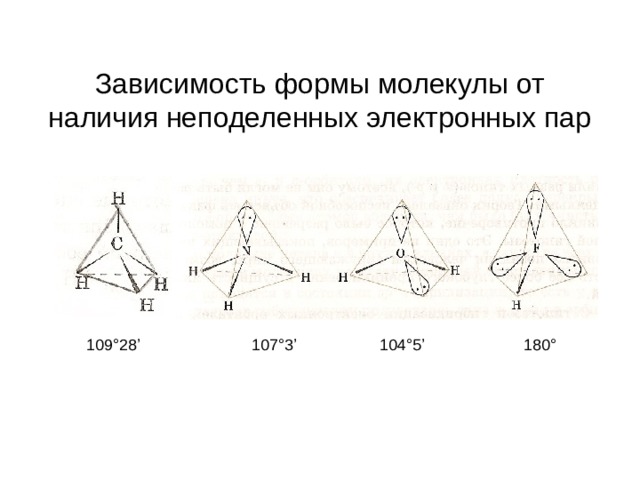
Зависимость формы молекулы от наличия неподеленных электронных пар
109 ° 28 ’
10 7 °3’
10 4 °5’
1 80 °
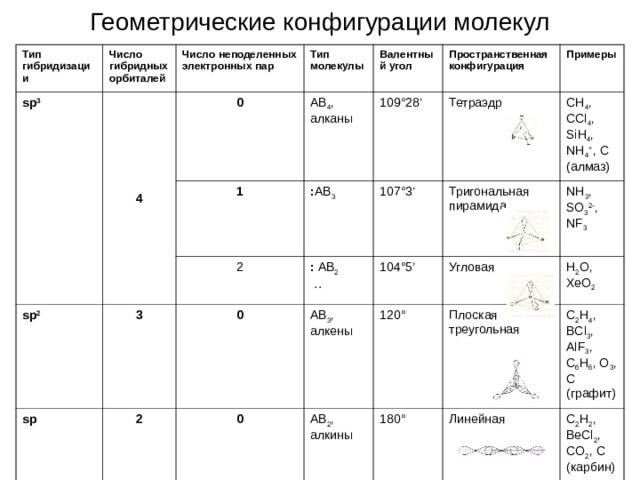
Геометрические конфигурации молекул
Тип гибридизации
Число гибридных орбиталей
sp 3
Число неподеленных электронных пар
4
0
Тип молекулы
1
AB 4 , алканы
sp 2
Валентный угол
109 ° 28 ’
3
: AB 3
sp
2
Пространственная конфигурация
107 ° 3 ’
2
: AB 2
. .
0
Примеры
Тетраэдр
0
AB 3 , алкены
104 ° 5 ’
Тригональная пирамида
CH 4 , CCl 4 , SiH 4 , NH 4 + , С (алмаз)
AB 2 , алкины
120 °
Угловая
NH 3 , SO 3 2- , NF 3
180 °
H 2 O, XeO 2
Плоская треугольная
C 2 H 4 , BCl 3 , AlF 3 , C 6 H 6 , O 3 , C (графит)
Линейная
C 2 H 2 , BeCl 2 , CO 2 , C (карбин)


Вопросы для закрепления
Даны формулы веществ:
а) C 2 H 4 ; г) Н 2 О ; ж) С (алмаз); к) C 2 H 2 ;
б) CH 4 ; д) BCl 3 ; з) C ( карбин ) ; л) C 6 H 6 ;
в) BeH 2 ; е) NH 3 ; и) С (графит); м) SiCl 4 .
1. Выберите формулы веществ, имеющих направленность связей, обусловленную
sp 3 - гибридизацией
sp 2 - гибридизацией
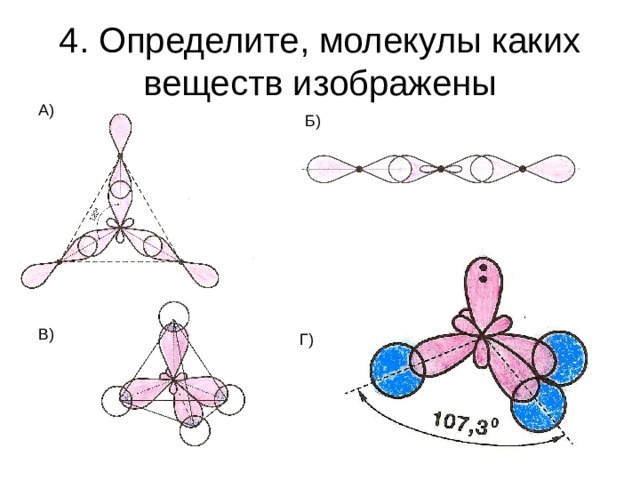
4. Определите, молекулы каких веществ изображены
А)
Б)
В)
Г)

Выберите правильный ответ .
- 1 . Тип гибридизации электронных облаков в молекуле CF 4
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.
- 2 . Тип гибридизации электронных облаков в молекуле СO 2
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.

- 1. Тип гибридизации электронных облаков в молекуле СаCl 2:
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.
- 2. Тип гибридизации электронных облаков в молекуле ВСl 3:
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd.

Выберите правильный ответ
- 1. Тип гибридизации электронных облаков в молекуле СCl 4
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.
- 2. Тип гибридизации электронных облаков в молекуле ВеJ 2
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.

Выберите правильный ответ
- 1. Тип гибридизации электронных облаков в молекуле GeCl 4
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.
- 2. Тип гибридизации электронных облаков в молекуле SiCl 4
- 1) sp-;
- 2) sp²-;
- 3) sp³-;
- 4) spd-.

























































