ВСЕРОССИЙСКАЯ ПРОВЕРОЧНАЯ РАБОТА
ХИМИЯ
11 КЛАСС
Инструкция по выполнению работы
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Оформляйте ответы в тексте работы согласно инструкциям к заданиям. В случае записи неверного ответа зачеркните его и запишите рядом новый. При выполнении работы разрешается использовать следующие дополнительные материалы:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости солей, кислот и оснований в воде;
– электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
При выполнении заданий Вы можете использовать черновик. Записи в черновике проверяться и оцениваться не будут. Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
ВАРИАНТ 1
1..Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) поваренной соли от попавших в неё железных опилок;
2) воды от мелких частиц карбоната кальция?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
| Смесь | Номер рисунка | Способ разделения смеси |
| Поваренная соль от попавших в неё железные опилки | 
| 
|
| Вода с мелкими частицами карбоната кальция | 
| 
|
2 На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Ответы запишите в таблицу.
| Символ химического элемента | № периода | № группы | Металл/неметалл |
| 
| 
| 
| 
|
3.Периодическая система химических элементов Д. И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах увеличиваются.
Учитывая эти закономерности, расположите в порядке увеличения радиусов атомов следующие элементы: N, C, Al, Si.![]() Запишите обозначения элементов в нужной последовательности. В ответе укажите обозначения элементов разделяя - . Например, 11 - 22.
Запишите обозначения элементов в нужной последовательности. В ответе укажите обозначения элементов разделяя - . Например, 11 - 22.
4.В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Характерные свойства веществ
| Молекулярного строения | Ионного строения |
| — при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — в расплавах и растворах проводят электрический ток |
Используя данную информацию, определите, какое строение имеют вещества азот N2 и поваренная соль NaCl. Запишите ответ в отведённом месте:
1) азот N2 ![]()
2) поваренная соль NaCl.![]()

5.Установите, к какому классу/группе относятся неорганические вещества, формулы которых указаны в таблице. В пустые ячейки таблицы впишите названия групп/классов, к которым относится данное вещество.
| Класс/
группа | 
| 
| 
| 
|
| Формула
вещества | MgO | Ca(OH)2 | H2SiO3 | Na2SO4 |
Прочитайте следующий текст и выполните задания 6—8.
В пищевой промышленности используется пищевая добавка Е526, которая представляет собой гидроксид кальция Ca(OH)2. Она находит применение при производстве: фруктовых соков, детского питания, маринованных огурцов, пищевой соли, кондитерских изделий и сладостей.
Получение гидроксида кальция в промышленном масштабе возможно путём смешивания оксида кальция с водой, этот процесс называется гашение.
Широкое применение гидроксид кальция получил в производстве таких строительных материалов, как белила, штукатурка и гипсовые растворы. Это связано с его способностью взаимодействовать с углекислым газом CO2, содержащимся в воздухе. Это же свойство раствора гидроксида кальция применяется для измерения количественного содержания углекислого газа в воздухе.
Полезным свойством гидроксида кальция является его способность выступать в роли флокулянта, очищающего сточные воды от взвешенных и коллоидных частиц (в том числе солей железа). Он также используется для повышения рН воды, так как природная вода содержит вещества (например, кислоты), вызывающие коррозию в сантехнических трубах.
6.
1. Составьте молекулярное уравнение реакции получения гидроксида кальция, которая упоминалась в тексте.
2. Объясните, почему этот процесс называют гашением..
7
1. Составьте молекулярное уравнение реакции между гидроксидом кальция и углекислым газом, которая упоминалась в тексте.
2. Объясните, какие особенности этой реакции позволяют использовать её для обнаружения углекислого газа в воздухе
8
1. Составьте сокращённое ионное уравнение упомянутой в тексте реакции между гидроксидом кальция Ca(OH)2 и соляной кислотой HCl.
2. Объясните, почему эту реакцию используют для повышения рН воды.
9. Дана схема окислительно-восстановительной реакции: H2S + Fe2O3 → FeS + S + H2O![]()
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
10. Дана схема превращений: Fe → FeCl2 → Fe(NO3)2 → Fe(OH)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
11. Установите соответствие между формулой органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | | КЛАСС/ГРУППА |
| А) CH3-CH2-CH3 Б) CH3-CH=CH2 В) CH3-CH2OH | | 1) предельные углеводороды 2) спирты 3) непредельные углеводороды 4) карбоновые кислоты |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
12. В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) C2H6 + ….. → C2H5Cl + HCl 2) C3H6 + ….. → CO2 + H2O
13.Аммиак используется в производстве азотной кислоты и азотных удобрений, в частности аммиачной селитры, в медицине, в качестве хладагента в промышленных холодильных установках. Какой объём (н. у.) аммиака необходимо ввести в реакцию с азотной кислотой для получения 200 кг аммиачной селитры? Запишите подробное решение задачи.
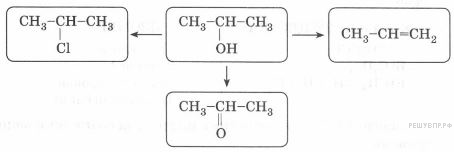
14. Изопропиловый спирт используют в качестве растворителя и исходного вещества в различных производствах. В соответствии с приведённой ниже схемой составьте уравнения реакций получения некоторых веществ из изопропилового спирта. При написании уравнений реакций используйте структурные формулы органических веществ.
15. К 140 г 8 %-ного раствора сахара добавили 20 г сахара и 50 мл воды. Рассчитайте массу сахара и его массовую долю в полученном растворе. Запишите подробное решение задачи.


































