Школьный этап всероссийской олимпиады по химии 2016 год.
9 КЛАСС
ЧАСТЬ 1 (тест)
К каждому заданию даны несколько ответов, из которых только один верный. Выберите верный ответ. Запишите номер задания и поставьте номер выбранного ответа.
1. Наибольшую молекулярную массу имеет
1) BaCl2 2)ВаS04 3) Ва3(Р04)2; 4) Ва3Р2. (1 балл)
2. Трехэлементное вещество — это ...
1) серная кислота; 2) негашеная известь (оксид кальция);
3) хлорид железа (III); 4) медный купорос. (1 балл)
З. Сумма коэффициентов в молекулярном уравнении реакции
(СuОН)2С03 + НС1 = СuС12 + С02 + ... (2 балла)
1)10: 2)11; 3)12; 4)9.
4. Количество вещества (моль), содержащееся в 6,255 г хлорида фосфора (V) (2 балла)
1)0,5; 2)0,3; 3)0,03; 4)0,15.
5. Масса (в граммах) навески нитрата алюминия, в которой содержится 3,612∙1023 атомов азота
1)127,8; 2)42,6; 3)213; 4)14,2. (2 балла)
6. Число протонов и нейтронов в ядре изотопа 40 К
1) р = 20, n=19; 2)р = 40, n = 19; 3)р= 19,n = 21: 4)р= 21,n=19. (2 балл)
7. Реакция, в результате которой выпадает осадок
1) КОН + НС1;2) К2С03 + Н2S04;3) Cu(OH)2 +HNO3; 4) Nа2S + Рb(N03)2. (2балла)
8. При взаимодействии смеси цинка (5,2г) и карбоната цинка (5,0 г) с соляной кислотой выделяются газы объемом (н.у.) (2 балла)
1)0,896 л; 2) 1,792 л; 3)2,688 л: 4) 22,4 л.
9. В 250 мл воды растворили 150 г хлорида кальция. Массовая доля соли в растворе (в процентах) равна:
1) 60; 2) 37,5; 3) 75; 4) 62,5 (2 балла)
10. Молярная масса газа массой 0,84 г, занимающего объем 672 мл (н.у.), равна
1)44; 2)28; 3)32; 4)16. (2 балла)
Итого 18 баллов
ЧАСТЬ 2 (цепочки превращений)
Прочитайте текст.
Шел солдат по полю, решил привал сделать, письмо написать родным, да нечем. Тут он нашел черный камешек, попробовал – рисует. Написал этим камешком письмо, да поспать решил. Бросил камешек в огонь – тот вспыхнул, только дым пошел. Дождь дым остановил, к земле прибил; водица текла тяжелая, известковая. Стала сохнуть вода, кое-где осталась, а где высохла – там уже белые камешки лежали. Проснулся солдат, удивился, как дождь из черного камешка белый сделал. Взял он белый камешек, провел им по белому валуну, глядь – а он рисует. Удивился солдат и пошел дальше.
Составьте цепочку превращений и решите ее. (8 баллов)
Напишите уравнения реакций, соответствующие следующим превращениям (А, Б, В — соединения меди):
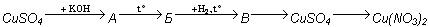
(10 баллов)
ЧАСТЬ 3 (задачи)
Конструкторы первых космических кораблей и подводных лодок столкнулись с проблемой: как поддерживать на судне или космической станции постоянный состав воздуха, т.е. как избавиться от избытка углекислого газа и возобновить запас кислорода? Решение было найдено изящное — надо превратить СО2в О2! Для этого было предложено использовать надпероксид калия (КО2), который образуется при сгорании калия в кислороде. При взаимодействии надпероксида калия с углекислым газом выделяется кислород в свободном виде (атомы кислорода являются и окислителем, и восстановителем одновременно). Составьте уравнения реакций, о которых идет речь в тексте. Зная, что в сутки человек выделят в среднем 0,51 м3 углекислого газа, рассчитайте, какое количество надпероксида калия должно быть на борту космической станции, чтобы обеспечить жизнедеятельность экипажа, состоящего из трех человек в течение месяца (30 дней). (24 балла)
Юный химик получил от учителя четыре склянки без этикеток, содержащие растворы гидроксида калия, хлорида цинка, хлорида бария и сульфида калия. Концентрация веществ в каждом из выданных растворов составляла 0,1 моль/л. Как, не используя дополнительные реактивы и имея в своем распоряжении только фенолфталеиновую бумагу (бумагу, пропитанную спиртовым раствором фенолфталеина), определить содержимое склянок? Предложите последовательность действий юного химика. Запишите уравнения происходящих реакций. (40 баллов)
Школьный этап всероссийской олимпиады по химии ОТВЕТЫ
9 КЛАСС
ЧАСТЬ 1Тест.
| Номер задания | Вариант ответа | Количество баллов |
| 1 | 3 | 1 |
| 2 | 1 | 1 |
| 3 | 2 | 2 |
| 4 | 3 | 2 |
| 5 | 2 | 2 |
| 6 | 3 | 2 |
| 7 | 4 | 2 |
| 8 | 3 | 2 |
| 9 | 2 | 2 |
| 10 | 2 | 2 |
| Итого 18 баллов |
ЧАСТЬ 2 Цепочки превращений.
Задание 11
|
|
| Количество баллов |
| Составлена цепочка | C—CO2—H2CO3—CaCO3 | 2 |
| 1 уравнение | C+O2=CO2 | 2 |
| 2 уравнение | CO2 +H2O=H2CO3 | 2 |
| 3 уравнение | H2CO3 + CaO =CaCO3 +H2O | 2 |
| Итого 8 баллов |
Задание 12
| записано уравнение реакции 1 | CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4 | 2 балла |
| записано уравнение реакции 2 | Cu(OH)2 = CuO + H2O (нагревание) | 2 балла |
| записано уравнение реакции 3 | CuO + H2 = Cu + H2O | 2 балла |
| записано уравнение реакции 4 | Cu + HgSO4 = CuSO4 + Hg | 2балла |
| записано уравнение реакции 5 | CuSO4 + Ba(NO3)2 = BaSO4↓ +Cu(NO3)2 | 2 балла |
| Итого 10 баллов |
ЧАСТЬ 3 Задачи.
Задание 13.
| Записано уравнение реакции сгорания калия в кислороде | K + O2 = KO2 | 5 баллов |
| Записано уравнение реакции взаимодействия надпероксида калия с углекислым газом | 4KO2 + 2CO2 = 2K2CO3 + 3O2 | 5 баллов |
| Рассчитано количество надпероксида калия, которое должно быть на борту. | В сутки человек выделяет углекислого газа 0,51 м3 = 510 л, что составляет 510л : 22,4л/моль = 22,77 моль, чтобы его утилизировать требуется в 2 раза больше надпероксида калия, т.е. 45,54 моль или 3,23 кг.
Для работы в течении 30 дней для троих человек потребуется 3,23кг х 30 дней х 3человек = 290,27кг надпероксида калия. | 14 баллов |
| Итого 24 балла |
Задание 14
| Фенолфталеин принимает малиновую окраску в щелочной среде. Окраска появляется в растворах гидроксида калия и сульфида калия:
К2S + НОН  КНS + КОН КНS + КОН Определяем, в какой склянке находятся гидроксид калия и сульфид калия.
Приливаем к пробам растворов, в которых окраска фенолфталеина не изменилась, содержимое одной из склянок. Если выпадает белый осадок, не растворяющийся в избытке раствора реактива – это раствор сульфида калия, а анализируемый раствор содержит хлорид цинка.
К2S + ZnCl2 = ZnS↓ + 2КCl | 15 баллов |
| Если выпадает студенистый осадок, растворимый в избытке реактива, то приливаемый раствор содержит гидроксид калия, а анализируемый раствор содержит хлорид цинка.
2КОН + ZnCl2 = Zn(ОН)2↓ + 2КСl
Zn(ОН)2↓ + 2КОН = К2[Zn(OH)4] или
Zn(ОН)2↓ + 2КОН = К2ZnО2 + 2Н2О | 15 баллов |
| В склянке, к пробам которой при приливании растворов К2S и КОН видимых изменений не происходит, содержится хлорид бария. | 10 баллов |
| Итого 40 баллов |















