Зачетная работа по химии 9 класс
Задание 1. Химический элемент. Простое вещество.
а) Перечислите что входит в понятия: химический элемент, простое вещество.
б) Выберите два высказывания, в которых говорится о железе как о химическом элементе.
1) Железо реагирует с хлором.
2) Железо быстро ржавеет во влажном воздухе.
3) Пирит является сырьём для получения железа.
4) Гемоглобин, содержащий железо, переносит кислород.
5) В состав ржавчины входит железо.
Запишите номера выбранных ответов.
Ответ:
Задание 2. Строение атома. Строение электронных оболочек атомов.
а) Чему равен порядковый номер? Как находят число нейтронов?
б) На приведённом рисунке изображена модель атома химического элемента.
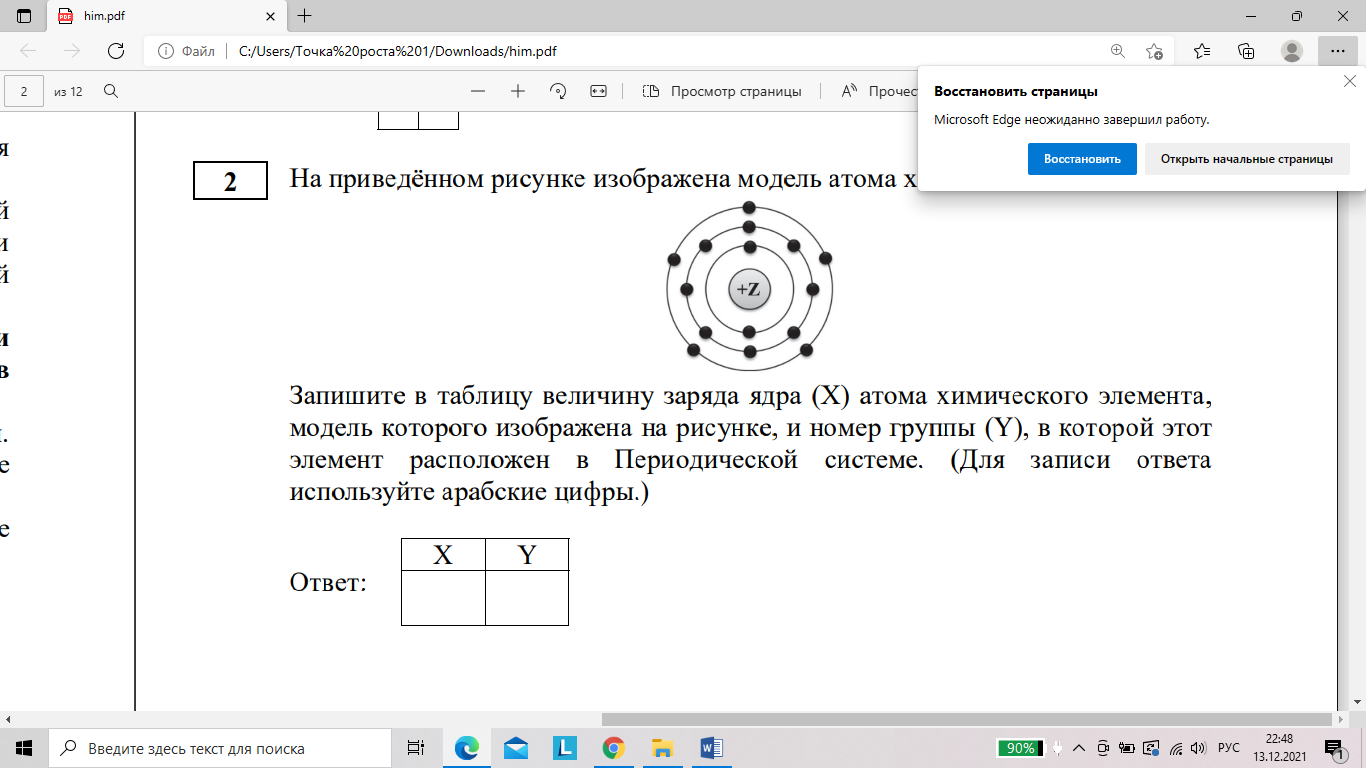
Запишите в таблицу величину заряда ядра (Х) атома химического элемента, модель которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе. (Для записи ответа используйте арабские цифры.)
Ответ:
Задание 3. Периодический закон и периодическая система элементов. Закономерности в ПСХЭ.
а) Какие свойства усиливаются в сторону фтора и франция?
б) Расположите химические элементы
1) сера 2) хлор 3) фосфор
в порядке увеличения их электроотрицательности.
Запишите номера элементов в соответствующем порядке.
Ответ:
Задание 4. Валентность и степень окисления.
Установите соответствие между формулой соединения и степенью окисления азота в этом соединении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЕДИНЕНИЯ СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
А) HNO3 1) +1
Б) N2O 2) –3
В) NH3 3) +3
4) +5
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
Задание 5. Химическая связь.
а) Напишите все типы химических связей и дайте объяснение.
б) Из предложенного перечня выберите два вещества с ионной связью.
1) СаО
2) РCl3
3) Br2
4) Li3N
5) H2S
Запишите номера выбранных ответов.
Ответ:
Задание 6. Основные классы неорганических соединений
а) Напишите основные классы неорганических соединений и их классификации.
б) Из предложенного перечня веществ выберите кислотный оксид и основание.
CO
Mg(OH)2
SO2
NaClO4
Al(OH)3
Задание 7. Химические свойства простых и сложных веществ.
а) Что такое простые и сложные вещества?
б) Установите соответствие между реагирующими веществами и продуктом(-ами) их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(Ы) ВЗАИМОДЕЙСТВИЯ |
| А) MgO + SO3 → Б) Mg(OH)2 + H2SO4 → В) Mg + H2SO4(разб.) → | → MgSО3 + H2 → MgSO4 + H2O → MgSO3 → MgSO4 + H2 → MgSO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
Задание 8. Химические свойства оксидов
Какие два вещества из предложенного перечня вступают в реакцию с оксидом алюминия?
1) Cu(OH)2
2) HNO3
3) O2
4) Be(OH)2
5) Na2O
Задание 9. Типы химических реакций
а) Перечислите основные типы химических реакций и приведите примеры.
б) Из предложенного перечня выберите две пары веществ, между которыми протекает реакция замещения.
1) железо и нитрат серебра
2) оксид серы(VI) и оксид железа(III)
3) оксид меди(II) и соляная кислота
4) алюминий и хлор
5) натрий и вода
Запишите номера выбранных ответов.
Ответ:
Задание 10. Условие и признаки протекания химических реакций
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРИЗНАК РЕАКЦИИ
А) FeCl3 (р-р) и NaOH (р-р) 1) выпадение белого осадка
Б) FeSO4 (р-р) и Ba(NO3)2 (р-р) 2) выпадение бурого осадка
В) FeS и H2SO4 (р-р) 3) выпадение серо-зелёного осадка
4) выделение газа
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
Задание 11. Электролитическая диссоциация.
а) Что такое электролитическая диссоциация? Что такое электролиты и неэлектролиты? Что такое ионы, катионы и анионы?
б) Выберите два вещества, при полной диссоциации 1 моль которых образуется 2 моль анионов.
1) нитрат магния
2) гидроксид бария
3) хлорид натрия
4) фосфат калия
5) сульфат натрия
Задание 12. Реакции ионного обмена
а) В каких случаях реакция ионного обмена протекает до конца?
б) Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
Ca2+ + SО32– = СаSО3
1) СаО
2) Ca
3) CaCl2
4) K2SO3
5) Н2SO3
6) SO2
Задание 13. Окислительно-восстановительные реакции
а) Что такое окислительно-восстановительные реакции? Что такое окислитель, восстановитель? Что такое процесс окисления и восстановления?
б) Установите соответствие между схемой процесса, происходящего в окислительно-восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА ПРОЦЕССА | | НАЗВАНИЕ ПРОЦЕССА |
| А S–2 → S0 | 1) | окисление |
| Б) H20 → 2H+ | 2) | восстановление |
| В) Cr+6 → Cr+3 | | |
Задание 14. Окислительно-восстановительные реакции
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
MnO2 + HBr → MnBr2 + Br2 + H2O
Определите окислитель и восстановитель.
| Задания 15 и 16 выполняются с использованием следующего текста. |
| Нитрат аммония (аммиачная селитра) – химическое соединение NH4NO3, соль азотной кислоты, которое используется в качестве азотного удобрения. |
Задание 15. Вычисление массовой доли химического элемента в веществе.
Вычислите в процентах массовую долю азота в нитрате аммония. Запишите число с точностью до целых.
Ответ: ___________________________ %.
Задание 16. Вычисление массы элемента по его массовой доле в веществе
При подкормках овощных и цветочных культур в почву вносится 200 г азота на 100 м². Вычислите, сколько граммов аммиачной селитры надо внести на земельный участок площадью 70 м². Запишите число с точностью до целых.
Ответ: ___________________________ г.
Задание 17. Вычисление массовой доли растворенного вещества.
После пропускания через раствор гидроксида натрия 2,24 л сернистого газа (н.у.) получили 252 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе.

















