Контрольная работа «Неметаллы»_Вариант №1
ЧАСТЬ А. (Задания 1 - 20 с выбором одного правильного ответа. 1 балл за правильный ответ)
Химическая реакция протекает между:
1. Br2 + H2SO4(раствор) 2. Br2 + HCI(раствор) 3. Br2 + NaCI(раствор) 4. Br2 + NaI(раствор)
Йод, в отличие от хлора, НЕ реагирует с
1. Алюминием 2. железом 3. бромидом натрия 4.фторидом натрия
Верны ли следующие суждения о неметаллах и их соединениях?
А. Все неметаллы реагируют с кислородом с образованием оксидов.
Б. Все оксиды неметаллов — кислотные.
1. верно только А 2. верно только Б 3. верны оба суждения 4. оба суждения неверны
Алюминий не вытесняет водород из
1. H2SO4(раствор) 2. H2SO4(разб.) 3. CH3COOH 4. HI
5. Сера реагирует с каждым из двух веществ:
1. H2 и HCI 2. CI2 и NaCI 3. HCI и NaOH 4. Mg и O2
Верны ли следующие суждения о свойствах углерода?
А. Для углерода характерны и восстановительные и окислительные свойства.
Б. При взаимодействии углерода с кислородом образуется угарный газ.
1. верно только А 2. верно только Б 3. верны оба суждения 4. оба суждения неверны
В каком ряду химические элементы расположены в порядке возрастания электроотрицательности?
1. O, N, C 2. Be, Mg, Ca 3. N, P, As 4. As, Se, Br
Неметаллические свойства наиболее выражены у
1. кремния 2. Кислорода 3. Бора 4. серы
9. Легче всего присоединяет электроны атом
1. серы 2. Хлора 3. Селена 4. брома
Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент 1. азот 2. Кремний 3. Бром 4. селен
Высший оксид состава ЭО2 образуют все элементы
1. 4 периода 2. IIA-группы 3. IVA-группы 4. 2 периода
Азот проявляет степень окисления –3 в каждом из двух соединений:
1. N2O3 и HNO2 2. NH3 и NF3 3. Mg3N2 и NH4CI 4. NaNO3 и HNO3
Степень окисления +4 в соединениях могут проявлять неметаллы
1. хлор и бор 2. углерод и кремний 3. фтор и кислород 4. кремний и бериллий
Степень окисления, равную +5, атом хлора проявляет в ионе
1. CIO4– 2. CIO3– 3. CIO2– 4. CIO–
15. Кристаллическая решетка твердого хлороводорода:
1. атомная 2. Молекулярная 3. Ионная 4. металлическая
16. Ионное строение имеет
оксид бора 2. оксид углерода (II) 3. оксид серы (IV) 4. оксид бария
17. Бром в твердом состоянии имеет кристаллическую решётку
1. молекулярную 2. металлическую 3. ионную 4. атомную
Молекулярное строение имеет
1. цинк 2. нитрат бария 3. гидроксид калия 4. сероводород
19. Кристаллическая решётка хлорида лития
1. металлическая 2. молекулярная 3. ионная 4. атомная
20. В схеме превращений: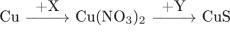
Определите вещества X и Y:
1. X – AgNO3, Y – K2S 2. X – HNO3, Y – S 3. X – KNO3, Y – H2S 4. X – Fe(NO3)2, Y – K2S
(Задания 21 – 23 на соотнесение. 2 балла за полный ответ)
21. Установите соответствие между названием вещества и формулами реагентов, с которыми оно может взаимодействовать.
| НАЗВАНИЕ ВЕЩЕСТВА | ФОРМУЛЫ РЕАГЕНТОВ |
| A) железо | 1) S, FeCI2, H2SO4 |
| Б) кислород | 2) Fe2S3, C2H5OH, NaOH |
| B) фосфор | 3) CuSO4, LiOH, Na2O |
| Г) цинк | 4) H2O, CI2, Fe2O3 |
|
| 5) S, H2S, Cu |
|
| 6) Br2, Mg, HNO3 |
22. Установите соответствие между реагирующими веществами и продуктами реакции.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| A) Fe(OH)2 + HCI(p-p) | 1) FeCI2 | + FeCI3 + H2O |
| Б) Fe(OH)3 + HCI(p-p) | 2) FeCI3 | + H2O |
| В) Fe3O4 + HCI(p-p) | 3) FeCI2 | + H2O |
| Г) Fe3O4 + KOH(тв.) | 4) K3[Fe(OH)6] |
|
| 5) KFeO2 + H2O |
|
| 6) Fe(OH)3 + KCI |
23. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
| НАЗВАНИЕ ОКСИДА | ФОРМУЛЫ ВЕЩЕСТВ |
| A) оксид калия | 1) H2O, MgO, LiOH |
| Б) оксид углерода (II) | 2) Fe2O3, H2O, Si |
| B) оксид хрома (III) | 3) H2, Fe3O4, O2 |
| Г) оксид фосфора (V) | 4) H2O, N2O5, H3PO4 |
|
| 5) H2SO4, NaOH, AI |
|
| 6) AI, N2O5, H2O |
ЧАСТЬ В. (задания со свободным ответом задания. 4 балла за полный ответ)
24. Осуществите схему превращений:
аммиак → азот → нитрид магния → аммиак → хлорид аммония → аммиак
Для реакций 1 составьте электронный баланс, для реакции 5 – ионные уравнения в полной и сокращенной форме. (7 баллов)
25. Сульфит натрия растворили в разбавленной серной кислоте. Выделившийся бесцветный газ растворили в воде и через полученный раствор пропустили газ, образовавшийся при растворении сульфида цинка в соляной кислоте. Осадок отфильтровали и растворили в концентрированной азотной кислоте. Напишите уравнения четырёх описанных реакций. (4 балла)
26. Решите задачу:
Навеску сульфида железа (II) массой 22 г. обработали соляной кислотой. Весь образовавшийся газ пропустили через 12%-й раствор гидроксида натрия массой 150 г. Вычислите массовые доли солей в растворе после реакции. (4 балла)
Контрольная работа «Неметаллы»_Вариант №2
ЧАСТЬ А. (Задания 1 – 20 с выбором одного правильного ответа. 1 балл за правильный ответ)
С водой при обычной температуре взаимодействуют
1. кислород и сера 2. фтор и калий 3. кремний и кальций 4. железо и медь
Общим свойством серебра и железа является их способность растворяться в
1. воде 2. серной кислоте (р-р) 3. азотной кислоте (конц.) 4) растворе щелочи
Верны ли следующие суждения о свойствах железа?
А. При взаимодействии железа с разбавленной хлороводородной кислотой образуется хлорид железа (II).
Б. При взаимодействии железа с хлором образуется хлорид железа (II).
1. верно только А 2. верно только Б 3. верны оба суждения 4. оба суждения неверны
При обычных условиях практически осуществима реакция между железом и
1. серой (тв.) 2. серной кислотой (конц.) 3. нитратом меди (II) (р-р) 4. нитратом цинка (р-р)
Верны ли следующие суждения о свойствах углерода?
А. При обычной температуре углерод инертен.
Б. При нагревании углерод является сильным восстановителем.
1. верно только А 2. верно только Б 3. верны оба суждения 4. оба суждения неверны
Какие вещества не взаимодействуют между собой?
1. AI и CI2 2. Ca и H2O 3. Na и H2 4. Cu и FeSO4
Характер оксидов в ряду: Li2O → BeO → B2O3 изменяется от
1. основного к кислотному 2. основного к амфотерному
3. амфотерного к кислотному 4. кислотного к основному
В порядке возрастания неметаллических свойств элементы расположены в ряду:
1. B →C → N → O 2. CI → S → P → Si 3. O → S → Se → Te 4. N → P → As → Sb
Кислотные свойства водородных соединений усиливаются в ряду:
1. HF → HCI → HBr → HI 2. HI → HBr → HCI → HF
3. HF → H2O → NH3 → CH4 4. HCI → H2S → PH3 → SiH4
Атом серы имеет минимальную возможную степень окисления в соединении:
1. CaSO3 2. H2SO4 3. Na2S 4. SO3
Из перечисленных элементов наиболее электроотрицательным является
1. азот 2. Кислород 3. Хлор 4. фтор
Азот проявляет степень окисления +3 в каждом из двух соединений:
1. HNO3 и NH3 2. NH4CI и N2O3 3. KNO3 и N2H4 4. HNO2 и N2O3
В ионе аммония NH4+ степень окисления атома азота равна
1. +1 2. +3 3. -3 4. -5
Хлор проявляет положительную степень окисления в соединении с
1. серой 2. Водородом 3. Кислородом 4. железом
Хлорид бария имеет кристаллическую решётку
1. атомную 2. металлическую 3. Ионную 4. молекулярную
Веществом молекулярного строения является
1. озон 2. оксид бария 3. Графит 4. сульфид калия
Немолекулярное строение имеет каждое из двух веществ:
1. S8 и O2 2. Fe и NaCI 3. CO и Mg 4. Na2CO3 и I2(тв)
Оксид серы (IV) в кристаллическом состоянии имеет кристаллическую решётку
1. ионную 2. Металлическую 3. Молекулярную 4. атомную
Ионное строение имеет
1. оксид кремния 2. оксид фосфора (V) 3. оксид азота (II) 4. оксид лития
В схеме превращений 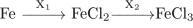 веществами «X1» и «X2» могут быть соответственно
веществами «X1» и «X2» могут быть соответственно
1. CI2 и HCI 2. HCI и NaCI 3. HCI и CI2 4. CI2 и O2
(Задания 21 – 23 на соотнесение. 2 балла за полный ответ)
Установите соответствие между простым веществом и реагентами, с каждым из которых оно может реагировать.
| НАЗВАНИЕ ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) азот | 1) KNO3, CO2, Au |
| Б) йод | 2) CI2, KOH, SiO2 |
| В) графит | 3) Ca, O2, H2 |
| Г) железо | 4) HCI, Fe2O3, S |
|
| 5) NaOH, HNO3, H2 |
|
| 6) H2SO4, CO, Ca(OH)2 |
22. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩСЕТВА | ПРОДУКТЫ |
| А) Ca(HCO3)2 + Ca(OH)2 | 1) CaCO3 + H2O |
| Б) Ca(HCO3)2 + H2SO4 | 2) CaCO3 | + CO2 + H2O |
| В) Ca(HCO3)2 → | 3) CaSO4 | + H2O |
| Г) CaCO3 + CO2 + H2O | 4) CaSO4 | + CO2 + H2O |
|
| 5) CaCO3 | + CO2 |
|
| 6) Ca(HCO3)2 |
23. Установите соответствие между схемами превращений и формулами веществ, необходимых для их последовательного осуществления.
| СХЕМЫ ПРЕВРАЩЕНИЯ | ФОРМУЛЫ ВЕЩЕСТВ |
| А) Fe → Fe2(SO4)3 → Fe → FeCI2 | 1) H2SO4, Mg, HCI |
| Б) Si → Mg2Si → Mg(OH)2 → MgSO4 | 2) Ca, H2O, O2 |
| В) Si → Ca2Si → Ca(OH)2 → CaSiO3 | 3) H2SO4, Mg, CI2 |
| Г) Si → Ca2Si → SiH4 → SiO2 | 4) Mg, H2O, H2SO4 |
|
| 5) Ca, H2O, SiO2 |
ЧАСТЬ В. (задания со свободным ответом задания)
Осуществите схему превращений:
аммиак → азот → аммиак → нитрат аммония → аммиак → оксид азота (II)
Для реакций 5 составьте электронный баланс, для реакции 4 – ионные уравнения в полной и сокращенной форме. (7 баллов)
На кристаллический хлорид натрия подействовали концентрированной серной кислотой. Образовавшийся газ растворили в воде и в получившийся раствор добавили необходимое количество оксида меди (II). Полученный раствор смешали с раствором нитрата серебра, выпавший при этом осадок отделили. К оставшемуся раствору добавили раствор иодида калия. Напишите уравнения четырёх описанных реакций. (4 балла)
26. Решите задачу: Сернистый газ, полученный при обжиге 8 г. пирита, содержащего 75% FeS2, пропустили через 120 г. 5%-го раствора гидроксида натрия. Вычислите массовые доли солей в растворе после реакции. (4 балла)















