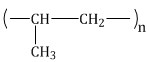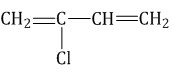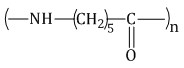СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Теория к заданиям 25
Просмотр содержимого документа
«Теория к заданиям 25»
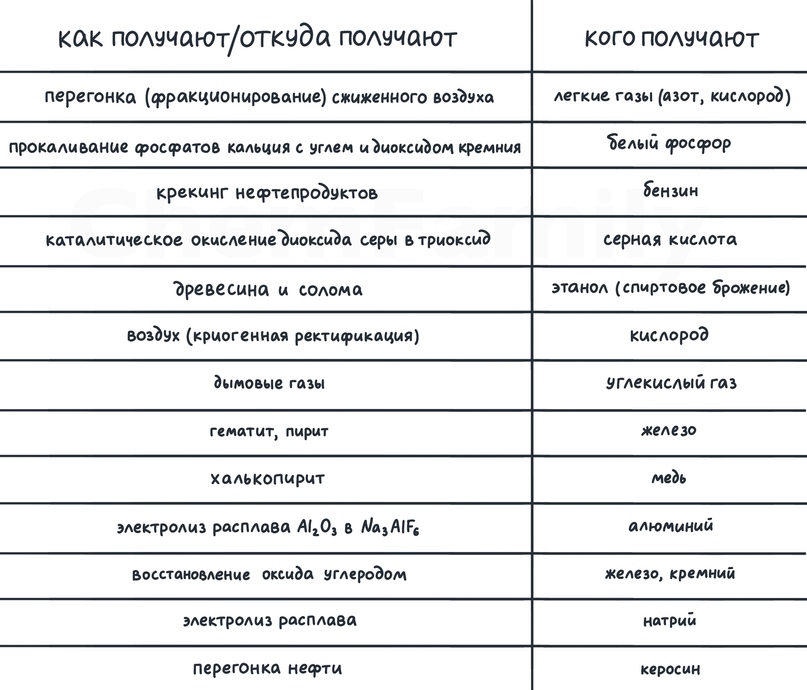
Применение веществ
Тут нужно сопоставить вещество и сферу его применения. Надо понимать, что очень много что может быть использовано для много чего, поэтому в задании просят соотнести вещество именно с основной сферой его применения. Надо прочувствовать логику ЕГЭ и не придумывать своего.
Основные типы удобрений – нитратные и фосфатные:
используются в качестве удобрений: нитрат аммония, нитрат калия, карбамид, суперфосфат, гидрофосфат кальция
используются для производства удобрений: аммиак, серная кислота
Подобное растворяется в подобном. Поэтому если надо растворить полярное вещество, то используется полярный растворитель. А если неполярное вещество – неполярный растворитель:
неполярные растворители: этилацетат, ацетон, толуол, тетрахлорметан
полярные растворители: этанол, вода
Для производства стекла можно использовать не только оксид кремния(IV), но и много чего еще. Например, соду.
Водоочистные станции:
водоподготовка (осветление, умягчение, обессоливание воды и т.п.) — сульфат алюминия
водоочистка — хлор, озон
адсорбент — активированный уголь
Анилин используется для производства красителей – бриллиантовый зеленый (зеленка), метиленовый синий.
Пищевая промышленность:
сода – разрыхлитель теста (в реакции с лимонной кислотой выделяется углекислый газ) и чистящее средство
консерванты: уксусная кислота, фосфорная кислота, бензойная кислота
лимонная кислота — пищевая промышленность, снятие накипи со стенок металлической посуды
NaCl – соль (любой солью картошечку не посолишь)
Топливо:
этанол, метан, пропан (для автомобилей)
Для производства полимеров применяют:
этилен, пропен, изопрен, капрон, бутадиен-1,3 (каучук, резина), триацетат целлюлозы (искусственный шелк)
Для выплавки чугуна (сплава железа с углеродом):
оксид железа(III), кокс
Отдельные факты:
сульфат меди(II) — средство защиты растений (из-за окислительных свойств)
ацетилен — для газовой сварки металлов, получения хлорвинила
этиленгликоль — компонент автомобильных антифризов и тормозных жидкостей
стеарат натрия — для производства моющих средств
целлюлоза — для производства бумаги
азот — для производства аммиака
азотная кислота — для получения нитросоединений
медь — для изготовления электропроводов
полипропилен — для изготовления упаковочной пленки
перекись водорода— отбеливатель, обработка небольших ран (антисептик)
NaClO — отбеливатель
кумол — для получения фенола
алюминий — для производства сплавов для самолетостроения
оксид алюминия — для производства жаропрочных материалов
этен — для производства этанола
CO — в качестве реагента при производстве метанола
глицерин — в составе косметики
Техника
В заданиях это типа надо выбрать, для чего используются те или иные аппараты.
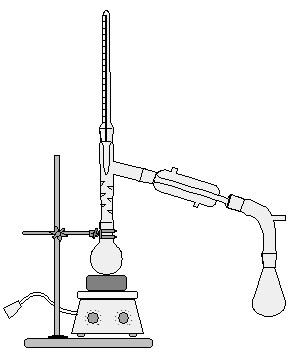
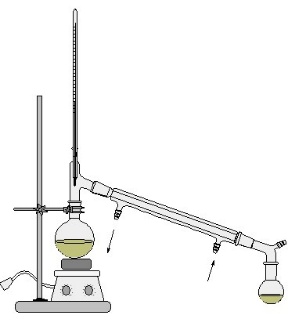
Ректификационная колонна

Колба подогревается до определенной температуры, при которой один из компонентов смеси испаряется. Пары вещества поднимаются вверх, где охлаждаются и конденсируются. Конденсат стекает по трубке в другую колбу. Так, нагревая исходную смесь до разных температур, можно разделить ее на составляющие.
Ректификационная колонна используется для перегонки нефти. Перегонка нефти это разделение ее на фракции (бензин, керосин и т.п.).
Колонна синтеза
Колонна синтеза это, грубо говоря, большой сосуд для проведения реакций между газами. Конечно, в реальности она устроена сильно сложнее, но для ЕГЭ это не надо.
С помощью колонны синтеза получают аммиак (из водорода и азота) и метанол (из угарного газа и водорода).
Получение серной кислоты
Есть 2 способа: контактный и башенный. Контактный способ является основным и включает три этапа:
Сжигание пирита (FeS₂) в кипящем слое с получением SO₂ (проводят в печи для обжига)
Окисление SO₂ до SO₃ в контактном аппарате в присутствии катализатора V₂O₅. Окисление SO₂ до SO₃ — обратимая, каталитическая, экзотермическая реакция
Абсорбция SO₃ концентрированной серной кислотой с получением олеума в поглотительной башне
В башенном способе используется реакция, которая проходит НЕ в колонне синтеза: SO₂ + NO₂ + H₂O → H₂SO₄ + NO.
Получение резины
полимеризация изопрена → натуральный каучук
или полимеризация дивинила → синтетический каучук
каучук + S → резина
(вулканизация каучука)
Разное
Электролизер — аппарат для проведения электролиза. Электролизом получают натрий.
Доменная печь — печь для выплавки чугуна. Внутри оксиды железа восстанавливаются угарным газом до железа. Основной особенностью доменной печи является то, что ее нельзя просто взять и погасить, иначе металл внутри застынет.
Компрессор — для сжатия газовой смеси.
Сепаратор — для отделения жидкостей от газов.
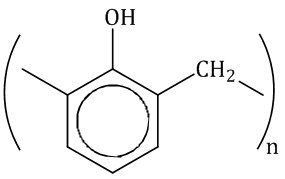
Полимеры
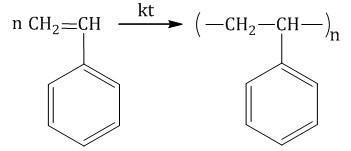
В этом типе задания надо соотнести полимеры и их мономеры. В основном, все следует из обычной теории по органике. Например, полимером полиэтилена является этилен. Подробнее читай об этом в статье по алкенам. Внимание на себя обращают несколько полимеров.
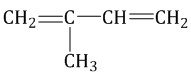
бутадиен-1,3 → дивиниловый каучук
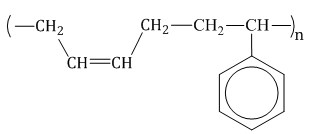
изопрен → натуральный каучук
глюкоза → крахмал
глюкоза → целлюлоза
капролактам → капрон
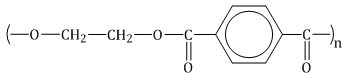
терефталевая кислота → полиэтилентерефталат (лавсан)
тетрафторэтилен → тефлон
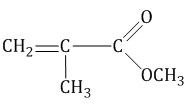
Еще может попасться вариант задания, где то же самое спрашивается в виде формул. Надо научиться писать реакции полимеризации (если не умеешь, смотри в алкенах). Но вот пара необычных молекул:
![]()
тефлон
![]()
капрон
фенолформальдегидная смола
Типы волокон
Натуральные полимеры: хлопок, ДНК, РНК, крахмал, натуральный каучук, лен, шелк.
Искусственные полимеры: вискоза, ацетатный шелк.
Синтетические полимеры: нейлон, капрон, лавсан, дивиниловый каучук, поливинилхлорид, акрил, лайкра, полиэстер.
Неорганические полимеры: стекловолокно, асбест.
Искусственные полимеры получаются путем модификации природных полимеров, а синтетические создаются с нуля.
Полимеры можно получать полимеризацией (без образования побочных продуктов) или поликонденсацией (с образованием побочных продуктов). Если в поликонденсацию вступает несколько молекул, то это сополиконденсация (образование фенолформальдегидной смолы).
Способы разделения
В этом типе задания дается смесь веществ, и нужно выбрать оптимальный способ разделения этой смеси.
Делительная воронка используется для разделения двух жидкостей при условии, что одна из них является гидрофильной, а другая гидрофобной. Со временем смесь жидкостей в воронке расслаивается из-за несмешиваемости и становится возможным слить нижнюю фракцию.
Декантация подобна разделению с помощью делительной воронки, только в делительной воронке сливается нижняя фаза, а в декантации верхняя.
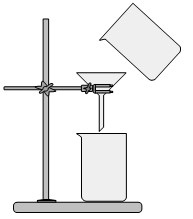
Фильтрование используется для отделения из раствора нерастворимого вещества.
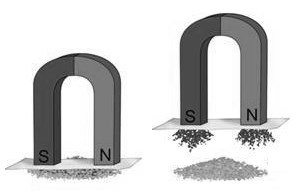
С помощью магнита можно разделить смесь двух металлов при условии, что один из них намагничивается.
С помощью фракционной перегонки разделяют смешиваемые жидкости. Например, если нагревать смесь воды и спирта, то спирт испарится раньше воды. Пары спирта можно будет собрать, охладить и поместить в отдельную емкость.
Если есть смесь двух твердых веществ, одно из которых растворимо в воде, а другое нет, то их можно разделить с помощью обработки водой, фильтрования и выпаривания раствора.
Способ получения
В этом задании надо соотнести вещество и основной источник его промышленного полученияя:
воздух → аммиак
(воздух является источником азота)
хлорид натрия → гидроксид натрия
(при электролизе раствора хлорида натрия одним из продуктов является гидроксид натрия)
природный газ → метан (основной компонент)
попутный нефтяной газ → пропан
крекинг нефти → этилен
высокотемпературная обработка метана → ацетилен
перегонка нефти → бензин, керосин
Лабораторная посуда
фарфоровая чашка → упаривание растворов
металлический шпатель → взятие небольших порций сыпучих веществ
ступка с пестиком → измельчение твердых веществ
мензурка → измерение объема жидкости
НеФИПИшная теория
То, что будет дальше, попадалось в разных авторских вариантах. Выучить это можно, но только после того как не будет проблем с основной теорией.
Методы получения веществ
Применение веществ
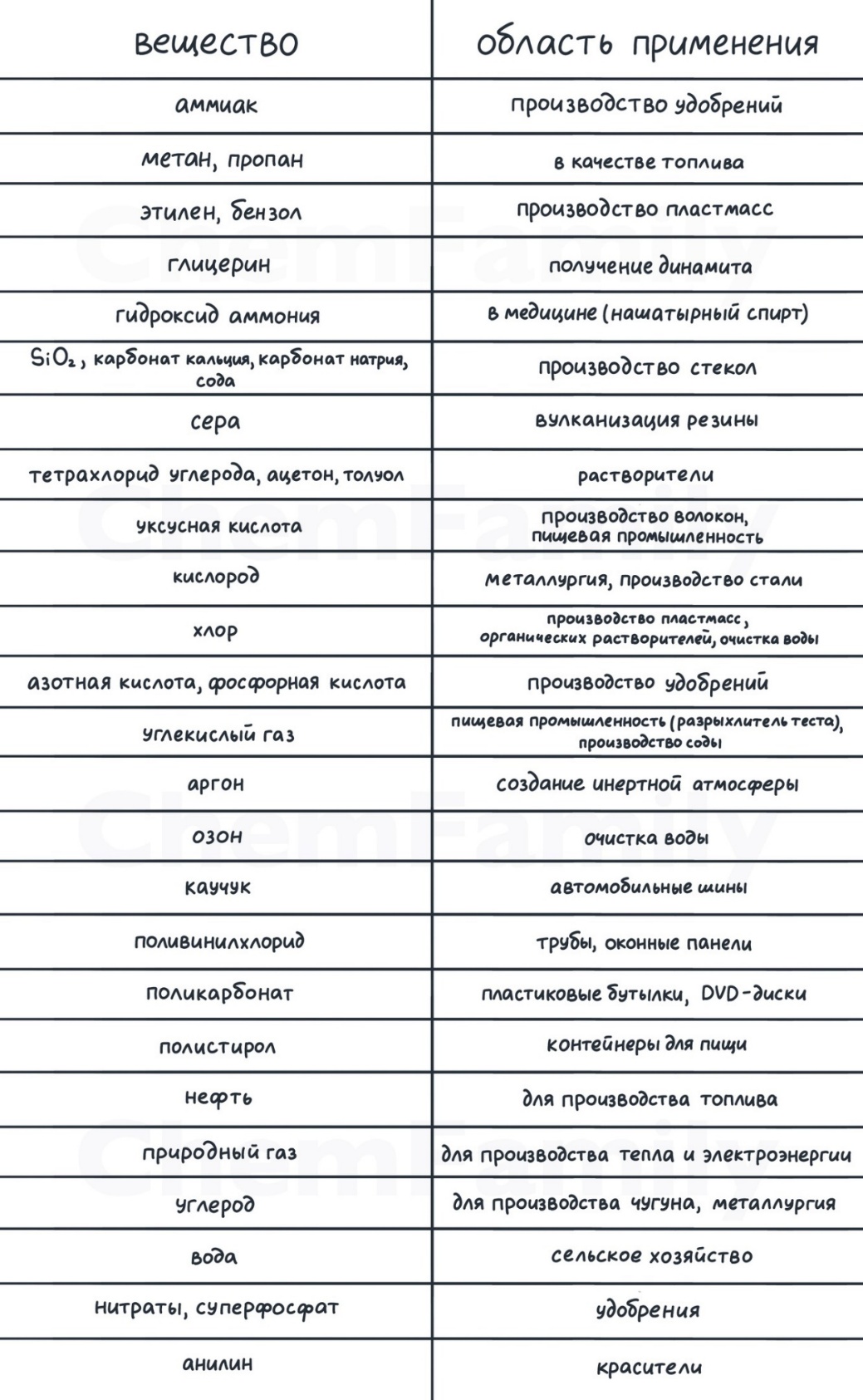
Окрашивание пламени
Разные соли окрашивают пламя горелки в разный цвет в зависимости от их состава:
Cu²⁺ и BO₃³⁻ → зеленый
Ba²⁺ → желто-зеленый
Na⁺→ желтый
Sr²⁺→ карминово-красный
Ca²⁺→ кирпично-красный
Li⁺→ красный
K⁺ → фиолетовый
Лабораторная посуда
Пипетка - для отбора раствора определенного объема
Бюретка - для титрования
Делительная воронка - для разделения несмешивающихся жидкостей
Колба Вюрца - составная часть прибора для перегонки
Колба Бунзена - для вакуумного фильтрования
Хлоркальциевая трубка - для осушения газов
Прямой холодильник - составная часть прибора для перегонки
Обратный холодильник - конденсирование паров и возврат конденсата в реакционный сосуд
Мерный цилиндр (стакан) - для измерения объема растворов
Пробирка - для проведения химических реакций
Фарфоровая ступка - для измельчения твердых веществ
Круглодонная колба - реакционная емкость для работы в вакууме или для нагревания раствора
Воронка Бюхнера - фильтрация под вакуумом
Фильтр Шотта - фильтрация под вакуумом
Фарфоровый тигель - для прокаливания в печи
Аппарат Киппа - для получения газов
Бокс - для хранения твердых веществ
Правила работы в лаборатории
Техника безопасности при работе в химической лаборатории. При работе в лаборатории необходимо строго соблюдать правила и инструкции техники безопасности.
1. В химической лаборатории можно работать только в халате. Халат должен быть застегнут на все пуговицы. Длинные волосы необходимо подбирать (убрать в пучок или иным способом).
2. На рабочем столе могут находиться только те вещи, которые необходимы для выполнения работы. На рабочем месте необходимо поддерживать чистоту и порядок.
3. Перед выполнением работы необходимо познакомиться с описанием работы, последовательностью действий, которые необходимо выполнять во время работы. При работе с приборами и установками необходимо изучить их устройство и правила работы с ними.
4. Категорически запрещено работать в лаборатории одному, так как при несчастном случае никто не сможет оказать помощь пострадавшему, вызвать помощь, ликвидировать последствия аварии и т.д.
5. В лаборатории категорически запрещается курить, принимать пищу и воду. Также в лаборатории запрещено хранить продукты питания.
6. Помещение обязательно должно быть оборудовано противопожарным оборудованием (средства пожаротушения: огнетушители в рабочем состоянии и др.). Все работники лаборатории должны знать, где находятся средства пожаротушения, а также аптечка.
7. Неизрасходованные реактивы нельзя высыпать и выливать обратно в те сосуды, откуда они были взяты.
8. При работе в лаборатории необходимо соблюдать чистоту и аккуратность. Вещества не должны попадать на кожу лица и рук, так как многие вещества вызывают раздражение кожи и слизистых оболочек.
9. Необходимо использовать только целую и чистую лабораторную посуду. После завершения работы необходимо помыть лабораторную посуду.
10. После окончания работы необходимо выключить газ, воду, электроэнергию.
11. При нагревании растворов и веществ в пробирке необходимо использовать держатель. Во время нагревания жидких и твердых веществ в пробирках и колбах нельзя направлять отверстия сосудов на себя и соседей. Может произойти внезапный выброс вещества.
12. Вещества в лаборатории категорически запрещается пробовать на вкус.
13. Чтобы определить запах вещества, необходимо осторожно направить на себя пары вещества или газы легким движением руки — от сосуда с веществом к лицу. Нельзя наклоняться к сосуду и нельзя вдыхать пары полной грудью.
14. Твердые химические реактивы можно брать только шпателем, пинцетом или ложечкой (ни в коем случае не руками!).
15. Жидкости категорически запрещается набирать в пипетки ртом. Для набора жидкости в пипетку используется специальная груша. Жидкие химические вещества следует переливать, обязательно пользуясь воронкой.
16. При появлении любых вопросов необходимо обращаться к преподавателю.
Лабораторная посуда и оборудование
| Оборудование | Название оборудования | Назначение |
|
| Делительная воронка | Для разделения несмешивающихся жидкостей |
|
| Бюретка | Для отбора точных объёмов жидкостей |
|
| Пипетка Мора | Для отбора точных объёмов жидкостей |
|
| Мерный цилиндр | Для отбора точных объёмов жидкостей |
|
| Воронка химическая | Для фильтрования растворов |
|
| Колба двугорлая | Для проведения химических синтезов |
|
| Колба трехгорлая | Для проведения химических синтезов |
|
| Колба Бунзена | Для проведения перекристаллизации |
|
| Бюкс | Для хранения веществ |
|
| Пробирка | Для проведения химических опытов |
|
| Химический стакан | Для приготовления и отбора порции растворов |
|
| Мерная колба | Для приготовления растворов с заданной концентрацией |
|
| Колба коническая | Для проведения химических опытов |
|
| Колба круглодонная | Для проведения химических опытов |
|
| Штатив | Для проведения химических опытов |
|
| Шпатель химический | Отбор твердых веществ |
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
К ядовитым веществам относятся:
1. Вещества, раздражающие слизистые оболочки и действующие на кожные покровы: щелочи, кислота, газообразный аммиак, оксиды азота, оксиды серы (VI) и (IV).
2. Вещества, которые воздействуют на нервную систему, например, аммиак, сероводород, бензол и др.
3. Вещества, поражающие кровь и органы: оксид углерода (II), соединения свинца и др.
К горючим веществам относятся бензин, ацетон, метиловый и этиловый спирты, толуол и др.
К едким веществам относятся концентрированные кислоты и щелочи, концентрированные растворы некоторых солей и др.
При работе с горючими, едкими и токсичными веществами необходимо соблюдать следующие правила безопасности:
1. Категорически запрещается сливать в раковину легковоспламеняющиеся и горючие жидкости, концентрированные растворы кислот и щелочей. Их необходимо собирать в специальные герметические сосуды.
2. Работу с кислотами, твердыми щелочами, едкими и токсичными веществами проводить только в защитных очках и перчатках. При растворении твердых щелочей в воде необходимо добавлять щелочь небольшими порциями в воду, избегая перегревания раствора. Разбавление кислот или щелочей необходимо производить в жаростойкой посуде.
3. Кислота в воду или вода в кислоту? При разбавлении концентрированных кислот и щелочей необходимо небольшими порциями приливать кислоту (или концентрированный раствор щелочи) в воду, а не наоборот. Растворение кислот и щелочей в воде сопровождается выделением большого количества теплоты. Небольшая порция воды может нагреться при добавлении в кислоту, смесь закипит и может попасть на лицо или руки. Поэтому необходимо добавлять небольшое количество кислоты в большое количество воды.
4. При разливе легковоспламеняющейся или горючей жидкости необходимо отключить все электроприборы и погасить газовые горелки. Место разлива засыпают песком, который затем удаляют с помощью лопатки. Запрещено использовать металлические совки, т.к. они могут дать искру и вызвать пожар.
5. Кислоту, пролитую на пол, нейтрализуют содой, а щелочь нейтрализуют борной кислотой. Для удаления нейтрализованных жидкостей также используют песок. Нейтрализацию и уборку концентрированных кислот необходимо проводить в противогазе.
6. При ожоге кислотой необходимо немедленно промыть пораженное место большим количеством воды. После чего промыть место поражения двухпроцентным раствором соды.
7. При ожоге щелочью необходимо длительное промывание пораженного места под струей воды, затем однопроцентным раствором борной кислоты или уксусной кислоты.
8. При ожоге глаз кислотой или щелочью необходимо немедленно промыть глаза водой длительное время.
9. Работы с токсичными, легковоспламеняющимися или горючими веществами необходимо проводить строго под включенной вытяжкой.
10. Легковоспламеняющиеся и горючие жидкости запрещено нагревать на открытом пламени.
11. Запрещено сливать горючие, едкие и токсичные вещества в канализацию. Для их утилизации и слива используют специальные емкости.
12. Работа с плавиковой кислотой требует особой осторожности и проводится обязательно в вытяжном шкафу. Хранить плавиковую кислоту необходимо в полиэтиленовой таре (угадайте, почему).
13. Щелочные и щелочноземельные металлы необходимо хранить в сосуде, не пропускающем ультрафиолет, под слоем керосина или другого инертного по отношению к этим металлам вещества. При работе с этими металлами необходимо соблюдать осторожность, избегать контакта этих металлов с водой. Запрещается трогать щелочные или щелочноземельные металлы руками. Небольшие остатки таких металлов запрещается выкидывать в канализацию или мусорное ведро. Их необходимо «погасить» этанолом или другим веществом (но не водой!).

При работе со средствами бытовой химии также необходимо соблюдать определенные правила:
1. В обязательном порядке пользуйтесь перчатками при работе с агрессивными средствами бытовой химии. Если вы работаете с хлорсодержащими препаратами, рекомендуется надеть специальные защитные очки из пластика.
2. Не забывайте тщательно удалять остатки чистящих или моющих средств после каждой уборки. Многие порошки состоят из мелких частиц, которые оставаться на поверхностях и вещах. При испарении такие химикаты выделяют ряд вредных веществ.
3. Хранить средства бытовой химии следует в герметично закрытых ёмкостях вдали от источников тепла и прямого солнечного света.
4. Все средства бытовой химии следует применять только по прямому назначению, строго соблюдая инструкции и рекомендации по их использованию.
Методы разделения смесей и очистки веществ1. Разделение жидкостейПерегонка – разделение жидкостей, различающихся по температуре кипения.
|
| Перегонку проводят в приборе, состоящем из колбы Вюрца (или круглодонной колбы с газоотводной трубкой), прямого холодильника, колбы-приемника, аллонжа, термометра и нагревательного прибора. Смесь жидкостей нагревают в перегонной колбе до температуры кипения каждого компонента, пары отводят в холодильник и собирают сконденсировавшуюся жидкость в приемник, отдельно каждый компонент смеси. |
Дистилляция – очистка воды от твердых примесей.
|
| Загрязненную жидкость нагревают в перегонной колбе до температуры кипения, пары отводят в холодильник и собирают сконденсировавшуюся жидкость в приемник. |
2. Разделение жидкостей и твердых веществ
Фильтрование – метод разделения жидкостей и твердых веществ.
|
| Фильтрованием отделяют нерастворимые твердые вещества от жидкости. |
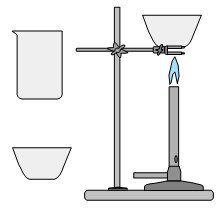
Выпаривание – метод разделения жидкостей и твердых веществ.
|
| Выпариванием отделяют воду от растворенных в ней веществ. |
Декантация – сливание жидкости с отстоявшегося осадка. К ней целесообразно прибегать в тех случаях, когда в сравнительно большом количестве жидкости находится немного твердого вещества, которое легко оседает на дно.
3. Разделение смесей твердых веществ
| Отстаивание | Магнитная сепарация |
| Например, смесь хлорида натрия и карбоната кальция можно разделить растворением в воде и последующим отстаиванием
| Например, смесь серы и железных опилок можно разделить с помощью магнита:
|
Сублимация (возгонка) — очистка твердых веществ, способных при нагревании переходить непосредственно из твердой фазы в газообразную, минуя жидкую фазу. Образующийся газ конденсируется охлаждаемой частью прибора. Сублимацию обычно проводят при температуре, близкой к температуре плавления вещества. Возгонкой можно очистить йод, серу, хлорид аммония.
Перекристаллизация. При повышенной температуре готовят насыщенный раствор очищаемого вещества, затем для удаления нерастворимых примесей раствор фильтруют через воронку для горячего фильтрования и охлаждают до низкой температуры. При понижении температуры растворимость вещества понижается, и основная часть очищаемого вещества выпадает в осадок, растворимые примеси остаются в растворе.
Хроматография. Метод разделения и анализа смесей веществ, который основан на распределении веществ между двумя фазами – неподвижной (твердая фаза или жидкость, связанная на носителе) и подвижной (газовая или жидкая фаза, элюент).
| Колоночная хроматография | Бумажная хроматография |
|
|
|
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
Обогащение природной руды (очистка, удаление примесей)
Получение металла или его сплава.
Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
| Нахождение металлов в природе | ||
| Активные металлы — в виде солей | Металлов средней активности — в виде оксидов и сульфидов | Малоактивные металлы -в виде простых веществ |
| Хлорид натрия NaCl
|
|
|
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
CaCl2 → Ca + Cl2
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
2Al2O3 → 4Al + 3O2
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.

Например, железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.

Например, железо можно получить восстановлением из оксида с помощью угарного газа:
2Fe2O3 + 6CО → 4Fe + 6CO2
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:

Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например, при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.
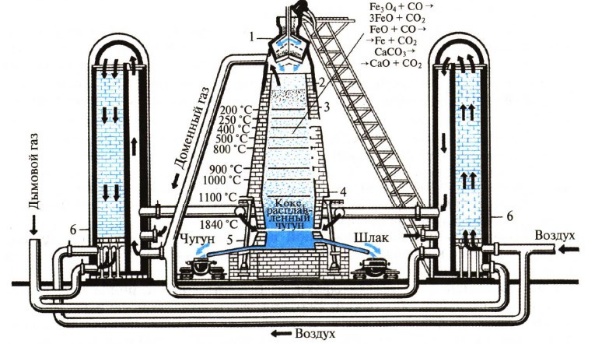
1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
C + O2 = CO2
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Fe2O3 → Fe3O4 (FeO·Fe2O3) → FeO → Fe
Последовательность восстановления оксида железа (III):
3Fe2O3 + CO → 2Fe3O4 + CO2
Fe3O4 + CO → 3FeO + CO2
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
Fe2O3 + 3CO → 2Fe + 3CO2
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
CaCO3 → CaO + CO2
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
CaO + SiO2 → CaSiO3
Получение аммиака
В промышленности аммиак получают по методу Габера – прямым взаимодействием азота и водорода в реакционной колонне:
N2 + 3Н2 ⇄ 2NH3
Реакция азота с водородом обратимая, экзотермическая, гомогенная (газофазная). Для увеличения выхода аммиака необходимо смещать равновесие в сторону продукта. Согласно принципу Ле-Шателье, для смещения равновесия вправо в данной реакции необходимо повышать давление и понижать температуру. Однако низкая температура уменьшит скорость реакции.
Поэтому для повышения скорости реакции температура в процессе поддерживается все-таки высокой, 500-550оС и в присутствии катализатора.
А для смещения равновесия применяют очень высокие давления 15-30 МПа.
В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
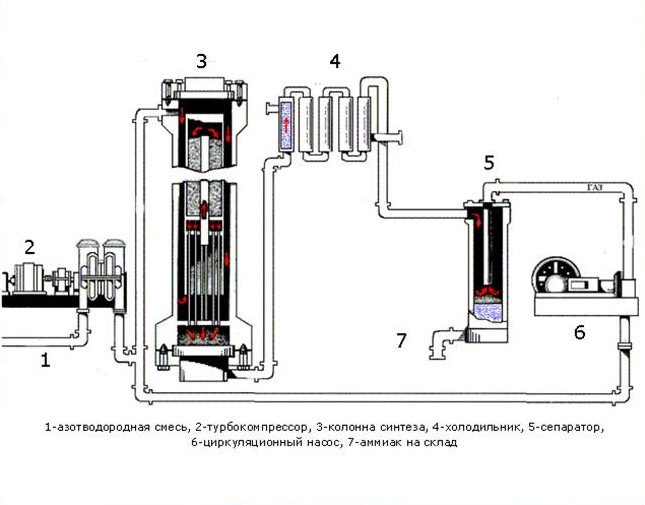
Рассмотрим процессы, протекающие на разных участках производства аммиака:
1 этап. Трубопровод. В трубопровод подается предварительно подготовленная азотно-водородная смесь (N2:Н2=1:3) в соотношении 1 к 3.
2 этап. Турбокомпрессор. Турбокомпрессор используется для сжатия исходной смеси газов с целью повышения давления. Синтез аммиака проводится при очень высоком давлении (15-30 МПа, или 150-300 атм).
3 этап. Колонна синтеза. В колонне синтеза (контактном аппарате) производится синтез аммиака. Азотно-водородная смесь продавливается через полки с катализатором. Процесс синтеза протекает обратимо (т.е. частично) и является сильно экзотермическим, протекает с большим выделением тепла. Часть выделяющегося тепла расходуется на нагревание поступающей азотоводородной смеси с помощью теплообменников. Смесь, выходящая из колонны синтеза в холодильник, состоит из аммиака (20-30%) и не прорегировавших азота и водорода.
4 этап. Холодильник. В холодильнике реакционная смесь, которая выходит из колонны синтеза, охлаждается и направляется на дальнейшее разделение в сепаратор.
5 этап. Сепаратор. После прохождения холодильника температура реакционной смеси значительно снижается, и аммиак переходит в жидкую фазу. В сепараторе происходит разделение реакционной смеси, жидкий аммиак отделяют от азота и водорода и отправляют на склад.
6 этап. Циркуляционный насос. Циркуляционный насос возвращает не прореагировавшую смесь азота и водорода в контактный аппарат. Благодаря циркуляции удаѐтся довести использование азотводородной смеси (конверсию) до 95%.
Производство серной кислоты
Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита (серного колчедана) FeS2.
Основные стадии получения серной кислоты :
Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
Очистка полученного газа от примесей.
Окисление сернистого газа в серный ангидрид.
Взаимодействие серного ангидрида с водой.
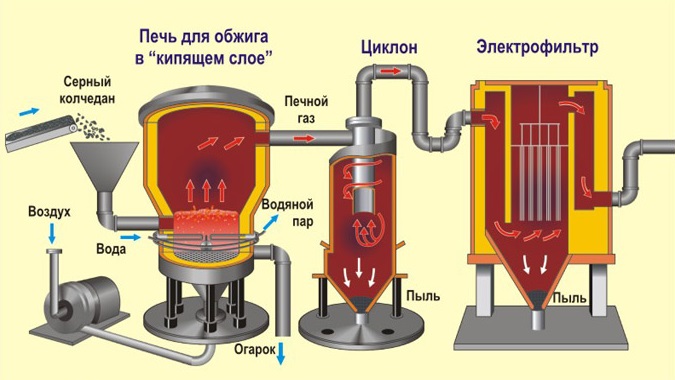
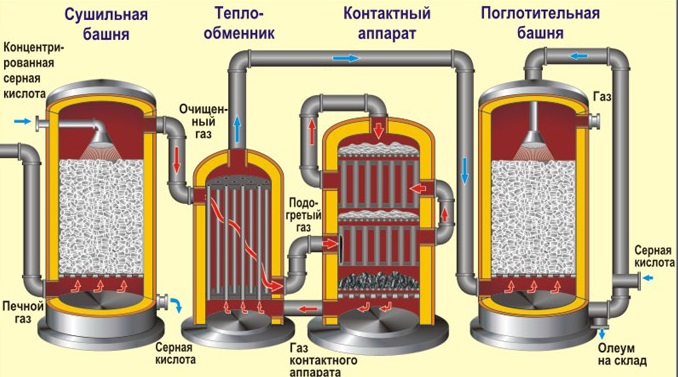
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3): температура: оптимальной температурой для протекания прямой реакции с максимальным выходом SO3 является температура 400-500оС. Для того, чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор – оксид ванадия (V) V2O5. давление: прямая реакция протекает с уменьшением объемов газов. Для смещения равновесия вправо процесс проводят при повышенном давлении. Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |


Общие научные принципы химического производства:
Непрерывность.
Противоток
Катализ
Увеличение площади соприкосновения реагирующих веществ.
Теплообмен
Рациональное использование сырья
Производство метанола
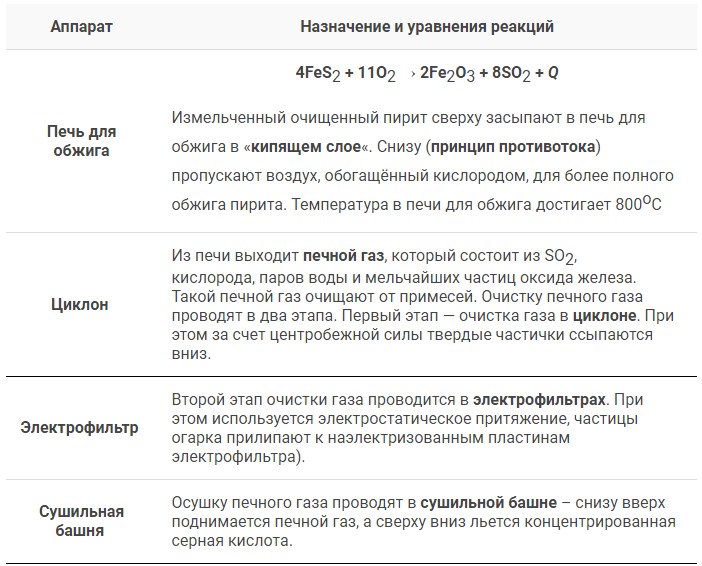
Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение метанола
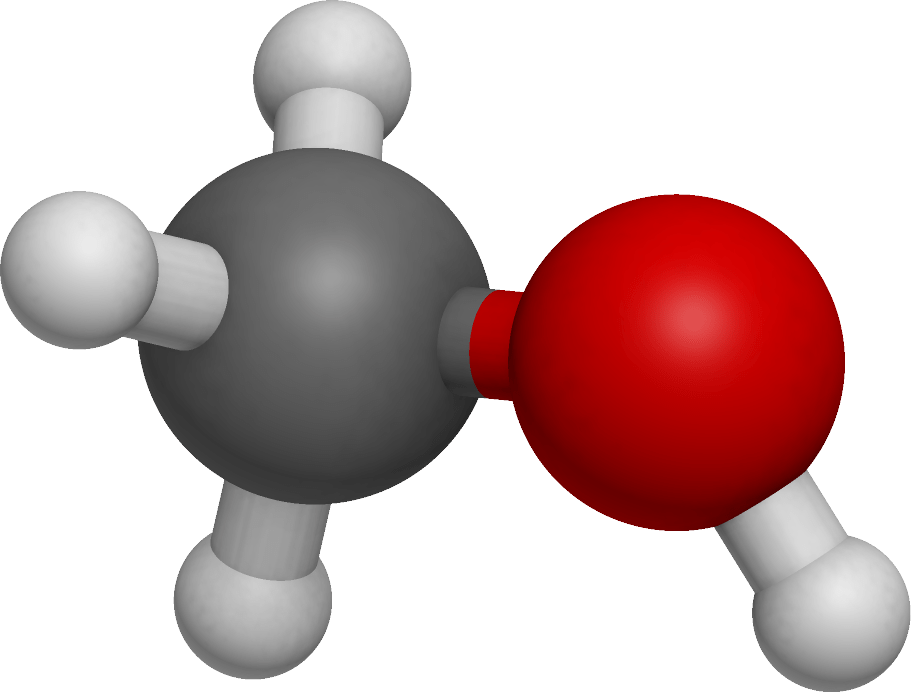
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
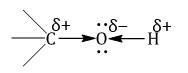
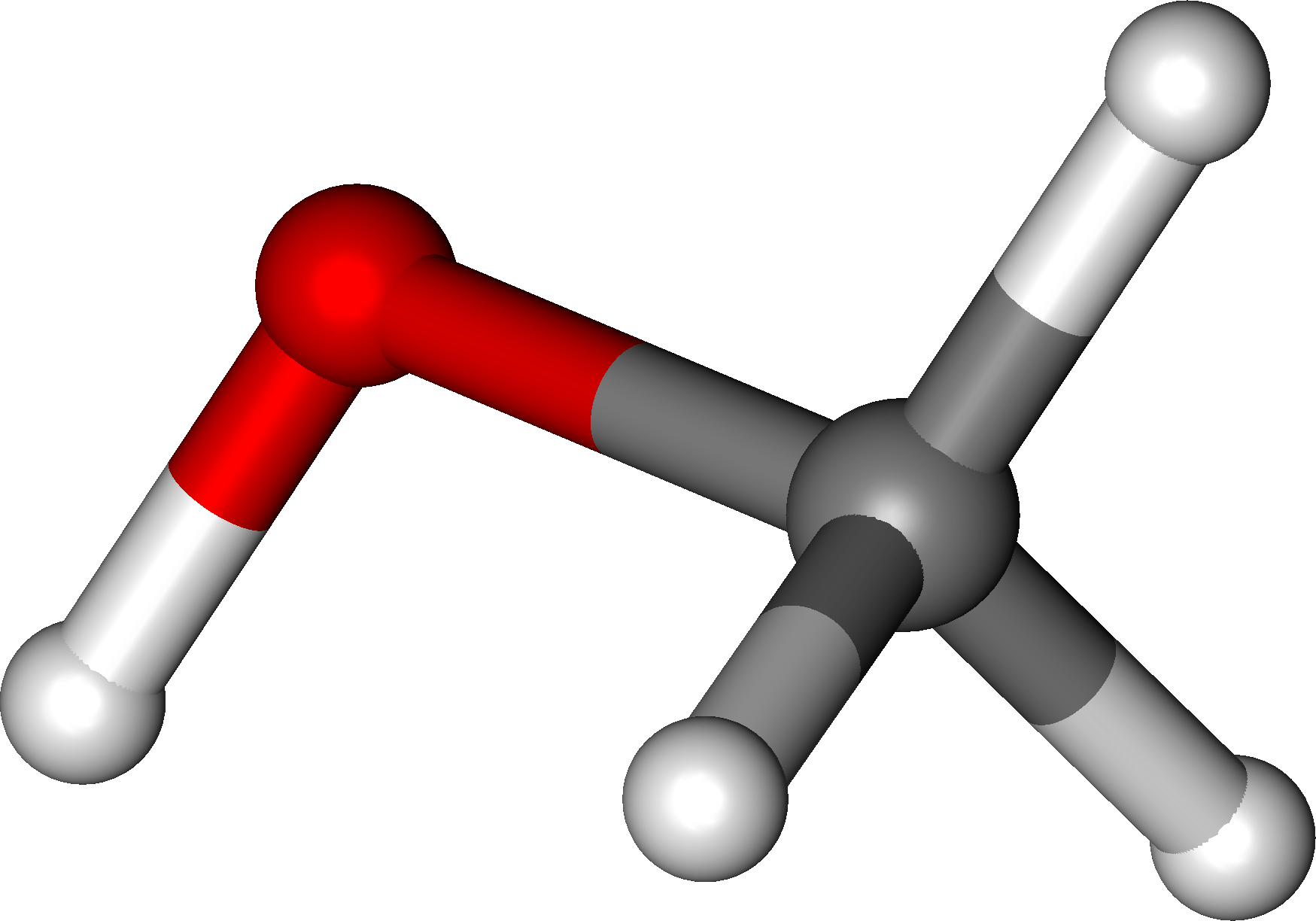
| Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
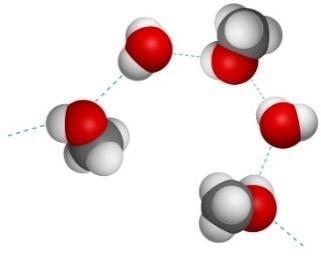
Водородные связи и физические свойства метанола
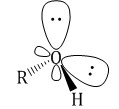
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
![]()
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5оС).
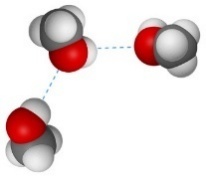
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
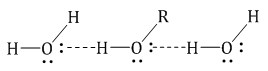
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
![]()
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода. |
2CH3-OH + 2K → 2CH3OK + H2
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
CH3-OH + HBr → CH3Br + H2O
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
CH3-OH + NH3 → CH3NH2 + H2O
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
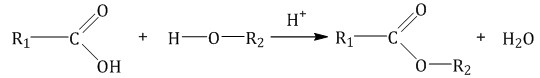
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
CH3-OH + CH3COOH → CH3COOCH3 + H2O
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой: |
CH3-OH + HNO3 → CH3ONO2 + H2O
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140оС образуется диметиловый эфир: |
2CH3-OH → CH3OCH3 + H2O
4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
CH3-OH + CuO → CH2O + H2O + Cu
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
2CH3-OH + O2 → 2CH2=O + 2H2O
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
| Например, уравнение сгорания метанола: |
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
CH3-OH → CH2=O + H2
Получение метанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
![]()
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
CO + 2H2 ⇄ CH3OH
Природные источники углеводородов
В природе углеводороды встречаются в виде нефти, природного газа, каменного угля.
| Нефть — маслянистая жидкость от светло-бурого до черного цвета с характерным запахом природного происхождения, состоящая из смеси различных углеводородов. |
| Природный газ — бесцветный газ, состоящий из смеси различных углеводородов (преимущественно из метана). |
| Каменный уголь — твердое горючее полезное ископаемое, которое имеет сложный состав. |
Состав нефти
В зависимости от месторождения нефть имеет различный состав. В неё могут входить: алканы, циклоалканы, ароматические углеводороды.
Фракции нефти
Фракция, собираемая от 40 до 200°С — фракция бензинов — содержит углеводороды от С6Н12 до С11Н24.
Лигроиновая фракция, собираемая в пределах от 150 до 250 °С, содержит углеводороды от С8Н18 до С14Н30.
Керосиновая фракция включает углеводороды от С12Н26 до С18Н38 с температурой кипения от 180 до 300°С.
В следующей фракции получают газойль (выше 275°С) — дизельное топливо.
Остаток после перегонки нефти – мазут – содержит углеводороды с большим числом атомов углерода (до многих десятков) в молекуле. После отгонки остается гудрон. Его применяют в дорожном строительстве.
Перегонка нефти
| Перегонка – это разделение нефти на отдельные фракции по температуре кипения. |
Перегонка нефти осуществляется в ректификационной колонне.
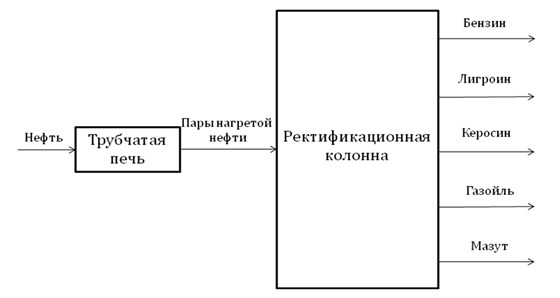
В печи нефть нагревается до 320-350 °С и поступает в ректификационную колонну.
Внутри она имеет горизонтальные перегородки с отверстиями, так называемые тарелки.
Пары нефти подаются в колонну и поднимаются вверх, при этом постепенно охлаждаются и сжижаются.
Менее летучие углеводороды конденсируются внизу, образуя газойлевую фракцию.
Выше собирается керосин, а затем — лигроин. Наиболее летучие углеводороды выходят в виде паров из колонны и сжижаются, образуя бензин.
Главный недостаток перегонки нефти — малый выход бензина (не более 20%).
Крекинг нефтепродуктов
| Крекинг — расщепление углеводородов с длинной цепью на углеводороды с меньшей относительной молекулярной массой. |
Такой процесс называется крекингом (по англ. crack – расщеплять). Промышленный метод крекинга был изобретен русским инженером В. Г. Шуховым в 1891 г.
Процесс крекинга происходит с разрывом углеродных цепей и образованием более простых предельных и непредельных углеводородов.
Например, при крекинге гексадекана образуются октан и октен:
C16H34 → C8H18 + C8H16
Образовавшиеся вещества могут разлагаться далее. При крекинге октана могут образоваться бутан и бутен:
C8H18 → C4H8 + C4H10
А при крекинге бутана образуются этан и этилен:
C4H10 → C2H4 + C2H6
Различают два основных вида крекинга:
Термический крекинг:
Расщепление углеводородов производится при высокой температуре (470—550°С) и давлении.
Бензин термического крекинга содержит много непредельных углеводородов и обладает большей детонационной стойкостью, чем бензин прямой перегонки. Он менее устойчив при хранении, так как непредельные углеводороды легко окисляются и полимеризуются. Поэтому к бензину термического крекинга добавляют антиокислители.
Каталитический крекинг:
Расщепление углеводородов происходит при несколько более низкой температуре (450- 500°С) с применением катализаторов (алюмосиликатов). Процесс происходит с большей скоростью, чем при термическом крекинге. Бензин каталитического крекинга более высокого качества, чем бензин термического крекинга, так как наряду с реакциями расщепления идет изомеризация и образуются разветвленные углеводороды, которые еще более повышают детонационную стойкость бензина. В бензине каталитического крекинга непредельных углеводородов содержится меньше, и поэтому он более устойчив при хранении.
Ароматизация нефти
Превращение предельных углеводородов и циклоалканов нефти в ароматические углеводороды. Также ароматизацию называют риформингом.
![]()
Так как в нефти содержатся также производные циклогексана, например, метилциклогексан, то из него при этих же условиях образуется метилбензол (толуол):
![]()
При этих же условиях н-гексан тоже превращается в бензол:
![]()
Переработка каменного угля
Каменный уголь подвергают коксованию. Это нагревание без доступа воздуха при температуре 1000-1400оС. При коксовании образуется кокс (почти чистый углерод), коксовый газ (состоит преимущественно из водорода и метана), аммиак, деготь, ароматические углеводорода и др.
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки.
| Высокомолекулярные вещества, состоящие из больших молекул цепного строения, называются полимерами (от греч. «поли» — много, «мерос» — часть). |
Например, полиэтилен, получаемый при полимеризации этилена CH2=CH2:
…-CH2-CH2-CH2-CH2-CH2-CH2-CH2-… или (-CH2—CH2-)n
Молекула полимера называется макромолекулой (от греч. «макрос» — большой, длинный). Молекулярная масса макромолекул достигает десятков — сотен тысяч (и даже миллионов) атомных единиц.
Соединения, из которых образуются полимеры, называются мономерами.
Например, пропилен (пропен) СН2=СH–CH3 является мономером полипропилена
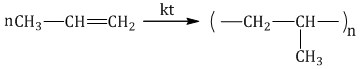
Группа атомов, многократно повторяющаяся в цепной макромолекуле, называется ее структурным звеном.
| Мономеры – низкомолекулярные вещества, из которых образуются полимеры. |
Степень полимеризации – число, показывающее количество элементарных звеньев в молекуле полимера.
Степень полимеризации обычно обозначается индексом «n» за скобками, включающими в себя структурное (мономерное) звено: (–CH2–CH2–)n.
Классификация полимеров
Полимеры, макромолекулы которых построены строго определенным способом, называют регулярными.
Полимер называется стереорегулярным, если заместители R в основной цепи макромолекул (–CH2–CHR–)n расположены упорядоченно.
Стереорегулярные полимеры обладают гораздо лучшими свойствами – пластичностью, прочностью и теплостойкостью; они способны кристаллизоваться, в отличие от нерегулярных.
Классификация по структуре
По структуре полимеры делятся на: линейные, разветвленные и пространственные.
| Линейные | Разветвленные | Пространственные |
| Состоят из последовательности повторяющихся звеньев с большим отношением длины молекулы к ее поперечному размеру. Целлюлоза, полиэтилен низкого давления, капрон | Макромолекулы разветвленных имеют боковые ответвления от цепи, называемой главной или основной Крахмал |
Химические связи имеются и между цепями, образуя пространственную структуру Резина, фенолформальдегидные смолы |
Линейные — макромолекулы состоят из последовательности повторяющихся звеньев с большим отношением длины молекулы к ее поперечному размеру (целлюлоза, полиэтилен низкого давления, капрон).
Разветвленные — макромолекулы которых имеют боковые ответвления от цепи, называемой главной или основной (крахмал).
Сетчатые (пространственные) — химические связи имеются и между цепями (резина, фенолформальдегидные смолы).
Классификация по происхождению
По способу получения полимеры делятся на: природные, синтетические и искусственные.
| Природные волокна | Синтетические волокна | Искусственные |
| Непосредственно существуют в природе хлопок шерсть натуральный шелк | Получают полностью химическим путем в реакциях полимеризации и поликонденсации капрон найлон лавсан | Получают модификацией натуральных полимеров ацетатное волокно целлулоид вискоза |
Природные полимеры непосредственно существуют в природе (крахмал, целлюлоза и др.).
Синтетические полимеры получают полностью химическим путем в реакциях полимеризации и поликонденсации (полиэтилен, полихлорвинил, фенол-формальдегидные смолы, метилметакрилат и т.д.). Не имеют аналогов в природе.
Искусственные – получают модификацией натуральных полимеров (вискоза –модифицированная целлюлоза, резина –модификация натурального каучука).
Классификация по химическому характеру
По химическому характеру и составу полимеры и химические волокна бывают: полиэфирные, полиамидные, элементоорганические (например, кремнийорганические полимеры).
| Полиэфирные полимеры | Полиамидные полимеры | Элементоорганические |
| Содержат группу -СОО- Лавсан (полиэтилентерефталат) | Содержат группу -СО-NH- Найлон, капрон | Содержат атомы других хим. элементов (кремний и др.). Кремнийорганические полимеры |
Полиэфирные полимеры — содержат группу сложных эфиров -СОО-.
Полиамидные полимеры — содержат пептидную связь -СО-NH-.
Элементоорганические полимеры — содержат атомы других химических элементов (помимо С, Н, О, N).
Классификация по способу получения
Полимеры получают либо реакциями полимеризации, либо поликонденсацией.
| Полимеризация | Поликонденсация |
| Это присоединение одних молекул к другим за счет разрыва кратных связей. Побочные продукты, как правило, не образуются. Полиэтилен, полипропилен и др. | Образование полимера происходит за счет реакции замещения. При этом образуется низкомолекулярный побочный продукт. Фенолформальдегидная смола, капрон |
| Полимеризация — процесс образования высокомолекулярного вещества(полимера) путём многократного присоединения молекул мономера к активным центрам в растущей молекуле полимера. |
Например, образование полиэтилена происходит по механизму полимеризации:
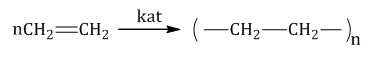
| Поликонденсация – процесс образования высокомолекулярных соединений, протекающий по механизму замещения и сопровождающийся выделением побочных низкомолекулярных продуктов (обычно это вода). |
Например, образование капрона протекает по механизму поликонденсации:
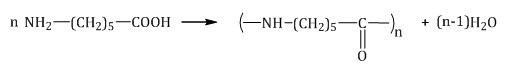
Свойства полимеров
По свойствам полимеры можно разделить на: термореактивные, термопластичные и эластомеры.
| Термореактивные | Термопластичные | Эластомеры |
| Неплавкие и неэластичные материалы. Фенолформальдегидные смолы, полиуретан | Меняют форму при нагревании и сохраняют её. Полиэтилен, полистирол, поливинилхлорид | Эластичные вещества при разных температурах. Натуральный каучук, полихлоропрен |
Термореактивные полимеры — пластмассы, переработка которых в изделия сопровождается необратимой химической реакцией, приводящей к образованию неплавкого и нерастворимого материала.
Например, фенолформальдегидные смолы, полиуретан.
Термопластичные полимеры — меняют форму в нагретом состоянии и сохраняют её после охлаждения.
Например, полиэтилен, полистирол, полихлорвинил и т.д.
Эластомеры – обладают высокоэластичными свойствами в широком интервале температур.
Например, натуральный каучук.
Полимеризация и поликонденсация
Полимеризация
Степень полимеризации — это число, показывающее сколько молекул мономера соединилось в макромолекулу.
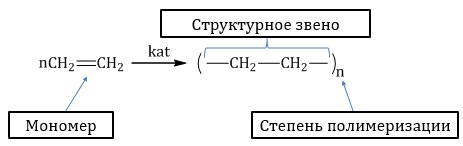
Степень полимеризации обычно обозначается индексом «n» за скобками, включающими в себя структурное (мономерное) звено: (–CH2–CH2–)n
| Характерные признаки полимеризации.
В основе полимеризации лежит реакция присоединения. Полимеризация – цепная реакция, включает стадии инициирования, роста и обрыва цепи. Элементный состав (молекулярные формулы) мономера и полимера одинаков. |
Катализаторами полимеризации могут быть: металлический натрий, пероксиды, кислород, металлоорганические соединения, комплексные соединения.
Процесс образования высокомолекулярных соединений при совместной полимеризации двух или более различных мономеров называют сополимеризацией.
Например, схема сополимеризации этилена с пропиленом:
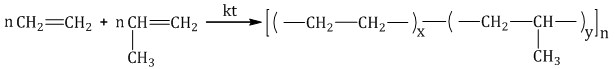
Важнейшие синтетические полимеры
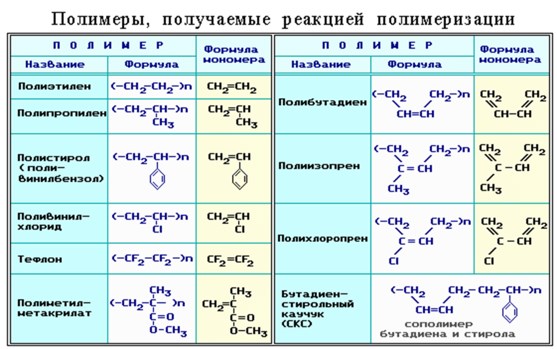
Важнейшие синтетические полимеры, получаемые реакцией полимеризации, и области их применения:
| Полимер | Мономер | Характеристики полимера | Применение полимера | ||
| Полиэтилен (–СН2–СН2–)n | Этилен СН2=СН2 | Синтетический, линейный, термопластичный, химически стойкий | Упаковка, тара | ||
| Полипропилен
| Пропилен СН2=СН–СН3 | Синтетический, линейный, термопластичный, химически стойкий | Трубы, упаковка, ткань (нетканый материал) | ||
| Поливинилхлорид
| Винилхлорид СН2=СН–Сl | Синтетический линейный полимер, термопластичный | Натяжные потолки, окна, пленка, трубы, полы, изолента и т.д | ||
| Полистирол
| Стирол
| Синтетический линейный полимер, термопластичный | Упаковка, посуда, потолочные панели | ||
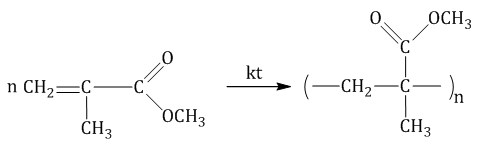
| Полиметилметакрилат
Метиловый эфир метакриловой кислоты
| Синтетический линейный полимер, термопластичный | Очки, корпуса фар и светильников, душевые кабины, мебель и т.д | |||
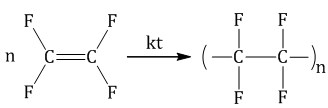
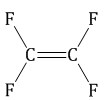
| Тефлон (политетрафторэтилен)
| Тетрафторэтилен
| Синтетический линейный полимер. Термопластичный (t = 260-3200C) Обладает очень высокой химической стойкостью | Посуда, пластины утюгов, ленты и скотч, упаковка, изоляция | ||
| Искусственный каучук
Мономер: бутадиен-1,3 (дивинил)
| Синтетический, линейный, эластомер, содержит двойные связи | Резина, изоляция, различные материалы, ракетное топливо | |||
| Натуральный каучук
Мономер: 2-метилбутадиен-1,3
| Природный, линейный, эластомер, содержит двойные связи | Резина, изоляция, различные материалы, ракетное топливо | |||
| Хлоропреновый каучук
Мономер: 2-хлорбутадиен-1,3
| Синтетический, линейный, эластомер, содержит двойные связи | Резина, изоляция, различные материалы, ракетное топливо | |||
| Бутадиен-стирольный каучук
Мономеры: бутадиен-1,3 и стирол | Синтетический, эластомер | Резина, изоляция, различные материалы, ракетное топливо | |||
| Полиакрилонитрил
| Акрилонитрил
| Синтетический, линейный | Волокна, пластмассы | ||
Поликонденсация
| Поликонденсация – процесс образования высокомолекулярных соединений, протекающий по механизму замещения и сопровождающийся выделением побочных низкомолекулярных продуктов, обычно это вода. |
| Характерные признаки поликонденсации. В основе поликонденсации лежит реакция замещения. Поликонденсация – процесс ступенчатый, т.к. образование макромолекул происходит в результате последовательного взаимодействия мономеров, димеров или n-меров как между собой, так и друг с другом. Помимо высокомолекулярного соединения, в реакции поликонденсации образуется второе, низкомолекулярное вещество (обычно это вода). |
Важнейшие синтетические полимеры, получаемые реакцией поликонденсации, и области их применения:
| Полимер и мономер | Характеристики полимера | Применение полимера |
| Капрон
Мономер: 6-аминокапроновая кислота (лактам) | Синтетический, линейный, термопластичный, очень эластичный | Полиамидные волокна (нитки, ткани, парашюты, втулки и т.д.) |
| Найлон
Мономер: 1,6-диаминогексан и адипиновая кислота (1,6-гександиовая) | Синтетический, полиамидный, линейный, термопластичный | Изготовление втулок, вкладышей, ниток, одежды, гитарных струн (полиамидное волокно) |
| Лавсан (полиэтилентерефталат)
Мономер: Этиленгликоль, терефталевая кислота | Синтетический линейный полимер, термопластичный, полиэфирный | Натяжные потолки, окна, пленка, трубы, полы, изолента и т.д |
| Фенолформальдегидная смола
Мономеры: фенол и формальдегид | Синтетический, пространственный (сетчатый) полимер | Производство ДСП, лаков, клея (БФ-6 применяется в медицине), часто используется с наполнителями |
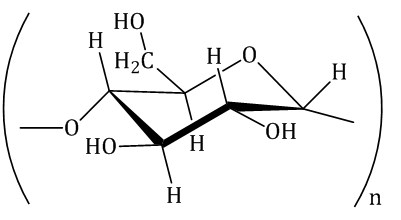
| Крахмал
Мономер: α-глюкоза | Природный, полиэфирный, разветвленный | Пищевая, текстильная, бумажная промышленность, фармацевтика и др. |
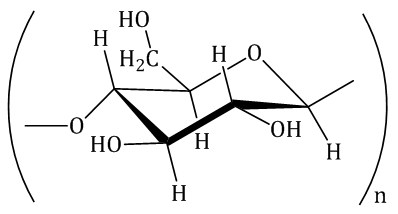
| Целлюлоза
Мономер: β-глюкоза | Природный, полиэфирный, линейный | Производство бумаги, искусственных волокон, пленок, пластмасс, лакокрасочных материалов, бездымного пороха, взрывчатки, твердого ракетного топлива, получение гидролизного спирта и др. |
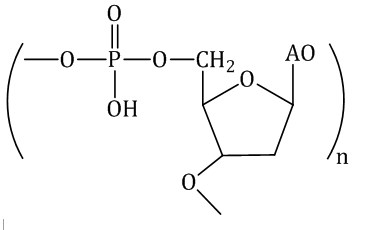
| ДНК
Мономер: Дезоксирибоза, ортофосфорная кислота, азотистые основания | Природный, полиэфирный, линейный | Функционирование живых организмов |
| РНК
Мономер: Рибоза, ортофосфорная кислота, азотистые основания |
|
|