Просмотр содержимого документа
«Занятие по МДК 02.01Электрохимическое получение хлората натрия»

Занятие № 10
Электрохимическое получение хлората натрия (NaClO 3 )

Применение хлоратов
Соли хлорной кислоты (хлораты) используются в органическом синтезе, пиротехнике, в производстве спичек, гербицидов, красящих веществ, перхлоратов (ClO 3 - ). Наиболее применимы NaClO 3 и KClO 3 (бертолетова соль).


Хлораты можно получать электролизом раствора NaCl в бездиафрагменном электролизере.

Процессы на электродах
Катодный процесс
Анодный процесс
- А: 2Сl - - 2e → Cl 2
- Cl 2 + Н 2 О ↔ НClO + НCl
- К: 2H 2 O + 2e→ Н 2 + 2ОН –

Хлорноватистая кислота взаимодействует со щелочью:
НClO + ОН – ↔ ClO – + Н 2 О (4)
Образующиеся анионы ClO – окисляются на аноде:
6ClO – + 3H 2 O – 6e→ 2ClO 3 – + 6H + + 4Cl – + 3/2О 2 (5)
В растворе протекает химическая реакция:
NaClO + 2HClО → NaClO 3 + 2HCl (6)
Выделяющийся на катоде водород может восстанавливать ионы ClO - и ClO 3 - :
ClO - + H 2 →Cl - + H 2 O (7)
ClO 3 - + 3H 2 → Cl - + 3H 2 O
Для предотвращения протекания побочных реакций вводят добавку K 2 Cr 2 O 7 .

Получение хлоратов возможно в результате:
1) химического окисления NaClO хлорноватистой кислотой;
2) анодного окисления иона ClO - . Соотношение между скоростями реакций зависит от условий электролиза. Для получения хлоратов обычно используют концентрированные растворы (до 280 г/л) NaCl, т. к. при уменьшении концентрации исходного раствора B T (ClO 3 - ) уменьшается.

Аноды – графитовые, металлооксидные (ОРТА, Fe 3 O 4 , Ti–PbO 2 , ПТА).
Графитовые аноды разрушаются, особенно при
i = 0,8– 1,0 кА/м 2 и увеличении температуры
от 40 до 50ºС.
Оптимальный износ графитовых анодов 6–8 кг/т ClO – . С повышением анодной плотности тока B T (ClO 3 - ) увеличивается .

Рис.1 Влияние рН раствора на выход по току хлората
При значении рН = 6,0–6,8 скорость химической реакции максимальна (рис.1). Значение рН поддерживают постоянным, вводя HCl и используя буферные свойства бихромата в этой области рН
Cr 2 O 7 2- + H 2 O → 2CrO 4 2- + 2H +
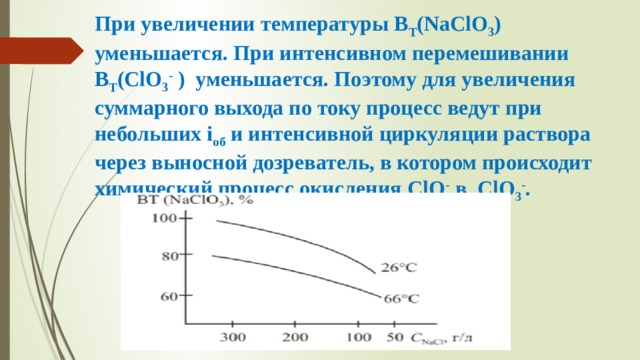
При увеличении температуры В Т (NaClO 3 ) уменьшается. При интенсивном перемешивании B T (ClO 3 - ) уменьшается. Поэтому для увеличения суммарного выхода по току процесс ведут при небольших i об и интенсивной циркуляции раствора через выносной дозреватель, в котором происходит химический процесс окисления ClO - в ClO 3 - .
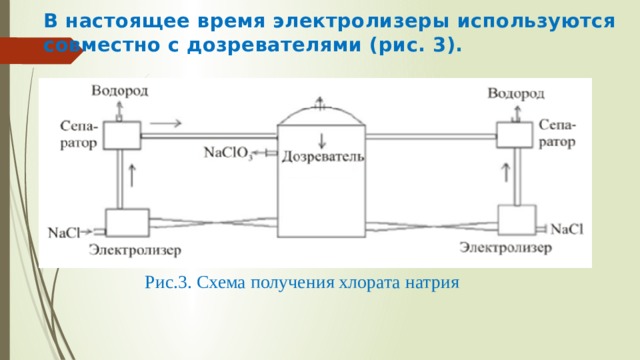
В настоящее время электролизеры используются совместно с дозревателями (рис. 3).
Рис.3. Схема получения хлората натрия

В электролизерах протекает электролиз водного раствора хлорида натрия с образованием NaClO и HClO 3 . Электролит за счет подъемной силы Н 2 поднимается по трубам и поступает в сепараторы, где отделяется от жидкости. Далее электролит поступает в дозреватель, где при повышении температуры идет химическая реакция. После накопления NaClO 3 до 550–600 г/л раствор отводят. NaClO 3 получают в твердом виде либо выпариванием, либо вымораживанием при охлаждении до –2– (–10)ºС. Определяющим фактором в выборе технологической схемы производства NaClO 3 является соотношение цен на пар и на электричество





























