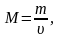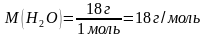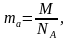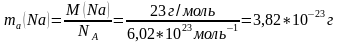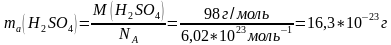Текшерилди
УИ боюнча директордун
орун басары
М.Б.Асанова _________
Сабакка чейин
Сабактын темасы: Заттын саны боюнча формулаларды колдонуп маселелерди чыгаруу Сабактын методу: репродуктивдүү
Сабактын тиби: Аралаш
Сабактын формасы: өз алдынча иштөө сабагы
| Сабактын максаты | Көрсөткүчтөрү |
| А)Конкреттүү максаты (билим берүүчүлүк): Заттын саны, молдук масса, заттын абсолюттук массасы боюнча маселе чыгарууну окуп үйрөнүшөт. | |
| Б)Конструктивдүү (ѳнүктүрүүчүлук, тарбиялоочулук): Зат, молекула, молекулалык масса боюнча түшүнүгү өнүгөт. Ой жүгүртүүсү өсөт. |
|
Күтүлүүчү натыйжа:
Сабактын мотивациясы (бул сабак эмнени берет): Заттын саны, молдук масса, заттын абсолюттук масса боюнча маселелерди өз алдынча чыгарууга көнүгүшөт.
Сабактын ѳбѳлгѳсү (Окуучунун априордук билими (мурунку билими)): Зат, молекула, салыштырмалуу атомдук жана молекулалык масса боюнча билими бар.
Сабактын жабдылышы: Слайддар, сүрөттөр, моделдер, анимация колдонулат.
Убакыт: 45 минута
Убакытты бѳлүштүрүү:Чакыруу этабы:6-8мин
Түшүнүү этабы(сабактын негизги бѳлүгү):22-25 мин
Ойлонуу этабы (сабакты бышыктоо):12-12 мин
Сабак
Сабактын жүрүшү:
Чакыруу этабы:
Сабактын чөйрөсү: Саламдашуу,класстын тазалыгына кѳз салуу,тактоо.
Жагымдуу маанай түзүү:
Элестеткиле бир үңкүргө кирдиңер кетип бара жатып бир туюк жерге келип андан ары жол таппай калдыңар ошол маалда жаныңарга бир жарганат келип бир несе деп шыбырап кетти. Ал сөз кайсы болушу мүмкүн?
Чыгуу каякта экенин мен билем
Кел, мен сага бул жактан чыгуунун жолун көрсөтөм
Изден, дагы изден
Сен бул жактан эч качан чыга албайсың
Окуучуларга тандаган сүйлөмдөрүнө жараша чечмелеп берүү
Үй тапшырмасын текшерүү жана ѳтүлгѳн теманы кайталоо:
1.Берилген заттын санында канча атом кармалат?
а)7.09моль Pb б)3.05мольCa в)4.5моль Pb
2.Берилген заттын санында канча молекула кармалат?
а) 21 моль Na3PO4 б)11моль CaSO4 в) 16 моль Mg
3.Берилген молекулаларда канча заттын саны кармалат?
а) 6*1023 Al(OH)3 б) 9.12*1023 Mg SO4 в) 4*1023 КCl
4.Заттын массасын аныктагыла
а) 21 моль Na3PO4 б)11моль CaSO4 в) 16 моль Mg SO4
5.Берилген затта канча молекула жана канча моль кармалып журот
а) 3.8г Сa3(PO4)2 б) 3.16г MnO2 в)2.4г HBr
6.Томонку заттардын моль массасын тапкыла:
а) Na2SO4 б) Mg S в) Al2S3
Түшүнүү этабы(сабактын негизги болүгү):
Заттын саны-моль. Химиялык өз ара аракеттенишүүгө катышкан заттар атомдордон, молекулалардан жана башка бөлүкчөлөрдөн турушу мүмкүн. Моль-бул ошол заттардын бөлүкчөлөрүнүн санын аныктоочу бирдик болуп саналат. Моль менен көрсөтүлгөн заттын саны гректин υ (ню) тамгасы менен белгиленет. Моль химиялык эсептөөлөрдү жүргүзүүгө ыӊгайлуу.
Атомдук масса эмне экендигин эске сала кетели. Ал көмүртектин атомунун массасы менен байланышкан. Ошондуктан, молду аныктоо да көмүртектин атомунун массасы менен тыгыз байланышкан.
Моль-бул 0,012 кг (12г) көмүртекте канча атому болсо, алынган затта да ошончо бөлүкчө( атом, молекула же башкалар) болуучу заттын саны.
Моль-бул 6,02*1023 молекуланы, атомду же башка бөлүкчөнү кармап турган заттын саны.
NА=6,02*1023 моль -1 сан Авогадро(Италия окумуштуусу А.Авогадронун урматына) саны деп аталат.

Бир моль ар түрдүү затта 6,02*1023 молекула же атом кармалат. Бир моль сууда 6,02*1023 суунун молекуласы бар, бир моль алюминийде 6,02*1023 алюминийдин атому бар, бир моль күкүрт кислотасында 6,02*1023 күкүрт кислотасынын молекуласы бар, бир моль хлордо 6,02*1023 хлордун молекуласы бар.
Авогадро туруктуулугун жана заттын санын байланыштырып атомдун, молекуланын же иондун санын аныктоого болот. Ал төмөкү формула менен аныкталат:
N=NА*υ
N-атом, молекула, индун саны
NА-Авогадро саны
υ –заттын саны
Моль масса. Химиялык реакцияларды ( темирдин күкүрт менен, суутектин кычкылтек менен болгон ж.б. өз ара аракеттенишүүсүн) кароо менен, алардын практика жүзүндө ишке ашырылышы үчүн «заттын санынын» чоӊдугун пайдалануунун максатка ылайыктуу экендигин байкоо кыйын эмес. Мисалы, темирдин күкүрт менен болгон реакциясында суутектин ар бир эки молекуласы кычкылтектин 1 молекуласы менен реакциялашат. Ошондуктан мындай суроо туулат:
Заттын курамын түзгөн бөлүкчөлөрдү кандай массалык катыштарды алуу керек?
Бул үчүн заттын «моль массасы» деген түшүнүк пайдаланылат.
Моль масса-бир моль заттын массасына барабар.
Моль масса-заттын массасынын заттын санына болгон катышына барабар.
Аны төмөнкү формула менен көрсөтүүгө болот:
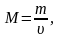
Мында,
М-моль масса
m-заттын массасы
υ-заттын саны
Моль массанын чен бирдиги учүн кг/моль же г/моль алынат.
Мисалы,
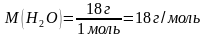
Моль масса менен Авогадро санын байланыштырып атомдордун жана молекулалардын абсолюттук массасын төмөнкү формула менен чыгарууга болот:
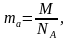
ma-абсолюттук масса.
Мисалы,
1)Na-абсолюттук массасы:
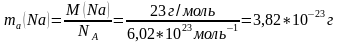
2)H2SO4-абсолюттук массасы:
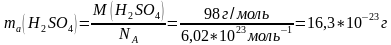
Ойлонуу этабы(сабакты бышыктоо):
| Мугалимдин иш аракети: | Суроо-жооп, аӊгемелешүү менен сабак лекция түрүндө өтүлөт. |
| 1.Берилген заттын санында канча атом кармалат? А)3моль Fe б)0.1моль Na в)0.2мольСa г)8моль C д)0.21моль Cl2 е)23мольP ж)7.7моль K з) 0.05моль Mn и) 1.02мольS й) 8.56мольP к) 8.9мольFe л) 1мольAl м)0.008моль N н) 12мольB о) 3.3мольMg п)7.001моль Cu р)0.008моль Sr с) 3мольAl т) 0.9мольBi у) 11мольPb ф) 0.003мольV х)2.2моль Ba ц)5моль К ч)9.002моль Na 2.Берилген заттын санында канча молекула кармалат? А)5моль Н2 б)4моль H2SO4 в)0.2моль NaOH г)0.03моль СaSO4 д) 20моль Al2O3 е)0.09моль Al(OH)3 ж)0.05моль S з)2.4моль FeCl3 и) 4.5моль Na2O й) 6.006моль H3PO4 к)35моль Na 3PO4 л) 9.001моль K2O м)3.006моль Al2S3 н)8моль FeCl3 о) 9моль K2MnO4 п)13мольСa3(PO4)2 р) 8.003моль H2CO3 с) 1моль H2S KMnO4 т)4моль Al2O3 у)2моль Na2SO4 ф) 7моль H2О х)0.003моль H2 ц) 0.8моль SO3 ч) 0.045мольAl2S3 3.Берилген молекулаларда канча заттын саны кармалат? А) 14.002*1023 H3PO4 б) 15.2*1023 Na2O в)3.003*1023 CaCO3 г) 9.02*1023 KMnO4 д) 3.1*1023 K2SO4 е) 5.8*1023 Al(OH)3 ё) 1.1*1023 K2SO4 ж) 7.02*1023 Al2O3 з) 9.5*1023 FeCl3 и) 3.01*1023 HNO3 й) 2*1023 H3PO4 к) 12.03*1023 H2SO4 л) 1.001*1023 CaSO4 м) 8.05*1023 Na3PO4 н) 2.01*1023 NaОH о) 3.9*1023 Zn(NO3 )2 п) 6*1023 Al2 (C O3) 3 р)0.87*1023 Al2 (S O4) 3 с) 4.009*1023 Na2SO4 т) 0.02*1023 Mg S у) 16.8*1023 Al2S3 ф) 11.2*1023 H2О х) 19.6*1023 Сa3(PO4)2 ц) 3.02*1023 MnO2 ч) 17.4*1023 CO2 4.Заттын массасын аныктагыла: а)5моль Н2 б)4моль H2SO4 в)0.2моль NaOH г)0.03моль СaSO4 д) 20моль Al2O3 е)0.09моль Al(OH)3 ж)0.05моль S з)2.4моль FeCl3 и) 4.5моль Na2O й) 6.006моль H3PO4 к)35моль Na 3PO4 л) 9.001моль K2O м)3.006моль Al2S3 н)8моль FeCl3 о) 9моль K2MnO4 п)13мольСa3(PO4)2 р) 8.003моль H2CO3 с) 1моль KMnO4 т)4моль Al2O3 у)2моль Na2SO4 ф) 7моль H2О х)0.003моль H2 ц) 0.8моль SO3 ч) 0.045мольAl2S3 5.Берилген затта канча молекула жана канча моль кармалып журот? а)12г K2SO4 б) 2г Al2O3 в)4г FeCl3 г) 5.5г HNO3 д)0.6г H3PO4 е) 8г H2SO4 ж ) 23г CaSO4 з) 1.12г Na3PO4 и) 0.09г NaОH й)3.4г Zn(NO3 )2 к) 25г Al2 (C O3) 3 л) 7.8г Al2 (S O4) 3 м) 9г Na2SO4 н) 5г Mg S о) 7.9г Al2S3 п) 1.005гH2О 6.Төмөнкү заттардын моль массасын тапкыла: а) K2SO4 б) Al2O3 в) FeCl3 г) HNO3 д) H3PO4 е) H2SO4 ж) CaSO4 з) Na3PO4 и) NaОH й) Zn(NO3 )2 к) Al2 (C O3) 3 л) Al2 (S O4) 3 7.Абсалюттук массаларын тапкыла: а) K2SO4 б) Al2O3 в) FeCl3 г) HNO3 д) H3PO4 е) H2SO4 ж) CaSO4 з) Na3PO4 и) NaОH й) Zn(NO3 )2 к) Al2 (C O3) 3 л) Al2 (S O4) 3
|
|
Үйгѳ тапшырма:
1.Берилген заттын санында канча атом кармалат?
а)2.2моль Ba б)5моль К в)9.002моль Na
2.Берилген заттын санында канча молекула кармалат?
а)0.003моль H2 б) 0.8моль SO3 б) 0.045мольAl2S3
3.Берилген молекулаларда канча заттын саны кармалат?
а) 19.6*1023 Сa3(PO4)2 б) 3.02*1023 MnO2 в) 17.4*1023 CO2
4.Заттын массасын аныктагыла:
а)0.003моль H2 б) 0.8моль SO3 в) 0.045мольAl2S3
5.Берилген затта канча молекула жана канча моль кармалып журот?
а) 5г Mg S б) 7.9г Al2S3 в) 1.005гH2О
6.Томонку заттардын моль массасын тапкыла:
а) Zn(NO3 )2 б) Al2 (C O3) 3 в) Al2 (S O4) 3
7.Абсалюттук массаларын тапкыла:
а) Zn(NO3 )2 б) Al2 (C O3) 3 в) Al2 (S O4) 3
Баалоо:
Критерийлер менен баалоо топто жана жеке
“5”- Өтүлгөн теманы кайталоодо активдүү катышкан жаӊы теманы өздөштүрүүдө өз алдынча, экиден , топто иштеше алса , алган билимин системалаштырып жыйынтык чыгара алса.
“4”-жогорудагылардын бирөөнө катыша албаса
“3”- жогорудагылардын экөөнө катыша албаса
“2”-таптакыр эле аракети жок болсо