ЗНО з хімії 2016(правильні відповіді з поясненням та розв׳язуванням)
1. Одними з найважливіших природних сполук є хлорофіли. Це пігменти, які відіграють провідну роль у перетворенні світлової енергії в енергію хімічних зв’язків органічних речовин під час фотосинтезу. Основними типами хлорофілів у рослин є хлорофіл a С55Н72О5N4Mg і хлорофіл b C55H70O6N4Mg. У цих речовин:
А) однакові структурні формули Б) різний якісний склад
В) однакові найпростіші формули Г) різний кількісний склад
2. Символи d-елементів наведено в рядку:
А) Li, Na, K Б) Fe, Co, Ni В) Mg, Ca, Sr Г) Ar, Ne, Kr
3. У ряду атомів хімічних елементів Li – Be – B – C:
А) збільшується радіус
Б) збільшується електронегативність
В) зменшується число електронів на зовнішньому енергетичному рівні
Г) зменшується загальне число електронів на енергетичних рівнях
4. Натрій фторид використовують у складі зубних паст для зміцнення зубної емалі й запобігання карієсу. У частинок Na+ і F–, із яких складається кристалічні ґратки цієї сполуки, однакове число:
А) протонів Б) нуклонів В) нейтронів Г) електронів
Пояснення: Na+ 1s2 2s2 2p6 ; F– 1s2 2s2 2p6
5. Склад мінералу родоліту описує формула MgxAl2(SiO4)3. Виходячи з принципу електронейтральності речовини, визначте індекс x у цій формулі.
А) 6 Б) 5 В) 3 Г) 2
Пояснення: x(+2) + 2(+3) + 3(+4) + 12(–2) = 0
2x + 6 + 12 – 24 = 0
x = 3
6. У якому рядку записано формули лише йонних сполук?
А) NH4Cl, HCl, H2S Б) NaCl, Na2O, K2S В) NaF, SiO2, CH4 Г) HF, NH3, KBr
7. Проаналізуйте схему окисно-відновної реакції: HI + H2SO4 → I2 + H2S + H2O. У цій реакції гідроген йодид є (І), а число електронів, що беруть участь у зміні ступеня окиснення Сульфуру, дорівнює (ІІ)
|
| І | ІІ |
| А) | відновником | 8 |
| Б) | окисником | 6 |
| В) | відновником | 4 |
| Г) | окисником | 2 |
Пояснення: S+6 + 8e– → S–2
8. Проаналізуйте твердження. Чи є поміж них правильні?
І. Розчинність карбон(IV) оксиду у воді за сталої температури збільшується внаслідок підвищення тиску.
II. Розчинність кисню у воді за сталого тиску зменшується внаслідок підвищення температури.
А) обидва правильні Б) немає правильних
В) правильне лише І Г) правильне лише ІІ
9. Які речовини не реагують між собою у водному розчині?
А) HCl і K2SiO3 Б) KOH і FeSO4 В) BaSO4 і HCl Г) Na2CO3 і BaCl2
Пояснення: HCl + K2SiO3 → H2SiO3↓ + KCl
KOH + FeSO4 → Fe(OH)2↓+ K2SO4 Na2CO3 + HCl → NaCl + H2O + CO2↑
10. У якому рядку формули оксидів записано в такій послідовності: основний, амфотерний, кислотний?
А) Al2O3, MgO, Cl2O7 Б) Li2O, ZnO, CO2
В) MgO, SiO2, N2O Г) ZnO, Al2O3, SO2
11. Для добування нерозчинної основи потрібно використати
А) CuO і H2O Б) Li2O і H2O В) K2SO4 і Ba(OH)2 Г) CuSO4 і NaOH
Пояснення: CuSO4 + NaOH → Cu(OH)2↓ + Na2SO4
12. Назви лише двохосновних кислот наведено в рядку
А) сульфідна, сульфатна, хлоридна Б) карбонатна, нітратна, сульфідна
В) сульфітна, сульфатна, карбонатна Г) нітратна, хлоридна, сульфітна
Пояснення: H2SO3 – сульфітна кислота H2SO4 – сульфатна кислота
H2CO3 – карбонатна кислота
13. Взаємодією речовин можна добути магній сульфат?
1) MgO і H2SO4 2) MgCO3 і H2SO4 3) Mg(OH)2 і Na2S
4) Mg і Na2SO4 5) MgCl2 і SO3 6) Mg(OH)2 і H2SO4
Пояснення: MgO + H2SO4 → MgSO4 + H2O
MgCO3 + H2SO4 → MgSO4 + H2O + CO2↑
Mg(OH)2 + H2SO4 → MgSO4 + H2O
14. В одній пробірці міститься розчин магній хлориду, в іншій – розчин алюміній хлориду. Визначити вміст пробірок можна за допомогою розчину речовини, формула якої:
А) NaOH Б) H2SO4 В) AgNO3 Г) Na2SO4
Пояснення: MgCl2 + NaOH → Mg(OH)2↓ + NaCl – білий осад
AlCl3 + NaOH → Al(OH)3↓ + NaCl – білий осад
Al(OH)3 + NaOH → Na[Al(OH)4] – розчинення осаду в надлишку лугу.
15. Унаслідок добавляння до розчину речовин X розчину барій хлориду випав білий осад, нерозчинний у воді. Після добавляння до розчину речовини X хлоридної кислоти виділився газ. Речовина X – це
А) аргентум(І) нітрат Б) амоній сульфат
В) натрій карбонат Г) калій сульфід
Пояснення: Na2CO3 + BaCl2 → BaCO3↓ + NaCl
Na2CO3 + HCl → NaCl + H2O + CO2↑
16. У розчин солі X занурили цинкову пластинку. Згодом вийняли, висушили й зважили. Маса пластинки збільшилася. Визначте формулу солі X.
А) Ba(NO3)2 Б) Pb(NO3)2 В) Ca(NO3)2 Г) Ni(NO3)2
Пояснення: Цинк може витіснити Ni та Pb. Однак збільшиться маса пластинки лише з Pb(NO3)2 оскільки Ar(Zn)
17. Наявність яких йонів зумовлює тимчасову твердість води?
А) Mg2+, Ca2+, HCO32– Б) Na+, K+, HCO32–
В) Mg2+, Ca2+, SO42– Г) Na+, K+, SO42–
18. Для добування водню можна використати алюмінієві ошурки й розчин натрій гідроксиду. У цій реакції Алюміній
А) віддає електрони й відновлюється Б) приймає електрони й окиснюється
В) віддає електрони й окиснюється
Г) приймає електрони й відновлюється
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ Al0 – 3e– → Al+3
19. Унаслідок взаємодії розжареного заліза з водяною парою утворюється залізна ожарина Fe3O4 і виділяється газ. Складіть рівняння цієї реакції й укажіть суму його коефіцієнтів.
А) 12 Б) 11 В) 10 Г) 8
Пояснення: 3Fe + 4H2O = Fe3O4 + 4H2
20. Для добування брому з водного розчину калій броміду можна використати речовину, формула якої:
А) CO2 Б) N2 В) Cl2 Г) I2
Пояснення: KBr + Cl2 → KCl + Br2
21. Сульфур і окиснюється, і відновлюється в хімічній реакції, схема якої:
А) Na2SO4 + H2SO4 → NaHSO4 + SO2 + H2O
Б) S + NaOH → Na2SO3 + Na2S + H2O
В) SO2 + NO2 + H2O → H2SO4 + NO
Г) MnSO4 + Na2S → MnS + Na2SO4
Пояснення: S0 + NaOH → Na2S+4O3 + Na2S–2 + H2O
S0 – 4e– → S+4 | окиснення
S0 + 2e– → S–2 | відновлення
22. Розгляньте схематичне зображення приладу для добування газу. Який газ добувають у такий спосіб?
А) хлор Б) натрій карбонату В) амоніак Г) нітроген(IV) оксид
Пояснення: Ca(OH)2 + NH4Cl → CaCl2 + NH3↑ + H2O
23. За допомогою якого реагенту можна відрізнити пропан від вуглекислого газу?
А) вапняної води Б) бромної води В) розчину фенолфталеїну
Г) розчину калій перманганату
Пояснення: CO2 + Ca(OH)2 → CaCO3↓ + H2O – помутніння вапняної води
C3H8 + Ca(OH)2 → не реагує.
24. Укажіть назву за номенклатурою IUPAC речовини, структурна формула якої
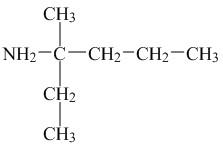
А) 2-пропілбутан-2-амін Б) 2-етилпентан-2-амін
В) 3-аміно-4-метилгексан Г) 3-метилгексан-3-амін
25. Які твердження щодо метану правильні?
1) взаємодіє з хлором за освітлення
2) основний компонент природного газу
3) знебарвлює бромну воду
4) можна добути взаємодією кальцій карбіду з водою
5) належить до гомологічного ряду алканів
6) важчий за повітря
26. Взаємодія пропену з бромом належить до реакції (1), а її продуктом є (2):
|
| 1 | 2 |
| А) | приєднання | 1-бромопропан |
| Б) | заміщення | 1,3-дибромопропан |
| В) | приєднання | 1,2-дибромопропан |
| Г) | заміщення | 2-бромопропан |
Пояснення: C3H6 + Br2 → C3H6Br2 – 1,2-дибромопропан
27. Проаналізуйте твердження. Чи є поміж них правильні?
І. Етин реагує з амоніачним розчином аргентум(І) оксиду.
ІІ. Продуктом каталітичної гідратації етину є етаналь.
А) обидва правильні Б) немає правильних В) правильне лише І
Г) правильне лише ІІ
Пояснення:C2H2 + Ag2O → C2Ag2 + H2O
C2H2 + H2O → CH3COH
28. Одним із продуктів циклізації й одночасного дегідрування гексану є бензен. Складіть рівняння цієї реакції й укажіть суму його коефіцієнтів:
А) 6 Б) 5 В) 4 Г) 3
Пояснення: C6H14 → C6H6 + 4H2
29. Речовина X у схемі перетворень є:
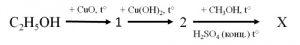
А) карбоновою кислотою Б) альдегідом В) естером Г) етером
30. Унаслідок часткового окиснення альдегідів утворюється
А) вуглеводні Б) карбонові кислоти В) вторинні спирти Г) первинні спирти
31. За наведеною структурною формулою речовини визначте реагенти, у результаті взаємодії яких утворюється ця сполука:
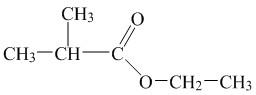
А) бутанова кислота й етанол Б) 2-метилпропанова кислота й етанол
В) етанова кислота й 2-метилпропан-1-ол Г) пропанова кисолта й пропан-2-ол
32. Укажіть назву речовини, що має такі властивості: волокниста, не розчиняється у воді, не взаємодіє з водно-спиртовим розчином йоду:
А) крохмаль Б) сахароза В) фруктоза Г) целюлоза
33. До розчину білка в пробірці добавили такий самий об’єм розчину лугу й кілька крапель розчину купрум(ІІ) сульфату, реакційна суміш набула фіолетового кольору. Це свідчить про те, що в молекулі білка є:
А) фрагменти молекул ненасичених амінокислот Б) дисульфідні зв’язки
В) фрагменти молекул ароматичних амінокислот Г) пептидні зв’язки
34. Визначте речовину X у схемі перетворень:
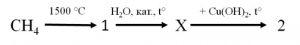
А) етаналь Б) етанол В) етиленгліколь Г) етанова кислота
35. Установіть відповідність між формулою та природою речовини:
| Формула речовини | Природа речовини |
| 1) BaSO4 | А) середня сіль |
| 2) H2SO4 | Б) основний оксид |
| 3) NH4HCO3 | В) амфотерний оксид |
| 4) CaO | Г) кислота |
|
| Д) кисла сіль |
36. Установіть відповідність між частинкою та її електронною формулою:
| Частинка | Електронна формула частинки |
| 1) йон Mg2+ | А) 1s2 2s2 2p6 3s2 3p6 |
| 2) йон Cl– | Б) 1s2 2s2 2p6 3s2 3p4 |
| 3) атом Na | В) 1s2 2s2 2p6 3s2 3p2 |
| 4) атом Si | Г) 1s2 2s2 2p6 3s1 |
|
| Д) 1s2 2s2 2p6 |
37. Установіть відповідність між назвою речовини та класом органічних сполук, до якого вона належить:
| Назва речовини | Клас органічних сполук |
| 1) етиленгліколь | А) аміни |
| 2) анілін | Б) спирти |
| 3) гліцин | В) естери |
| 4) бутаналь | Г) альдегіди |
|
| Д) амінокислоти |
38. Установіть відповідність між хімічною реакцією та її продуктами:
| Хімічна реакція | Продукт хімічної реакції |
| 1) каталітичне окиснення амоніаку | А) N2, CO2 і H2O |
| 2) горіння метиламіну на повітрі | Б) CO2 і H2O |
| 3) термічне розкладання метану | В) NO і H2O |
| 4) горіння амоніаку в кисні | Г) C2H2 і H2 |
|
| Д) N2 і H2O |
Пояснення:
1) NH3 + O2 → NO + H2O 2) CH3NH2 + O2 → CO2 + H2O + N2
3) CH4 → C2H2 + H2 4) NH3 + O2 → N2 + H2O
39. Установіть відповідність між хімічною реакцією та одним з її продуктів:
| Хімічна реакція | Продукт хімічної реакції |
| 1) гідратація ацетилену | А) фенол |
| 2) міжмолекулярна дегідратація етанолу | Б) етаналь |
| 3) гідроліз хлоробензену | В) діетиловий етер |
| 4) відновлення нітробензену | Г) етиленгліколь |
|
| Д) анілін |
Пояснення:
1) C2H2 + H2O → CH3COH 2) 2C2H5OH → C2H5OC2H5 + H2O
3) C6H5Cl + H2O → C6H5OH + HCl 4) C6H5NO2 + H2 → C6H5NH2 + H2O
40. Установіть відповідність між перетворенням, номер якого позначено цифрою над стрілкою, та типом хімічної реакції:
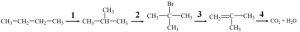
|
| Тип реакції | № |
| А) | заміщення | 1 |
| Б) | приєднання | 2 |
| В) | відщеплення | 3 |
| Г) | ізомеризації | 4 |
| Д) | повного окиснення |
|
41. Розташуйте формули сполук за посиленням їхніх основних властивостей.
А) CH3–NH2 Б) NH3 В) CH3–NH–CH3 Г) C6H5–NH2
Відповідь: C6H5–NH2 3 3–NH2 3–NH–CH3
42. Розташуйте формули речовин за збільшенням у них масової частки Феруму:
А) FeO Б) FeSO4 В) FeCl2 Г) FeS2
Відповідь: FeSO4 (36,8 %) 2 (44,1 %) 2 (46,7 %)
43. Обчисліть середню молярну масу (г/моль) суміші метану з пропаном, об’ємна частка метану в якій становить 25%.
Розв’язання: M(CH4 + C3H8) = M(CH4) · φ(CH4) + M(C3H8) · φ(C3H8)
M(CH4 + C3H8) = 16 · 0,25 + 0,75 · 44 = 37 г/моль
Відповідь: 37
44. Олеум – суміш сульфур(IV) оксиду та безводної сульфатної кислоти. Добавлянням олеуму до води можна добути розчин сульфатної кислоти потрібної концентрації. Олеум масою 200 г з масовою часткою сульфур(IV) оксиду 20% змішали з водою масою 218 г. Обчисліть масову частку (%) сульфатної кислоти в одержаному розчині.
Розв’язання: m(розчину H2SO4) = 200 г + 218 = 418 г
m(SO3) = 200 · 0,2 = 40 г
n(SO3) = 40 г / 80 г/моль = 0,5 моль
m1(H2SO4) = 200 – 40 г = 160 г
SO3 + H2O = H2SO4
n(H2SO4) = n(SO3) = 0,5 моль
m2(H2SO4) = 98 г/моль · 0,5 моль = 49 г
m(H2SO4) = m1(H2SO4) + m2(H2SO4)
m(H2SO4) = 160 г + 49 г = 209 г
m(розчину H2SO4) = 200 г + 218 = 418 г
w(H2SO4) = m(H2SO4) / m(розчину H2SO4) · 100 %
w(H2SO4) = 209 г / 418 г · 100 % = 50 %
Відповідь: 50
45. Обчисліть відносну густину сульфур(IV) оксиду за гелієм:
Розв’язання: DHe(SO2) = M(SO2) / M(He)
DHe(SO2) = 64 / 4 = 16 Відповідь: 16
46. На гідрування алкену масою 2,8 г витратили водень об’ємом 1,12 л (н. у.).
1. Обчисліть молярну масу (г/моль) алкену.
Розв’язання: CnH2n + H2 = CnH2n + 2
2,8 / M(CnH2n) = 1,12 / 22,4
M(CnH2n) = 56 г/моль
Відповідь: 56
2. Виведіть молекулярну формулу алкену. У відповіді запишіть число, що дорівнює сумі індексів у виведеній формулі.
Розв’язання: M(CnH2n) = 56 г/моль
12n + 2n = 56; n = 4; C4H8 Відповідь: 12
47. Для проведення реакції взято безводний натрій етаноат масою 8,2 г та натрій гідроксид у надлишку. Унаслідок прожарювання цієї суміші утворився сухий залишок і виділився метан, який повністю спалили у кисні.
1. Обчисліть об’єм (мл) метану (н. у.), що виділився внаслідок реакції.
Розв’язання: CH3COONa + NaOH = CH4↑ + Na2CO3
n(CH3COONa) = 8,2 г / 82 г/моль = 0,1 моль
n(CH4) = n(CH3COONa) = 0,1 моль
V(CH4) = 0,1 моль · 22,4 л = 2,24 л = 2240 мл
Відповідь: 2240
2. Обчисліть об’єм (мл) кисню, що витратився на спалювання добутого метану (об’єми газів виміряно за однакових умов)
Розв’язання: CH4 + 2O2 = CO2 + 2H2O
V(O2) = 2V(CH4)
V(O2) = 2 · 2240 мл = 4480 мл
Відповідь: 4480
48. Використовуючи метод електронного балансу, перетворіть схему реакції NH3 + OF2 → N2 + HF + H2O на хімічне рівняння й укажіть коефіцієнт перед формулою окисника:
Розв’язання: N–3H3 + O+2F2 → N20 + HF + H2O–2
2N–3 – 6e– → N20 | 2 | – відновник
O+2 + 4e– → O–2 | 3 | – окисник
4NH3 + 3OF2 → 2N2 + 6HF + 3H2O
Відповідь: 3
49. Суміш об’ємом 11,2 л (н. у.), що складається з метану й пропану, спалили в кисні. Продукти згорання пропустили крізь вапняну воду в надлишку. Унаслідок цього утворився осад масою 80 г. Обчисліть об’ємну частку (%) пропану у вихідній суміші.
Розв’язання: CH4 + 2O2 = CO2 + 2H2O (1)
C3H8 + 5O2 = 3CO2 + 4H2O (2)
CO2 + Ca(OH)2 = CaCO3↓ + H2O
n(CaCO3) = 80 г / 100 г/моль = 0,8 моль
n(CO2) = n(CaCO3) = 0,8 моль
Нехай в суміші є x л C3H8. Тоді V(CH4) = 11,2 – x (л)
За рівнянням 1 утворилось a моль CO2, а за рівнянням 2 – b моль CO2.
(1) a = (11,2 – x)/22,4 моль
(2) b = 3x/22,4 моль
a + b = 0,8 моль
(11,2 – x)/22,4 + 3x/22,4 = 0,8 x = 3,36 л
φ(C3H8) = 3,36 / 11,2 · 100 % = 30 %
Відповідь: 30
50. Одна зі стадій добування міді в промисловості – випалювання збагаченої руди, головною складовою якої є купрум(І) сульфід. Цей процес відбувається за схемою Cu2S + O2 → CuO + SO2. У результаті випалювання руди масою 200 кг одержали купрум(ІІ) оксид масою 120 кг. Обчисліть масову частку (%) купрум(І) сульфіду в руді.
Розв’язання: Cu2S + 2O2 → 2CuO + SO2
n(CuO) = 120 000 г / 80 г/моль = 1500 моль
n(Cu2S) = 0,5n(CuO) = 1500 / 2 = 750 моль
m(Cu2S) = 750 моль · 160 г/моль = 120 000 г = 120 кг
ω(Cu2S) = 120 кг / 200 кг · 100 % = 60 %
Відповідь: 60





























