Просмотр содержимого документа
«10 класс. Практическая работа. Получение этилена и опыты с ним. Прием чек-лист.»
10 класс. Практическая работа. Получение этилена и опыты с ним
(Прием «чек-лист»)
Цель: учиться использовать оборудование при получении в лаборатории этилена; изучить физические и химические свойства этилена, умения описывать эксперименты, давать объяснения.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
Реактивы: этиловый спирт C2H5OH, H2SO4(конц.), песок, бромная вода (Br2), KMnO4.
Ход работы
Инструктаж по охране труда.
Экспериментальная часть
| Описание задания | Схема прибора |
| Опыт 1. В пробирку налейте 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпьте немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении). Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки. Что вы наблюдаете? Запишите уравнение проделанной реакции. Как называется тип этой реакции? | 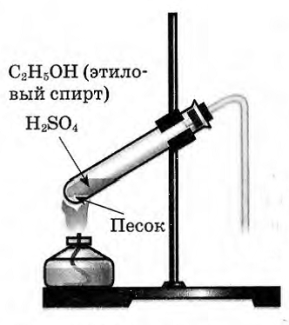
|
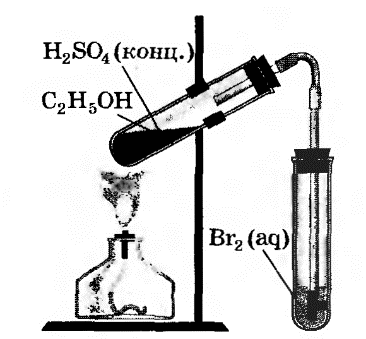
| Опыт 2. В другую пробирку налейте 2—3 мл бромной воды, опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете? Запишите уравнение проделанной реакции.
| 
|
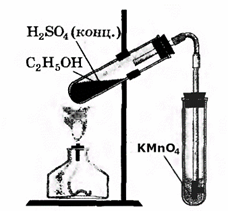
| Опыт 3. В третью пробирку налейте 2—3 мл разбавленного раствора перманганата калия, подкисленного серной кислотой, и пропустите через него газ. Что вы наблюдаете? Запишите уравнение проделанной реакции. Почему раствор перманганата калия обесцвечивается?
| 
|
| Опыт 4. Подожгите выделяющийся газ. Каким пламенем горит этилен? Запишите уравнение проделанной реакции. Почему пламя при горении этилена отличается от горения метана (природного газа)? | 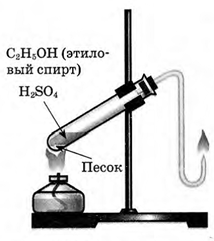
|
Оформление опытов в форме таблицы:
| № опыта. Что делаю? | Что наблюдаю | Уравнения реакций. Объяснения. |
Общий вывод по работе.
Ожидаемые наблюдения, объяснения, уравнения
| Опыт | наблюдения | уравнения
| объяснения |
| 1 | В пробирке начинается выделяться бесцветный газ - этилен | H2SO4 С2H5OH → C2H4↑ + H2O
| В ходе реакции концентрированная серная кислота забирает воду из спирта, в результате образуется этилен. Такую реакцию называют – реакция дегидратации. |
| 2 | При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
| H2C=CH2 + Br2 → CH2Br – CH2Br
| В ходе реакции происходит окисление этилена бромной водой по двойной связи.
|
| 3 | При пропускании газа через подкисленный раствор KMnO4, происходит обесцвечивание раствора KMnO4.
| 5C2H4+12KMnO4+18H2SO4→10CO2+6K2SO4+ +12MnSO4+28H2O.
| В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия, раствор перманганата калия восстанавливается до бесцветного Мn2+
|
| 4 | Этилен на воздухе горит ярким светящимся пламенем. | С2Н4 + 3О2 → 2СО2+2Н2О.
| Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей. |
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Практическая работа. Получение этилена и изучение его свойств
В пробирку налейте 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпьте немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении). Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки (рис. 53). Что вы наблюдаете?

2. В другую пробирку налейте 2—3 мл бромной воды, опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете?
3. В третью пробирку налейте 2—3 мл разбавленного раствора перманганата калия, подкисленного серной кислотой, и пропустите через него газ.
Что вы наблюдаете?
Запишите уравнение проделанной реакции.
4. Подожгите выделяющийся газ. Каким пламенем горит этилен? Почему?
Напишите уравнения всех проведенных вами реакций 1—4.























