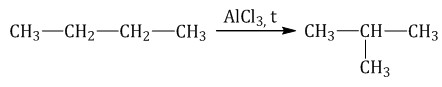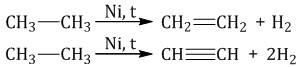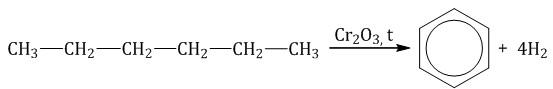| Формулы алканов нормального строения: Метан - CH4 Этан - C2H6 Пропан - C3H8 Бутан - C4H10 Пентан - C5H12 Гексан - C6H14 Гептан - C7H16 Октан - C8H18 Нонан - C9H20 Декан - C10H22
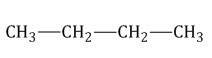 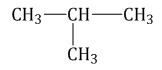 изобутан, изобутан,
Н-бутан 2-метилпропан. (нормальный бутан) РАСПОЗНАВАНИЕ : не обецвечивают растворы бромной воды ( Br2) и перманганата калия (KMnO4) |
| 1. строение | 1. хим. связи одинарные между атомами С–С. сигма-связи (σ-связи) 2. гибридизация атомов С sp3, угол связи 109о 28′ C–H и С–С 3. Молекулы линейных алканов с большим числом атомов углерода имеют зигзагообразное расположение атомов углерода
4. Характерна структурная изомерия – изомерия углеродного скелета |
| 2. Физ, свойства | С -- С4 С5 ---- С17 С 18------ Газы жидкости твердые ------------------------------------------------------------------ Уменьшение tкип. |
| 3. Химические свойства
| !!! Не могут вступать в реакции присоединения |
| 1.Реакции замещения, Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного
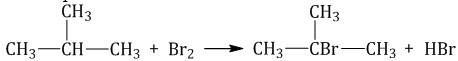
А) Галогенирование ( хлорирование, бромирование ) свет или t (по стадиям, цепная реакция), по свободнорадикальному механизму.
1) Например, галогенирование алканов (реакция цепная) А) CH4 + Cl2 hν → CH3Cl + HCl (1 стадия) CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия), ….. т.д.
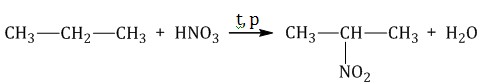
Б) Нитрование алканов + HNO3 Для удобства азотную кислоту - HNO3 – записывают как HO-NO2. (Атом Н в алкане замещается на нитрогруппу NO2 )
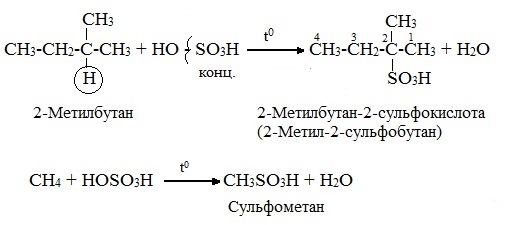
В) .Сульфирование : ………. + серная кислота Н2SO4 (НО─SO3Н). (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
|
| 2. Изомеризация С 4 И 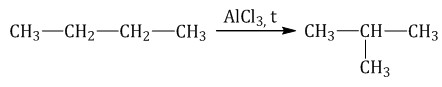 |
| 3. Дегидрирование – иск. метан 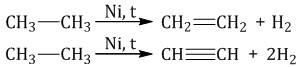
|
| 4. Крекинг (С ) разрыв связи С–С. в цепи, - образуются алкан + алкен Крекинг бывает термический и каталитический. Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды. 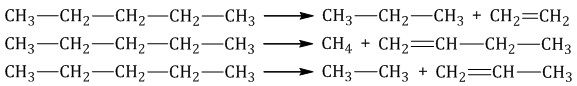 |
| 5.Дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла., n 5 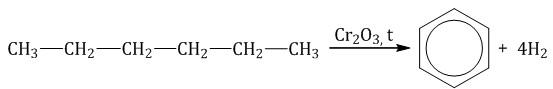
|
|
| 6. Окисление А) Полное окисление – горение Алкан + O2 → CO2 + 2H2O + Q CH4 + 2O2 → CO2 + 2H2O + Q !!!! 2C 4H10 + 5O2 --4C H3COOH + 2H2O Б) не окисляются сильными окислителями (KMnO4, хромат или дихромат калия и др.). |
| Получение | 1. галогеналкан + металл натрий (реакция Вюрца) Например, хлорметан реагирует с натрием с образованием этана: R Г +2Na + R Г → R-R + 2NaCl
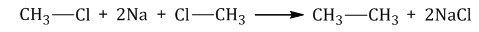
2 Электролиз растворов солей карбоновых кислот (электролиз по Кольбе)
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма) с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
4.Гидрирование алкенов, алкинов, циклоалканов С3, С4, алкадиенов 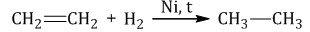
|
| ОСОБЫЕ СВОЙСТВА ВЕЩЕСТВА |
| CH4 метан , болотный, рудниичный газ. , взрывоопасен При каталитическом окислении метана кислородом возможно образование метанола, муравьиного альдегида или муравьиной кислоты в зависимости от условий проведения процесса и катализатора 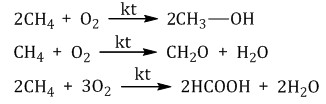 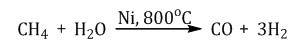 Продукт реакции – так называемый «синтез-газ» Пиролиз (дегидрирование) метана 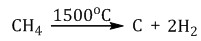 ацетилен Получение гидролиз карбида алюминия Al4C3 + 12H2O = 4Al(OH)3 + 3CH4 Al4C3 + 12HCl = 4AlCl3 + 3CH4 |






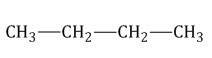
 изобутан,
изобутан,