
Атомның электрондық конфигурациясы


Атомның электрондық конфигурациясы


Атомның сыртқы қабатындағы электрондарды ұяшықтарға орналастыру.

Химиялық элементтердің периодтық жүйесі (Менделеев кестесі) — элементтердің әртүрлі қасиеттерінің атом ядросы зарядына тәуелділігін белгілейтін химиялық элементтердің жіктелу реті.
Периодтар
Период деп сілтілік металдан басталып инертті газбен аяқталатын элементтер тобын айтады. Периодтар горизонталь қатардан түрады. Бірінші периодта-2 элемент, екінші және үшіншіде-8-ден, төртінші мен бесіншіде-18-ден, алтыншыда-32, жетіншіде(аяқталмаған)-32 элемент бар. Әрбір период, біріншіден басқасы, сілтілік металдан басталып, инертті элементпен аяқталады.
Элементтің период номері бұл сол элементтің энергетикалық деңгейін немесе қабат санына тең. Мысалы, натрий 3 периодта орналасқан, онда 3 энергетикалық деңгей бар.

Топтар
Тігінен орналасқан элементтердің қатарын топтар деп атайды.
Топтардың аталуы
1 топ - сілтілік металдар
2 топ - сілтілік-жер металдар
d – элементтер - ауыспалы металдар
6 топ – халькогендер
7 топ – галогендер
8 топ - асыл газдар.
Элементтің топ номері сыртқы қабатындағы электрондар санына тең. Мысалы, 3 период, 1 топта орналасқан, олай болса натрийдің 3 энергетикалық қабаты бар. Соңғы 3 қабатында тек бір электрон орналасқан.
Сыртқы қабатындағы 1 электрон
3 қабат

Энергетикалық деңгей және деңгейше
n – энергетикалық деңгей, ол период номеріне тең. Мысалы, Натрий 3 периодта орналасқан, онда n = 3.
l – элементтердің типі, немесе энергетикалық деңгейше. Ол l =0, 1, 2,.... (n-1)
Мысалы: n = 1 n = 2 n = 3 n = 4
l = 0 l = 0,1 l = 0,1,2 l = 0,1,2,3
Әрбір ұяшыққа 2 электроннан сияды
l = 0 – s
l = 1 - p
l = 2 - d
l = 3 - f

Сыртқы қабаттағы электрондардың ұяшықтарға толтырылуы
Валенттілік дегеніміз – бұл жұптакспаған электрондардың саны
Натрий – тұрақты бір валентті, себебі жұптаспаған электрондардың саны 1 тең
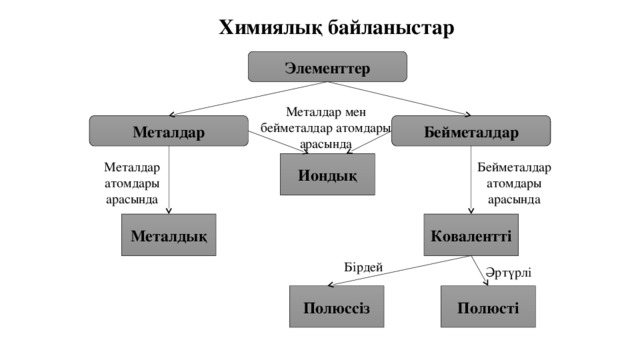
Химиялық байланыстар
Элементтер
Металдар мен бейметалдар атомдары арасында
Металдар
Бейметалдар
Иондық
Бейметалдар атомдары арасында
Металдар атомдары арасында
Ковалентті
Металдық
Бірдей
Әртүрлі
Полюсті
Полюссіз

Металдық байланыс
Металдың кристалдық торының түйіндерінде атомдар немесе олардың иондары орналасатыны белгілі. Металдық тордағы бостау күйдегі делокальданған электрондар көптеген ядролардың арасында өзара тарту күштерін тудырып, металдық байланыс түзеді. Металдардың сыртқы деңгейіндегі валенттік электрондар саны аз болатындықтан, олардың иондарға айналуы қиын емес: Me - ne - → Ме +n
Мұндай қабілетті металдар бос күйде де, химиялық әрекеттесу кезінде де көрсетеді. Бос күйдегі металдың белгілі физикалық қасиеттері: электр- және жылуөткізгіштігі, қаттылығы, иілімділігі, созылғыштығы, өзіне тән жылтыры, т.б. булардың барлығы металдық байланысқа тәуелді.
Металдардың валенттік электрондары өз ядросымен нашар байланысқан. Сондықтан, бір-бірінен оңай ажырайды және металда теріс иондар қатары қалыптасады. Бұл иондар кристалдық торда орналасқан және электрондардың көбісі бүкіл кристалл бойынша жылжи алады. Металдың электрондары бүкіл металдағы атомдарды байланыстырады.

Иондық байланыс
Иондық байланыс катиондар мен аниондардың арасында электро-статикалық тартылу күшінің нәтижесінде пайда болады. Химиялық әрекеттескен атомдар 8 электронды тұрақты октет қабатқа ие болып, катион мен анионға айналу үшін олар күшті металдар мен бейметалдарға жатуы тиіс.
Иондық байланысқан қатты заттар иондық кристалдық торға ие болады. Сондықтан олар қатты, берік, қиын балқитын заттарға жатады. Иондық байланыс көбіне нағыз типтік металдардың оксидтері мен гидроксидтеріне және барлық тұздарға тән.
Әдетте, бір молекуланың ішінде байланыстың әр түрлі типтері кездеседі. Мысалы, күшті негіздерде (КОН, Са(ОН) 2 , т.б. ) металл катионы мен гидроксотоп арасында иондық, ал оттек пен сутек арасында коваленттік полюсті байланыс түзіледі. Оттекті қышқылдардың тұздарында да (K 2 SО 4 , СаСО 3 , т.б.) металл катионы қышқыл қалдығының анионымен иондық байланыспен байланысса, оттек пен бейметалл (С, S) арасында коваленттік полюсті байланыс түзіледі.
Ковалентті байланыс
Ковалентті байланыс ортақ электрон жұбы түзілу арқылы іске асады. Ковалентті байланыстар тек бейметалл атомдарының арасында ғана түзіледі. Электртерістіліктері бірдей элемент атомдарының арасында (Н 2 , О 2 , N 2 , С1 2 ) байланыста болатын сутек молекуласының түзілу мысалында қарастырайык. Сутек атомының электрондық формуласы 1s 1 . Сутектің электротерістілігі 2,1. S-электрондарының электрон бұлттары сфера (шар) тәрізді, олардың өзара әсерлесуін былай көрсетуге болады:
Н • + •Н → Н : Н
Cонда s электрондарының бұлттары өзара қабысып, екі электрон екі ядроға да ортақ, олардан бірдей қашықтықта орналасады. Бірдей бейметалл атомдарының арасындағы байланыс полюссіз ковалентті байланыс деп аталады. Электрон бұлттары қабысуы нәтижесінде энергия бөлініп, молекула түзіледі. Бұл энергия шамасы молекуладағы байланыс беріктілігін сипаттайды, олай болса молекула жеке атомдарға қарағанда тұрақты жүйе. Полюссіз ковалентті байланыста байланыстырушы электрон жұбының бұлты ядролардан бірдей қашықтықта орналасады.
Молекулалардың құрылымдық формулаларында бір электрон жұбына бір сызықшаға ( - ) сейкес келеді. Сутек атомдарының валенттіліктері I, себебі валенттілік байланыс түзуге жұмсалған электрондар санымен анықталады. Сутегі молекуласындағы элементтердің тотығу дәрежелері нөлге тең, себебі атомдардың электртерістіліктері бірдей, электрондар жұптары екі элемент ядросынан бірдей қашықтықта орналасады.

Оттегі молекуласындағы байланыстың түзілуі
Оттек атомының электрондық формуласы 1s 2 2s 2 2p 4 , валенттілік электрондары 2s 2 2p 4 , электртерістілігі 3,5.
Электронды-графикалық формуласын қарасақ, валенттілік электрондар саны 6, оның екеуі дара күйінде, міне, осы электрондар екінші оттек атомындағы дәл осындай электрондармен екі жұп түзеді, яғни байланыс саны екі. Енді әр атом ядросын 8 электроннан айналатын болады. Сөйтіп, бұл мысалдан да көретініміз молекула түзілгенде аяқталған 8 электронды қабаттың пайда болуы.
Оттек атомдарының тотығу дәрежелері нөлге тең, валенттіліктері ІІ-ге тең болады. Еселі байланыс дара байланысқа қарағанда беріктеу болады.
Электрондардың электрон бұлттарының формаларын қолданып байланыстың түзілуін көрсетсек:

Ортақ электрон жұбы әр түрлі екі бейметалл атомдарының арасында түзілсе , онда байланыс ковалентті полюсті (полярлы) байланыс деп аталады.
Пайда болған ортақ электрон жұбы периодтық кестеде қайсысы оң жаққа қарай орналасса, соған қарай ығысып орналасады. Себебі солдан оңға қарай оладың бейметалдық қасиеті арта түседі .
Мысалы: хлорсутек молекуласы
Әдетте, бір молекуланың ішінде байланыстың әр түрлі типтері кездеседі. Мысалы, күшті негіздерде (КОН, Са(ОН) 2 , т.б. ) металл катионы мен гидроксотоп арасында иондық, ал оттек пен сутек арасында коваленттік полюсті байланыс түзіледі. Оттекті қышқылдардың тұздарында да (K 2 SО 4 , СаСО 3 , т.б.) металл катионы қышқыл қалдығының анионымен иондық байланыспен байланысса, оттек пен бейметалл (С, S) арасында коваленттік полюсті байланыс түзіледі.
Жалпы алғанда, химиялық байланысты типтерге жіктеу шартты сипатқа ие. Өйткені олардың түпкі негізі бір. Мысалы, иондық байланысты коваленттік байланыстың шекті түрі деп қарау керек. Металдық байланыста коваленттік полюсті байланыстың да, иондық байланыстың да элементтері бар. Көптеген заттарда "таза" бір ғана химиялық байланыс типі бола бермейді. Мысалы, ас тұзы — натрий хлориді иондық байланысты қосылыстарға жатады. Іс жүзінде оның 84% байланысы иондыққа, қалған 16%-і коваленттіге тиесілі. Сондықтан химиялық байланыстың полюстік дәрежесін біліп тұрып, нақты қай типке жататынын сөз еткен дұрыс.
Егер галогенсутектер қатарындағы байланыстың полюстік дәрежесінің өзгеруіне келсек, фторсутектен астатсутекке қарай: HF→HCl→HBr→HI→HAt төмендейді. Себебі галоген мен сутектің электртерістіктерінің айырмашылығы азая түседі де, ақыры астатсутекке жеткенде байланыс полюссіз коваленттіге жуықтайды.

Кристалдық торлардың түрлері

Металдық кристалдық тор
Қасиеттері
- Электр өткізгішітігі жоғары
- Жылу өткізгіштігі жоғары
- Балқу температурасының жоғары
- Беріктігі жоғары
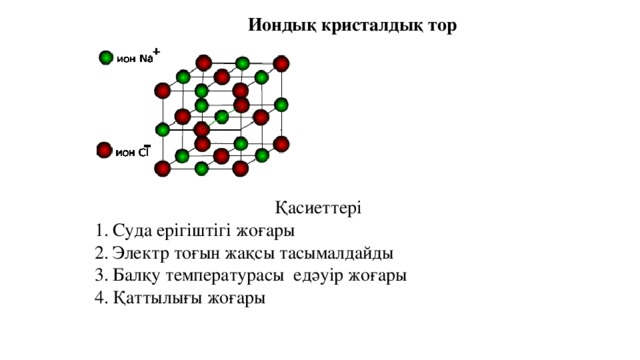
Иондық кристалдық тор
Қасиеттері
- Суда ерігіштігі жоғары
- Электр тоғын жақсы тасымалдайды
- Балқу температурасы едәуір жоғары
- Қаттылығы жоғары
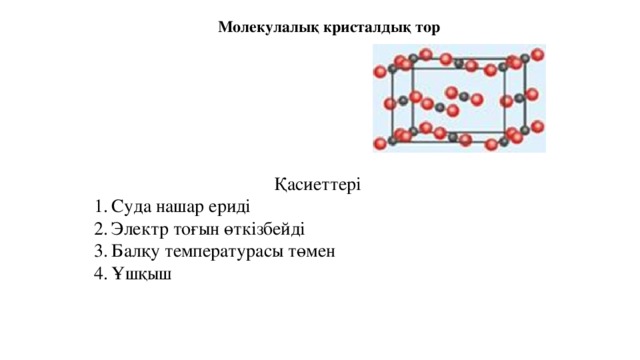
Молекулалық кристалдық тор
Қасиеттері
- Суда нашар ериді
- Электр тоғын өткізбейді
- Балқу температурасы төмен
- Ұшқыш
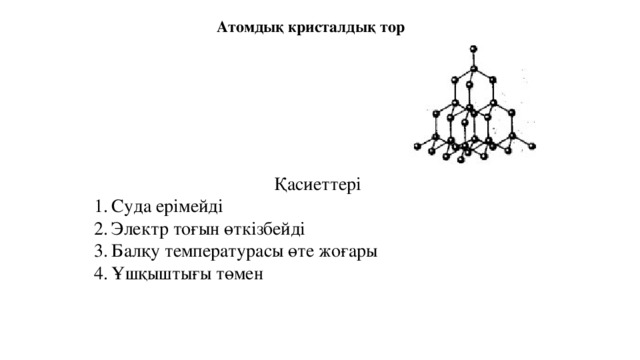
Атомдық кристалдық тор
Қасиеттері
- Суда ерімейді
- Электр тоғын өткізбейді
- Балқу температурасы өте жоғары
- Ұшқыштығы төмен



































