Просмотр содержимого документа
«Авторская методическая разработка к уроку химии "СОЛИ"»

СОЛИ
учитель химии МБОУ «Луганская школа Марьинского района» Зуб Татьяна Васильевна

Соли — это сложные вещества, состоящие из ионов
металлов и кислотных остатков.
Al(NO 3 ) 3

Формула соли из кислоты выводится
следующим образом:
6
3 +
2–
Al SO 4
Al 2 ( SO 4 ) 3
Сульфаты — соли серной кислоты.

Формула соли из кислоты выводится
следующим образом:
2
2+
2–
ZnSO 3
Zn SO 3

Название солей
соль
кислотный остаток
металл
+
нитрит натрия
NaNO 2
нитрат калия
KNO 3
хлорид
натрий ( Na)
нитрат
калий ( K)
сульфит
хлорид железа ( III ) FeCl 3
сульфид железа ( II ) FeS
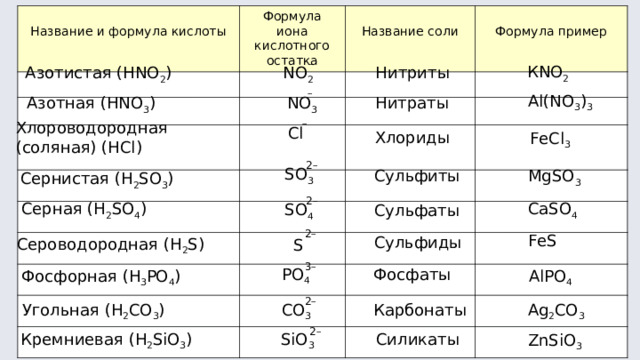
Название и формула кислоты
Формула иона кислотного остатка
Название соли
Формула пример
–
К NO 2
Азотистая ( HNO 2 )
NO 2
Нитриты
–
Al(NO 3 ) 3
Нитраты
NO 3
Азотная ( HNO 3 )
–
Хлороводородная
(соляная) ( HCl )
Cl
Хлориды
FeCl 3
2–
SO 3
Сульфиты
MgSO 3
Сернистая (H 2 SO 3 )
2–
Серная (H 2 SO 4 )
CaSO 4
SO 4
Сульфаты
2–
FeS
Сульфиды
Сероводородная (H 2 S)
S
3–
Фосфаты
PO 4
AlPO 4
Фосфорная (H 3 PO 4 )
2–
CO 3
Ag 2 CO 3
Угольная (H 2 CO 3 )
Карбонаты
2–
SiO 3
Кремниевая (H 2 SiO 3 )
Силикаты
ZnSiO 3

Растворимость солей в воде
Соли
растворимые
малорастворимые
(Р)
(М)
нерастворимые
(Н)

Растворимость оснований, кислот и солей в воде
Катионы
Анионы
Р
—
Р
Р
Р
—
М
Н
Н
Н
Н
Н
Н
Н
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
М
Р
Н
Р
Р
Р
Р
Р
Р
Н
—
Н
Н
Н
—
Н
Р
Р
Р
М
Р
М
—
Р
Р
Р
—
—
Н
М
М
М
М
Р
М
М
Н
Н
М
М
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Н
Н
Р
Н
Р
Р
Н
—
Н
Н
Н
—
—
Р
—
—
Н
Н
Н
Р
Н
—
—
Н
Н
Н
Н
Р
Н
Н
Н
Н
Н
Н
Н
Н
Н
Р
Р
Н
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
— растворимо
— малорастворимо
— нет достоверных сведений о
существовании соединения
— нерастворимо

Состав солей
Соли
двойные
комплексные
средние
кислые
основные

Zn
Pb
H 2 s
H 2 CO 3
карбонат свинца
сульфид цинка
( PbCO 3 )
( ZnS )
Средние соли — соли, состоящие из
кислотного остатка и ионов металла.

K
Na
H 2 SO 3
H 2 SO 4
H
H
гидросульфит калия ( КHSO 3 )
гидросульфат натрия ( NaHSO 4 )
Кислые соли — содержат кислотный остаток, атомы водорода и ионы металла.
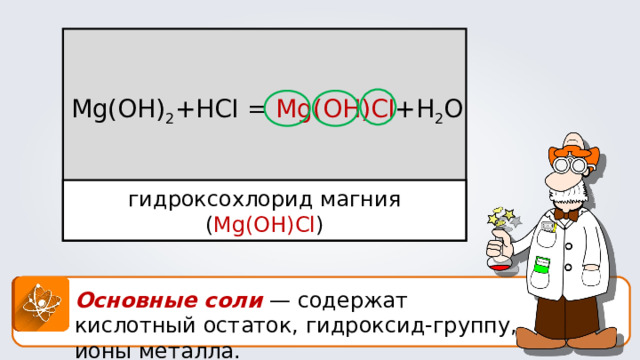
Mg(OH) 2 +HCI = Mg(OH)CI +H 2 O
гидроксохлорид магния ( Mg(OH)Cl )
Основные соли — содержат кислотный остаток, гидроксид-группу, ионы металла.

KAl ( SO 4 ) 2
алюмокалиевые квасцы
Двойные соли состоят из ионов двух
разных металлов и кислотного остатка.
![K 4 [ Fe ( CN ) 6 ] гексациноферрат калия Комплексные соли — в состав входят сложные (комплексные) ионы, которые в формулах заключаются в квадратные скобки.](https://fsd.multiurok.ru/html/2023/03/14/s_640fc04c32265/img13.jpg)
K 4 [ Fe ( CN ) 6 ]
гексациноферрат калия
Комплексные соли — в состав входят сложные (комплексные) ионы, которые в формулах заключаются в квадратные скобки.

Применение солей
NaCl — хлорид натрия
CaCO 3 — карбонат кальция
Ca 3 PO 4 — фосфат кальция

Применение солей.
Хлорид натрия ( NaCl )
поваренная соль

Применение солей.
Карбонат кальция ( CaCO 3 )
атоллы (тропические острова)

Применение солей.
Карбонат кальция ( CaCO 3 )
коралловые рифы

Применение солей.
Карбонат кальция ( CaCO 3 )
мел
мрамор
известняк

Применение солей.
Фосфат кальция ( Ca 3 Р O 4 )
фосфорит
апатит

Соли — сложные вещества, которые состоят
из ионов металла и кислотных остатков. Широко применяются во всех сферах жизни человека.




















![K 4 [ Fe ( CN ) 6 ] гексациноферрат калия Комплексные соли — в состав входят сложные (комплексные) ионы, которые в формулах заключаются в квадратные скобки.](https://fsd.multiurok.ru/html/2023/03/14/s_640fc04c32265/img13.jpg)

















