Просмотр содержимого документа
«Азотная кислота»

Азотная кислота
Подготовила Лушникова Анастасия Викторовна
для учащихся 9 класса гимназии №31 г. Саратова

Цель урока: Изучить свойства азотной кислоты и ее применение.
- Изучить состав и строение молекулы азотной кислоты;
- Вспомнить физические свойства;
- Отметить ее особенности взаимодействия с металлами.
- Рассмотреть области применения азотной кислоты.

«Терминологическая разминка»
1. Степень окисления - это условный заряд атома.
2. Окислитель - это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции.
3. Восстановитель - это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции.
4. Электролит - вещества, которые проводят электрический ток.
5. Индикаторы - вещества, изменяющие свой цвет в зависимости от среды раствора.
6. Донорно - акцепторная связь - это передача неподеленной электронной пары от донора к акцептору с образованием связи.

К.П.С.
К.П.С.
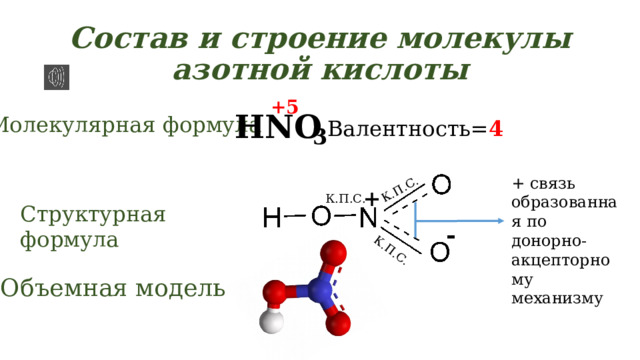
Состав и строение молекулы азотной кислоты
+5
HNO
Молекулярная формула
Валентность= 4
3
+ связь образованная по донорно-акцепторному механизму
+
К.П.С.
Структурная формула
-
Объемная модель

Физические свойства азотной кислоты
- Бесцветная жидкость, дымящаяся на воздухе с едким запахом
- Концентрированная – желтого цвета из-за NO 2 ↑
- Плотность кислоты- 1,52 г/см
- Температура кипения + 86 С
- Температура замерзания - 41 С
- Гигроскопична- способность поглощать водяные пары из воздуха.
- Растворима в воде
- Сильный электролит
3
°
°

горячая
холодная
Схема взаимодействие с металлами
HNO
60%
2%
10%
3
Ме до Н 2
Ме после Н 2
Au, Pt, Te, W
Mg
Al Fe
Cr
Ме любой активности
От Li до Zn
От Fe до Pb
СОЛЬ Ме
N
NO
N O
-
H 2 O
NH 4 NO 3
NO 2
N O
2
2
2

Примеры реакций

Применение азотной кислоты
Производство лекарств
В авиации
Производство удобрений
HNO
Ракетное топливо
3
Красители
Пластмассы
Взрывчатые вещества

Спасибо за внимание!!!
До встречи на уроке!!!
Всем успехов!!!



























