Просмотр содержимого документа
«Фенол туралы түсінік»

Фенол
C 6 H 5 OH
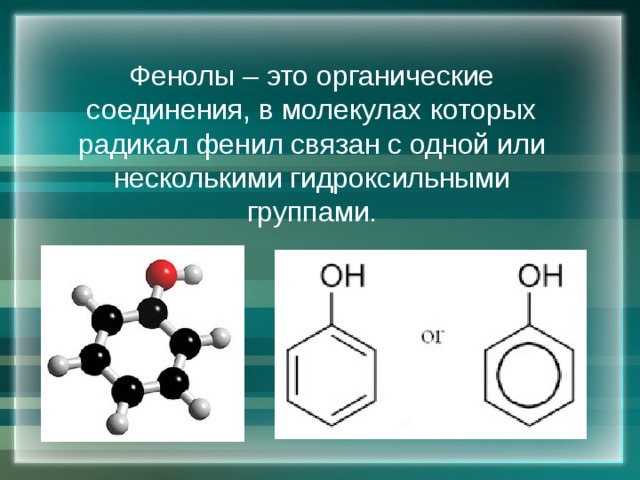
Фенолы – это органические соединения, в молекулах которых радикал фенил связан с одной или несколькими гидроксильными группами.
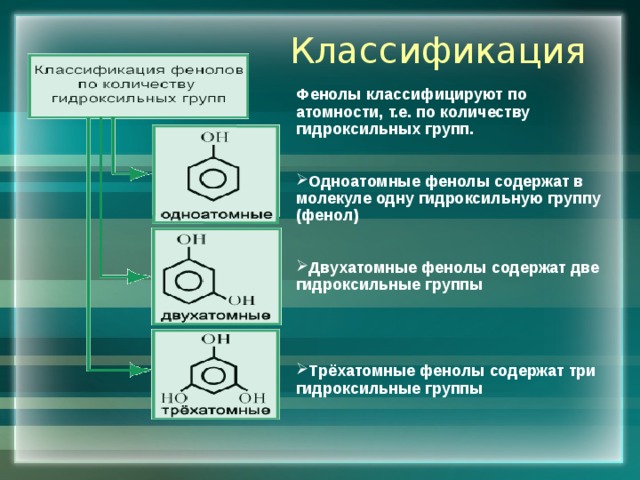
Классификация
Фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
- Одноатомные фенолы содержат в молекуле одну гидроксильную группу (фенол)
- Двухатомные фенолы содержат две гидроксильные группы
- Трёхатомные фенолы содержат три
гидроксильные группы

Физические свойства
- Бесцветное кристаллическое вещество с характерным запахом.
t пл = 41ºС , t кип = 182 ºС
- При хранении приобретает розоватый оттенок.
- Фенол очень вреден для здоровья. Ядовит.
- В холодной воде плохо растворим, но при нагревании до 70 ºС
растворяется полностью.

Химические свойства
1. Реакция гидроксильной группы.
- Фенол проявляет свойства слабой кислоты :
- Взаимодействует с щелочными металлами и щелочами с образованием солей – фенолятов :
- Фенол ( как кислота ) слабее угольной кислоты :
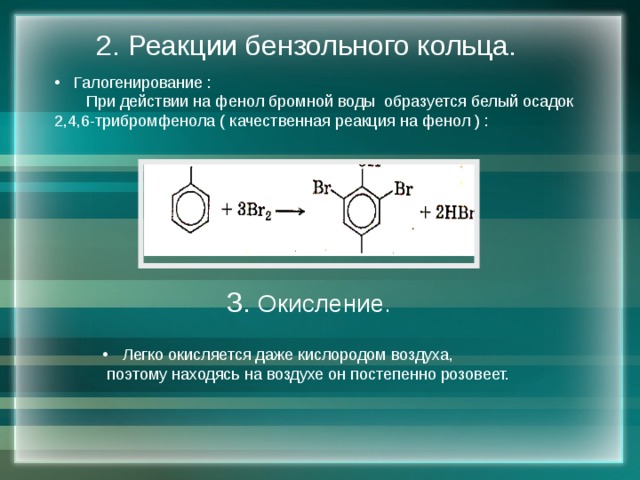
2. Реакции бензольного кольца.
При действии на фенол бромной воды образуется белый осадок 2,4,6-трибромфенола ( качественная реакция на фенол ) :
3. Окисление.
- Легко окисляется даже кислородом воздуха,
поэтому находясь на воздухе он постепенно розовеет.

Получение фенолов
- Перегонкой каменноугольной смолы.
2. Синтез из бензола, через промежуточный продукт хлорбензол.
C6H6 + Cl2 → C6H5Cl + HCl C6H5Cl + 2NaOH → C6H5ONa + NaCl + H2O
3. Кумольный метод - одновременно получаются 2 ценных продукта - фенол и ацетон.
Вначале из бензола получают кумол. Кумол затем окисляют до гидропероксида кумола,
который разлагают действием серной кислоты на фенол и ацетон.
C6H6 + CH2=CH-CH3 C6H5-CH(CH3)2 (кумол)

Одним из основных источников для промышленного получения фенола является каменный уголь.

Дезинфицирующее средство. Сырье при производстве красителей,
фенолоформальдегидных пластмасс, многих лекарственных средств (салициловая и
ацетилсалициловая кислоты, парацетамол). Гидрохинон используется в фотографии.
Применение


























