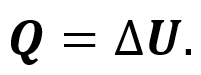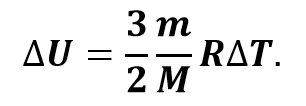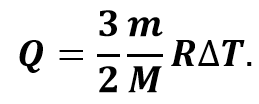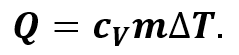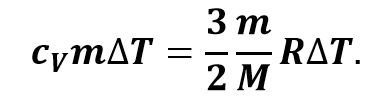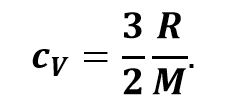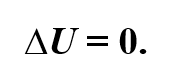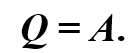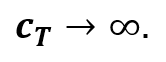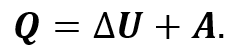https://videouroki.net/tests/3418833/ ТЕСТ
https://videouroki.net/tests/3418833/ САМОСТОЯТЕЛЬНАЯ РАБОТА








чтобы в системе произошли какие-то изменения необходимо приложить определенные усилия извне. В народной мудрости своеобразным выражением первого закона термодинамики могут служить пословицы – «под лежачий камень вода не течет», «без труда не вытащишь рыбку из пруда» и прочая. То есть на примере пословицы про рыбку и труд, можно представить, что рыбка и есть наша условно закрытая система, в ней не произойдет никаких изменений (рыбка сама себя не вытащит из пруда) без нашего внешнего воздействия и участия (труда).
Интересный факт: именно первый закон термодинамики устанавливает, почему потерпели неудачу все многочисленные попытки ученых, исследователей, изобретателей изобрести «вечный двигатель», ведь его существование является абсолютно невозможным согласно этому самому закону, почему, смотрите абзац выше.
В начале нашей статьи было максимального простое определение первого закона термодинамики, в действительности в академической науке существует целых четыре формулировки сути данного закона:
Энергия ни откуда не появляется и ни куда не пропадает, она лишь переходит из одного вида в другой (закон сохранения энергии).
Количество теплоты, полученной системой, идет на совершение ее работы против внешних сил и изменение внутренней энергии.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе, и не зависит от способа, которым осуществляется этот переход.
Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Применение первого закона термодинамики
Первый закон термодинамике имеет практическое применение к различным процессам в физике, например, позволяет вычислить идеальные параметры газа при разнообразных тепловых и механических процессах. Помимо сугубо практичного применение можно этому закону найти применение и философское ведь что ни говорите, но первый закон термодинамики является выражением одного из самых общих законов природы – закона сохранения энергии. Еще Еклезиаст писал, что ничто ни откуда не появляется и никуда не уходит, все пребывает вечно, постоянно трансформируясь, в этом и кроется вся суть первого закона термодинамики.
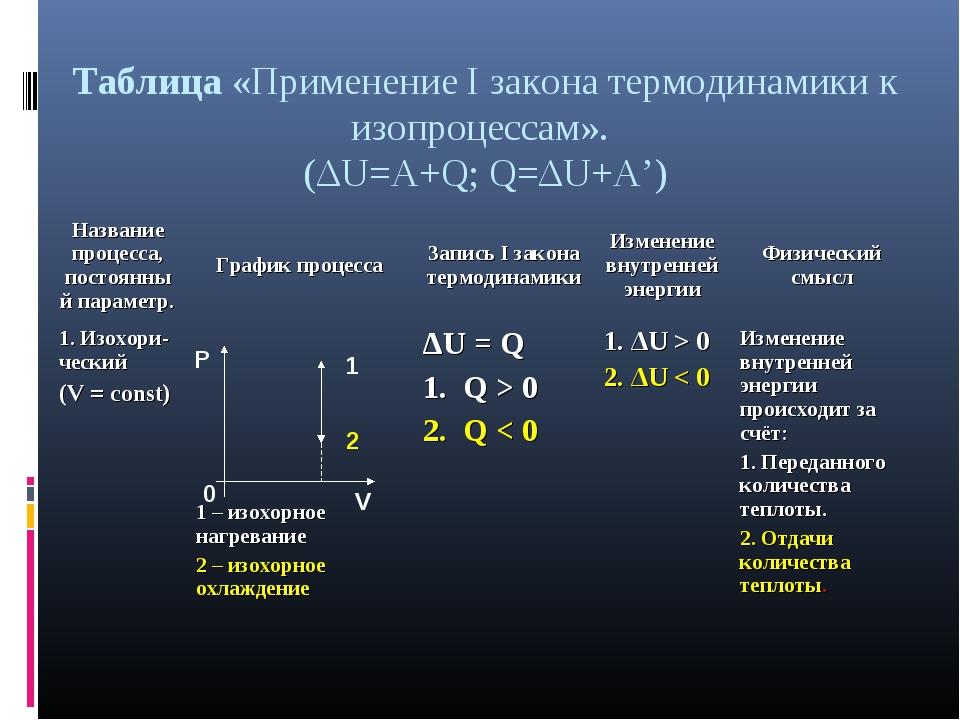
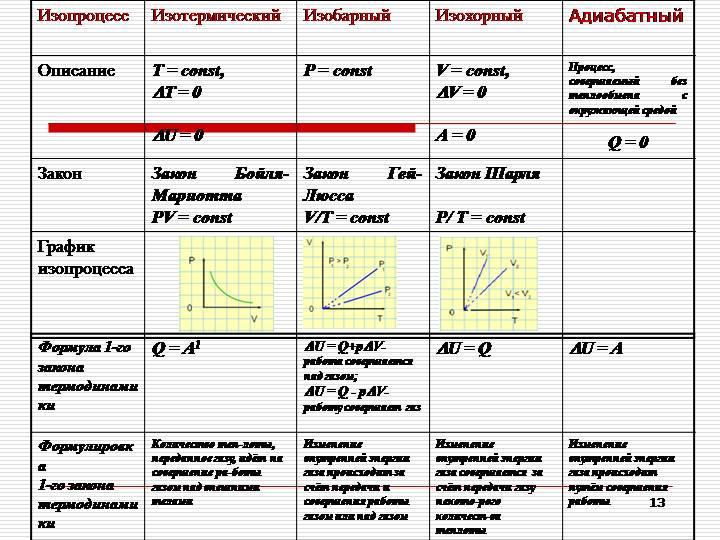
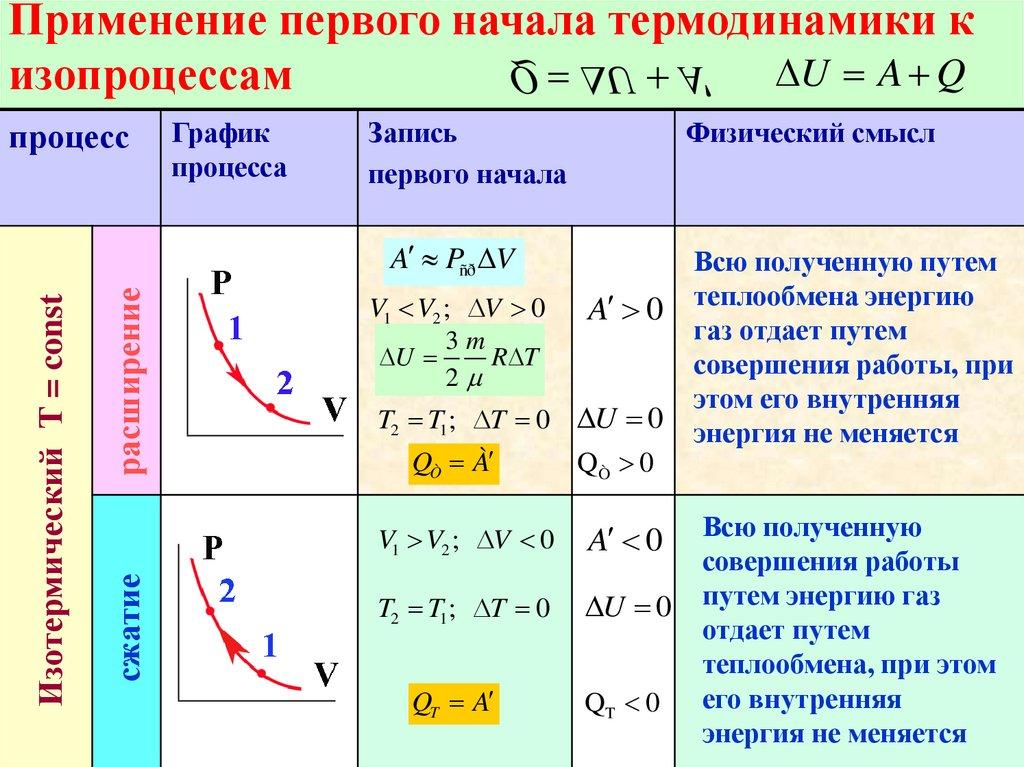
С помощью первого закона термодинамики можно делать важные заключения о характере протекающих процессов. Рассмотрим различные процессы, при которых одна из физических величин, характеризующих состояние газа, остаётся неизменной (то есть изопроцессы). Естественно, что для простоты мы будем считать газ идеальным одноатомным.
Пусть газ находится в цилиндрическом сосуде, закрытом неподвижным поршнем. Что произойдёт, если мы начнём подводить теплоту к газу? Если пренебречь тепловым расширением сосуда, то объём газа остаётся практически неизменным, хотя давление газа увеличивается. Следовательно, работа силы давления газа равна нулю. А это, согласно первому закону термодинамики, означает, что при изохорном процессе всё передаваемое газу количество теплоты идёт на увеличение его внутренней энергии:
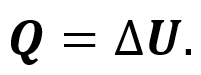
Очевидно, что если теплота отводится от газа, то изменение внутренней энергии отрицательно и внутренняя энергия газа уменьшается.

Мы уже с вами знаем, что изменение внутренней энергии идеального одноатомного газа прямо пропорционально изменению его абсолютной температуры и не зависит от других макроскопических параметров системы:
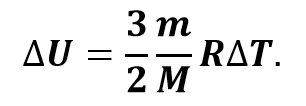
Следовательно, при изохорном процессе количество теплоты также пропорционально изменению абсолютной температуры:
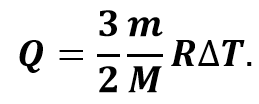
С другой же стороны, количество теплоты, переданное термодинамической системе, прямо пропорционально её массе и изменению абсолютной температуры:
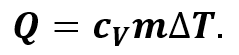
В записанной формуле cV — это удельная теплоёмкость газа при постоянном объёме. Давайте подставим записанное уравнение в предыдущую формулу:
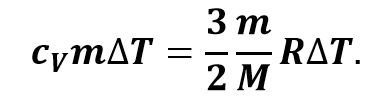
Сократив полученное выражение на массу газа и изменение его температуры, получим, что удельная теплоёмкость газа при изохорном процессе обратно пропорциональна его молярной массе:
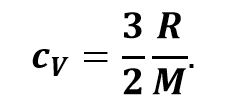
Теперь предположим, что наш сосуд с газом под поршнем находится в термостате (напомним, что это устройство, в котором поддерживается постоянная температура). Если теперь, например, мы с помощью внешнего устройства начнём медленно перемещать поршень в сосуде так, чтобы объём газа увеличивался, то работа силы давления расширяющегося газа будет положительной. При одинаковой первоначальной температуре термостата и газа теплопередачи не происходит. Положительная работа силы давления расширяющегося газа совершается за счёт уменьшения его внутренней энергии, а значит, и температуры. Но как только температура газа начинает уменьшаться, тут же возникает теплопередача от термостата газу. При медленном перемещении поршня в сосуде температура газа успевает выровняться, а реально происходящий процесс близок к изотермическому.
Значит, и внутренняя энергия идеального одноатомного газа остаётся постоянной, а её изменение равно нулю:
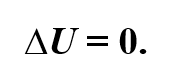
Отсюда следует, что при изотермическом процессе всё подведённое к газу количество теплоты идёт на совершение газом работы:
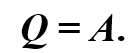

Если же внешнее устройство обеспечивает медленное уменьшение объёма газа в сосуде, то работа газа будет отрицательной. А это приводит к увеличению внутренней энергии и, следовательно, температуры газа. В результате возникает теплопередача от газа термостату.
Что касается теплоёмкости газа при изотермическом процессе, то она стремится к бесконечности (предлагаем вам самостоятельно доказать это):
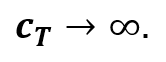
Теперь предположим, что наш газ находится в цилиндрическом сосуде, закрытом поршнем, который может свободно перемещаться. Будем изобарно нагревать газ (напомним, что изобарный процесс — это процесс, протекающий при постоянном давлении). Очевидно, что в этом случае газ будет нагреваться, расширяться и совершать работу, то есть будет изменяться его внутренняя энергия. Следовательно, при изобарном процессе подведённое к газу количество теплоты частично расходуется на увеличение внутренней энергии системы и частично на совершение работы силой давления газа при его расширении:
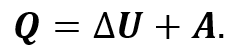
Распишем величины, входящие в формулу, согласно их определению:
Величина cp — это удельная теплоёмкость газа при постоянном давлении.
Преобразуем формулу для работы газа. Для этого запишем уравнение Клапейрона — Менделеева для двух его состояний (а мы вправе это сделать, так как масса газа и его химический состав в ходе процесса не изменялись):
Теперь вычтем из второго уравнения первое:
Сравнивая последнее уравнение с формулой для работы, находим, что работа газа прямо пропорциональна изменению его абсолютной температуры:
Перепишем первое начало термодинамики для изобарного процесса с учётом наших рассуждений:
Полученное равенство разделим на массу газа и изменение его температуры:
Сравнивая полученное равенство с выражением для удельной теплоёмкости газа при постоянном объёме, видим, что удельная теплоёмкость газа при постоянном давлении всегда больше его удельной теплоёмкости при постоянном объёме:
Это объясняется тем, что при постоянном давлении часть подводимой энергии расходуется на совершение силой давления газа работы при расширении.
Расширение жидких и твёрдых тел при нагревании при постоянном давлении значительно меньше, чем газов. Поэтому их работа при расширении намного меньше, чем изменение внутренней энергии. Следовательно, их удельные теплоёмкости слабо зависят от характера процесса (ср ≈ сV).
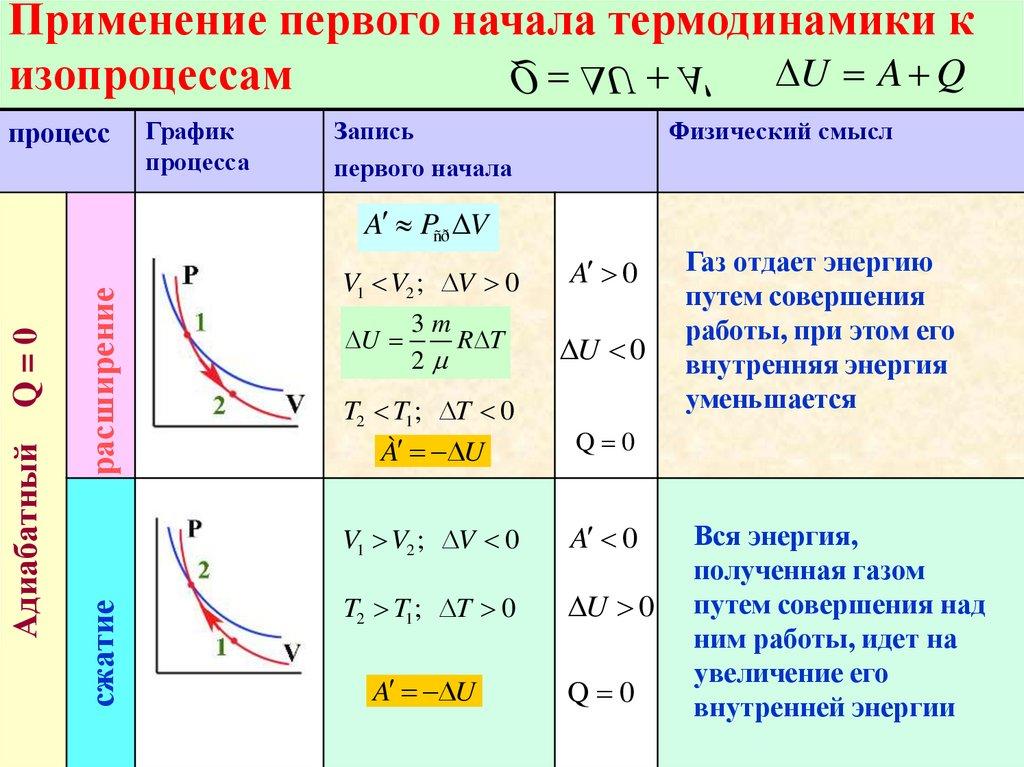
А теперь давайте представим, что мы смогли теплоизолировать цилиндр с газом и предоставили ему возможность самопроизвольно расширяться. Очевидно, что при этом газ будет совершать положительную работу. Но за счёт чего? Ведь теплообмен с окружающей средой отсутствует, то есть теплота не подводится (Q = 0).
Процесс, протекающий без теплообмена термодинамической системы с окружающей средой, называется адиабатным процессом.
Из первого закона термодинамики следует, что работа газа при адиабатном процессе совершаться только за счёт убыли его внутренней энергии:
Таким образом, при адиабатном расширении газ совершает работу и сам охлаждается. И наоборот, при адиабатном сжатии работа совершается над газом и он нагревается. А так как при адиабатном процессе количество теплоты равно нулю, то и удельная теплоёмкость газа также равна нулю:
На практике адиабатный процесс осуществляется главным образом не за счёт теплоизоляции (нельзя окружить систему оболочкой, которая абсолютно не допускает теплопередачи), а за счёт скорости протекания процесса. Например, когда вы открываете охлаждённую газировку, то можете заметить облачко тумана, которое растекается из горлышка бутылки. Объясняется это тем, что при адиабатном расширении происходит уменьшение температуры газа и, как следствие, происходит конденсация пара.
Адиабатный процесс, как и все изопроцессы, можно наглядно представить в виде графика зависимости давления газа от его объёма. График адиабатного процесса в координатах (p, V), называется адиабатой.
Обрати
https://www.youtube.com/watch?v=QV2zoyZpS40&feature=emb_logo