| Начало формы Фосфор – необходимый элемент для жизни аквариума. Животные используют его для развития костной и нервной систем, он содержится во многих белках и таких соединениях, как АТФ и ДНК. Однако главными потребителями фосфора в аквариуме являются всё-таки растения. Нормальное развитие растений без него невозможно. Назовите два продукта питания, которые целесообразно употреблять в пищу для пополнения запасов фосфора в организме.
2 группа
Вода (оксид водорода) H2O — самое распространённое вещество на Земле. Это единственное вещество, которое существует на планете одновременно в трёх агрегатных состояниях. Жидкая вода покрывает 75 % земной поверхности реками, озёрами, морями и океанами. Большое количество твёрдой воды в виде льда сосредоточено на Северном и Южном полюсах. Газообразная вода содержится в атмосфере.  Рис. 1. Вода, лёд, пар Вода входит в состав всех живых организмов. Например, организм человека содержит 70 % воды, рыбы — 80 %. В живой клетке вода представляет собой среду, в которой протекают жизненно важные процессы. Она участвует во многих биохимических реакциях (фотосинтез, гидролиз сложных органических веществ). Ни один организм не может обходиться без воды. Так, большое дерево для обеспечения всех жизненных потребностей летом поглощает из почвы и испаряет в течение суток 500–700 дм³ воды, а человек без воды не может прожить более 4 дней. Живым организмам требуется пресная вода. Её запасы на планете ограничены. Поэтому важное значение приобретает проблема охраны водных источников от загрязнения и экономного расходования пресной воды. В природе абсолютно чистой воды не бывает. В ней всегда содержатся примеси. Для получения особо чистой воды используют дистилляцию (перегонку). Воду испаряют, а затем пары конденсируют в приёмнике. Полученная таким способом вода называется дистиллированной и применяется для приготовления лекарств, лабораторных растворов и т. д. Строение воды В молекуле воды — две ковалентные полярные связи O−H и две неподелённые электронные пары на атоме кислорода. Структурная формулы воды: H−O H Электронная формула: .. H :O: .. H Молекула воды имеет угловое строение. Угол между связями составляет 104,5°. Молекула представляет собой диполь. В ней атом кислорода несёт отрицательный заряд, а атомы водорода — положительный:  Рис. 2. Молекула воды Полярность молекул воды часто представляется упрощённо в виде эллипса с двумя полюсами:  Рис. 3. Диполь Полярность молекулы воды оказывает сильное влияние на её физические и химические свойства. Почему же именно воду называют веществом номер один?
При обычных условиях вода — прозрачная жидкость без вкуса и запаха. В тонком слое она бесцветна, а при толщине более 2 м имеет голубой оттенок. Плотность жидкой воды максимальна при 4 °С и равна 1 г/см³ (1000 г/дм³). В отличие от других веществ твёрдая вода (лёд) легче жидкой. Плотность льда при 0 °С составляет 0,92 г/см³. Поэтому айсберги плавают по поверхности океанов, а пресноводные водоёмы зимой не промерзают до дна, и обитающие в них организмы выживают во время сильных морозов.  Рис. 1. Айсберг Температура плавления воды равна 0 °С, а температура кипения — 100 °С. Это аномально высокие значения для вещества с такой низкой молекулярной массой. Эта и другие особенности свойств воды обусловлены образованием агрегатов из полярных молекул воды за счёт межмолекулярных водородных связей.
Водородная связь — это взаимодействие между положительно заряженными атомами водорода одной молекулы и отрицательно заряженными атомами кислорода, фтора или азота другой молекулы. Эта связь слабее ковалентной. Но благодаря ей значительно повышаются температуры плавления и кипения веществ.  Рис. 2. Водородная связь Водородными связями объясняется также способность воды образовывать при замерзании снежинки разной формы.  Рис. 3. Снежинка Из всех жидких и твёрдых веществ у воды самая высокая теплоёмкость. Она медленно нагревается и так же медленно остывает. Благодаря такому свойству вода влияет на климат Земли, сглаживая колебания температуры. Моря и океаны накапливают тепло в тёплое время, а в холодное — его освобождают. У воды высокие значения теплоты плавления и теплоты парообразования. Поэтому процессы таяния льда и снега, испарения воды происходят постепенно и приводят к медленной смене сезонов года: зима — весна — лето — осень. Ещё одна особенность воды — высокое поверхностное натяжение. Поверхностное натяжение обуславливает капиллярные явления, собирает воду в капли, создаёт поверхностную плёнку и позволяет некоторым насекомым перемещаться по ней.  Рис. 4. Роса  Рис. 5. Водомерка Высокая полярность молекул обуславливает способность воды растворять вещества с ионной или ковалентной полярной связью. Такие вещества часто называют гидрофильными. К ним относятся соли, щёлочи, некоторые кислоты и другие. Неполярные вещества в воде не растворяются. Их называют гидрофобными - спирты, амины, углеводы, белки, соли. Вода - важнейший компонент клетки, определяет физические свойства клетки – объём, упругость. Вода растворяет вещества, участвующих в химических реакциях: переносит питательные вещества, выводит из клетки отработанные и вредные соединения. Обеспечивает гидролиз, окисление высокомолекулярных органических соединений (белков, жиров, углеводов). Какова биологическая роль воды в клетке? Написать гидролиз NaCl и AlCl3.
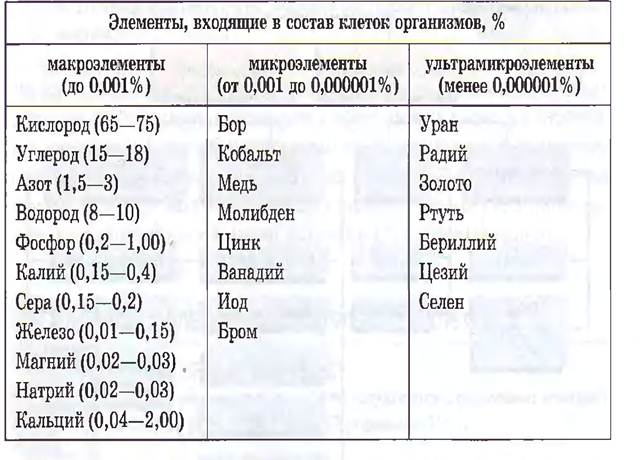
3 группа Их числа неорганических соединений, входящих в состав организмов, наибольшее значение имеют соли минеральных кислот т соответствующие им катионы и анионы. Хотя потребность человека и животных в минеральных веществах выражается десятками и даже тысячными долями грамма, однако отсутствие в пище какого-либо из биологически важных элементов ведёт к тяжелым заболеваниям, например, эндемический зоб при недостаточном содержании йода в питьевой воде. Минеральные соли обеспечивают стабильные показатели осмотического давления, передачу нервного импульса, являются носителями электрического заряда. Для процессов жизнедеятельности из входящих в состав солей катионов наиболее важны: К+, Na+, Ca2+, Mg2+ из анионов: HPO42-, H2PO4-, Cl-, HCO3- Прочность и твёрдость костной ткани обеспечивается фосфатом кальция, а раковин моллюсков – карбонатом кальция. В клетке минеральные соли находятся в твёрдом или в растворённом виде. Растворённые соли диссоциированы на ионы. Наиболее важными являются катионы металлов: калия K+, натрия Na+, кальция Ca2+, магния Mg2+, и анионы: Cl−, H2PO−4, HPO2−4, HCO−3, CO2−3.Конец формы
|