Практическое занятие № 4
Решение задач по теме: «Углеводороды и их природные источники».
Учебная цель: формировать умение решать задачи по теме: «Углеводороды и их природные источники».
Учебные задачи:
повторить правила написания углеводородов по систематической номенклатуре, химические свойства, получение и применение.
Научиться решать задачи на вывод молекулярной формулы органического соединения.
Научиться пользоваться правилом Ле Шателье для смещения химического равновесия;
Ожидаемые результаты:
Студент должен:
иметь практический опыт: применения знаний по органической химии при решении задач;
знать: предельные и непредельные углеводороды, понятия изомерии и гомологии
уметь: называть разветвленные УВ по систематической номенклатуре, писать уравнения реакции, отображающие химические свойства, получения УВ, выполнять расчёты по формулам;
владеть: навыками работы с калькулятором.
Обеспеченность занятия (средства обучения):
Сборник методических указаний для студентов по выполнению практических занятий по учебной дисциплине «Химия».
Рабочая тетрадь.
Карточки – задания.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
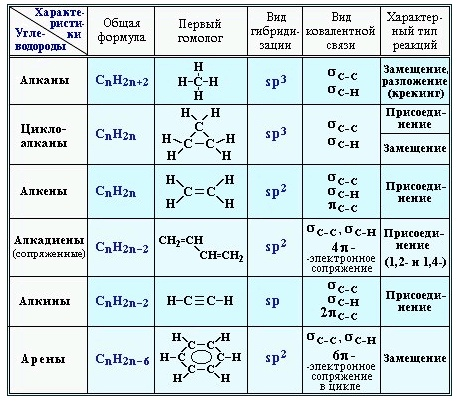
Углеводороды – самые простые органические соединения, состоящие из углерода и водорода. В зависимости от характера углеродных связей и соотношения между количеством атомов углерода и водорода они делятся на предельные (насыщенные) и непредельные (ненасыщенные) с одной или несколькими кратными связями. В зависимости от строения углеродной цепи углеводороды относятся к соединениям с открытой (незамкнутой) углеродной цепью и с замкнутой, т.е. к циклическим соединениям. Среди циклических углеводородов особую группу составляют ароматические углеводороды, отличающиеся рядом специфических свойств.
 Гомологи - вещества, принадлежащие к одному классу, сходные по составу, строению и свойствам, но различающиеся на одну или несколько групп СН2 (группу СН2 называют гомологической разностью)
Гомологи - вещества, принадлежащие к одному классу, сходные по составу, строению и свойствам, но различающиеся на одну или несколько групп СН2 (группу СН2 называют гомологической разностью)
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их молекулярных масс, сходных по строению и химическим свойствам, где каждый член отличается от предыдущего на группу СН2 Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. Различия в порядке соединения атомов в молекулах (т.е. в химическом строении) приводят к структурной изомерии. Строение структурных изомеров отражается структурными формулами.
УВ в зависимости от строения проявляют следующие химические свойства:
Задачи на вывод молекулярной формулы органического вещества:
Алгоритмы решения.
1. 1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) =  (2)
(2)
б) если w дана в долях:
n(Э) =  (3)
(3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Пример: Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
Дано:
w(C) = 82,75%
w(H) = 17,25%
D(возд) = 2
______________
Найти:
СхНу
M(воздуха) = 29г/моль
М(С4Н10) =12 * 4 + 1 * 10 = 58г/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
n(С) =  = 4
= 4
3. Находим количество атомов Н по формуле (2)
n(Н) =  = 1
= 1
4. Вычисляем молярную массу С4Н10
М(С4Н10) = 12 * 4 + 1 * 10 = 58г/моль
5. Вычисленная молярная масса совпадает с (1), задача решена.
Ответ: С4Н10
2.Определение формул веществ по продуктам сгорания.
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) =  (2)
(2)
б) если СО2 дано в объеме:
n(C) =  (3)
(3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N)
n(Н) = 2  (4)
(4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Пример: При сгорании органического вещества массой 2, 37 г образовалось 3,36 г оксида углерода(IV) (н.у.), 1,35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2,724. Выведите молекулярную формулу вещества.
Дано:
m ( в-ва) = 2,37г
V (CO2) = 3,36 л
m (H2O) = 1,35 г
D (возд.) = 2,724.
_________________
Найти:
CxHyNz
М(возд) = 29 г/моль
М(Н2О) = 18 г/моль
Vm = 22,4л/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
n(C) =  = 5
= 5
2. Находим количество атомов Н по формуле (4)
n(Н) = 2  = 5
= 5
3. Вычисляем молярную массу С5Н5.
М(С5Н5) = 12 * 5 + 1 * 5 = 65г/моль
4. Вычисляем количество атомов азота (5)
79 – 65 = 14. т.к. атомная масса азота – 14, значит в данной формулу один атом N.
Ответ: С5Н5N
Выполнение работы.
1 Вариант
Назовите вещества:
а) СН2 = СН- С Н – СН2 – СН – СН2 – СН2 – СН3
| |
С2Н5 СН3
б) СН ≡ С – СН2– СН- СН2 – СН3
|
СН3
2.Составить структурные формулы соединений по их названиям:
а)3-метилпентен-1; б) 2,3-диметилбутадиен-1,3
3. Составьте уравнения реакций по цепочке превращений:
оксид кальция → карбид кальция → ацетилен → бензол
4.Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
При сжигании 2.2 г. вещества получили 4,4 г оксида углерода и 1,8 г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
2 Вариант
1.Назовите вещества:
а)СН3– СН = С – СН2 – СН2 – СН – СН3
| |
С2Н5 СН3
б)СН3 – С ≡С– СН2 - СН – СН3
|
СН3
2.Составить структурные формулы соединений по их названиям:
а)4-метилпентин-2; б) 2,3-диметил-3-этилгексан.
3. Составьте уравнения реакций по цепочке превращений:
карбид алюминия → метан → ацетилен → этилен
4. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
5.При сгорании 11,2 г. Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Порядок выполнения отчёта по практическому занятию:
В тетради напишите номер, название и учебную цель занятия.
Выполните задания по вариантам.







 Гомологи - вещества, принадлежащие к одному классу, сходные по составу, строению и свойствам, но различающиеся на одну или несколько групп СН2 (группу СН2 называют гомологической разностью)
Гомологи - вещества, принадлежащие к одному классу, сходные по составу, строению и свойствам, но различающиеся на одну или несколько групп СН2 (группу СН2 называют гомологической разностью) 










