
Амины, анилин: строение, свойства получение, применение.
Преподаватель химии и биологии
ГБПОУ РО «НАТТ имени Героя Советского Союза Вернигоренко И.Г.»
Г. Новошахтинск Ростовской области

Цели урока
Рассмотреть строение, изомерию, свойства, получение, применение аминов и анилина.
Развить навыки определения видов изомерии, номенклатурных названий, написания уравнений реакций химических свойств аминов и анилина.

Строение
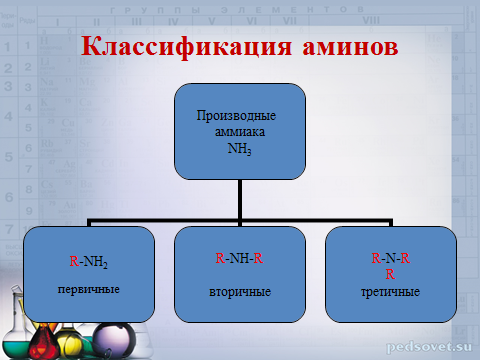
Амины - органические произведения аммиака, в молекуле которого один, два или все три атома водорода замещены углеводородным остатком.

Классификация аминов
Производные
аммиака
N H 3
R -N H 2
R -N H - R
R -N- R
R
первичные
вторичные
третичные

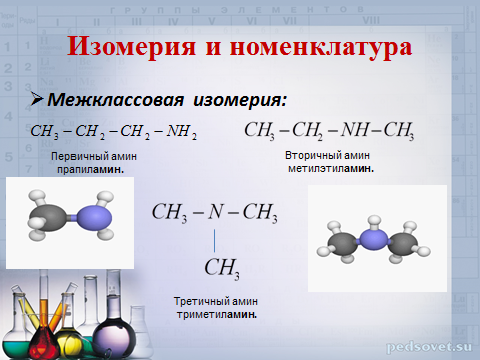
Изомерия и номенклатура
- Изомерия углеродного скелета:
бутил амин
изобутил амин

Изомерия и номенклатура
- Изомерия положения функциональной группы:
пропил амин
изопропил амин
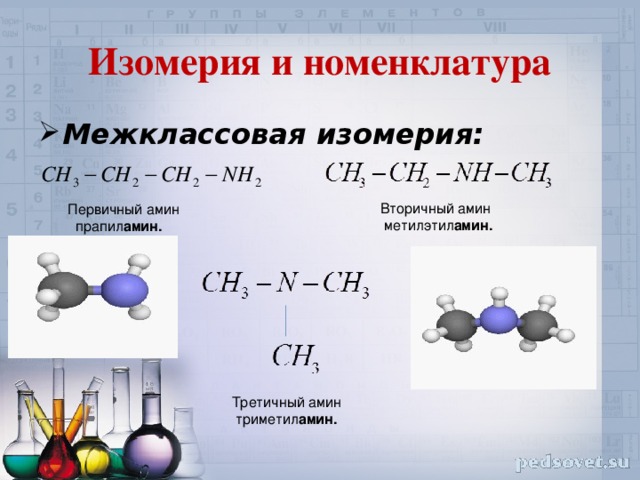
Изомерия и номенклатура
Вторичный амин
метилэтил амин.
Первичный амин
прапил амин.
Третичный амин
триметил амин.
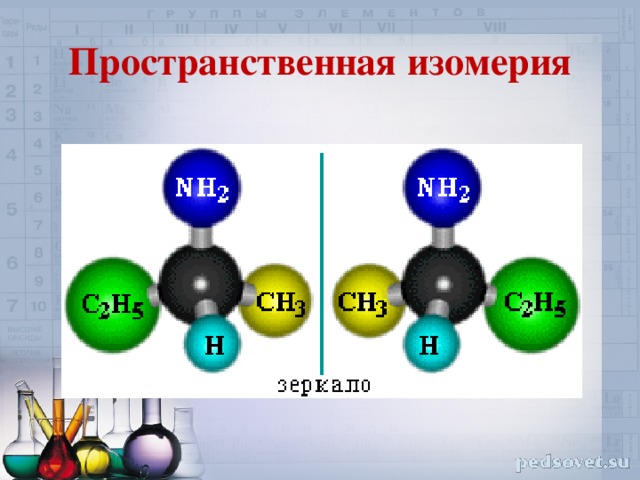
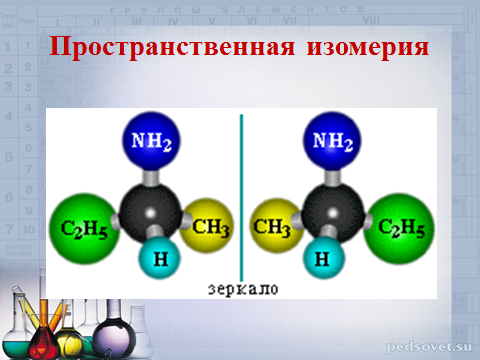
Пространственная изомерия

Получение
- Получение аминов из галогенопроизводных
В результате этой реакции образуется соль амина ( гидробромид этиламмония), из которой действием щёлочи можно выделить первичный амин ( этиламин):

- При взаимодействии полученного первичного амина и галогенопроизводного и последующей обработке щелочью получают вторичный амин ( диэтиламин):

- Повторение процедуры приводит к образованию третичного амина:

- Третичный амин может ещё раз вступить в реакцию с бромэтаном. При этом образуется четвертичная аммонийная соль, образованная бромид-ионом и катионом тетраэтиламмония:

Физические свойства
- Простейшие амины ( метиламин, диметиламин, триметиламин ) – газообразные вещества. Остальные низшие амины – жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
- Первичные и вторичные амины способны образовывать водородные связи. Это приводит к повышению их температуры.
- Анилин – маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184

Химические свойства
1. Амины как основания.
Атом азота аминогруппы за счет неподеленной пары электронов может образовывать ковалентную связь по донорно – акцепторному механизму, вступая в роли донора. В связи с этим амины способны присоединять катион водорода.
ИОН АММОНИЯ
ИОН ЭТИЛАММОНИЯ
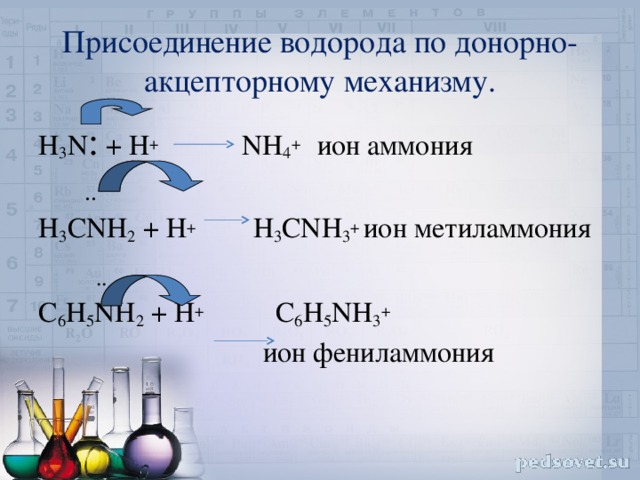
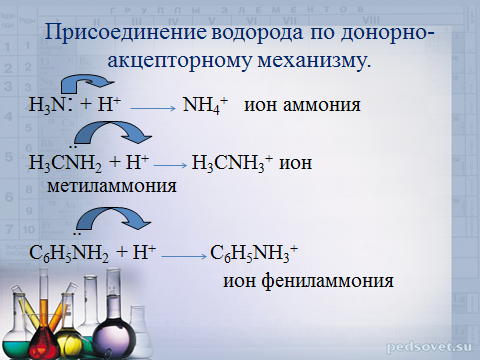
Присоединение водорода по донорно-акцепторному механизму.
H 3 N : + H + NH 4 + ион аммония
..
H 3 CNH 2 + H + H 3 CNH 3 + ион метиламмония
..
C 6 H 5 NH 2 + H + C 6 H 5 NH 3 +
ион фениламмония
![Основное свойство аминов (взаимодействие с кислотами) H 3 CNH 2 + HCl [CH 3 NH 3 ] + Cl - хлорид метиламмония C 6 H 5 NH 2 + HCl [C 6 H 5 NH 3 ] + Cl - хлорид фениламмония](https://fhd.multiurok.ru/a/0/6/a06e321f6bc8c277776501b86ddb4f34dc326ba6/img_phpzmr9Np_urok-aminy-anilin_0_15.jpg)
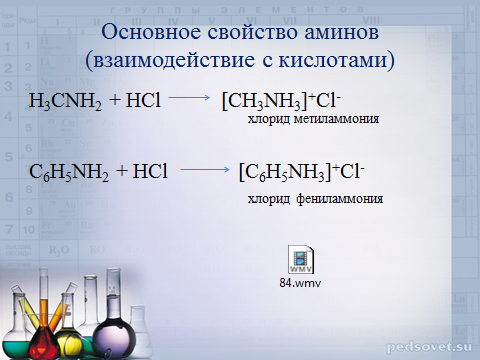
Основное свойство аминов (взаимодействие с кислотами)
H 3 CNH 2 + HCl [CH 3 NH 3 ] + Cl -
хлорид метиламмония
C 6 H 5 NH 2 + HCl [C 6 H 5 NH 3 ] + Cl -
хлорид фениламмония

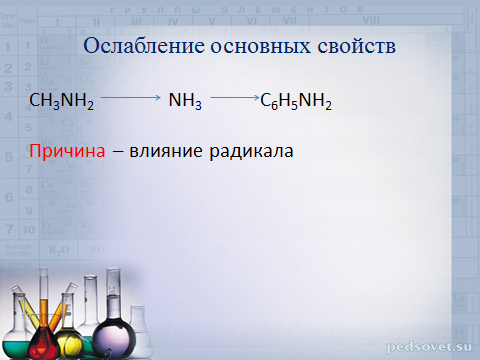
Ослабление основных свойств
CH 3 NH 2 NH 3 C 6 H 5 NH 2
Причина – влияние радикала

Амины горят.
На воздухе с образованием углекислого газа, воды и азота:

Амины вступают в реакцию нуклеофильного замещения.
Выступая в роли нуклеофилов:

Амины взаимодействую с производными карбоновых кислот,( сложными эфирами, хлорагидридами, ангидридами ).
Образуя Амиды – важнейший класс органических соединений:
Амид – является продуктом замещения гидроксильной группы на остаток амина.

Применение аминов
- Амины широко применяются для получения лекарств, полимерных материалов.
- Анилин – важнейшее соединение данного класса, которое используется для производства анилиновых красителей, лекарств (сульфаниламидных препаратов), полимерных материалов (анилиноформальдегидных смол).
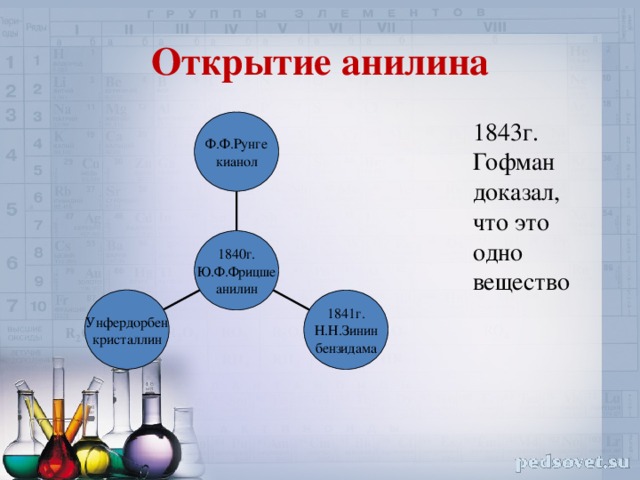
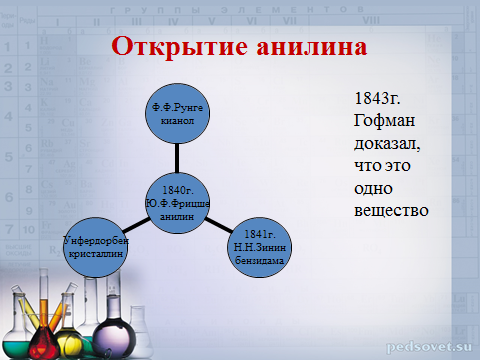
Открытие анилина
Ф.Ф.Рунге
кианол
1843г. Гофман доказал, что это одно вещество
1840г.
Ю.Ф.Фрицше
анилин
Унфердорбен
кристаллин
1841г.
Н.Н.Зинин
бензидама
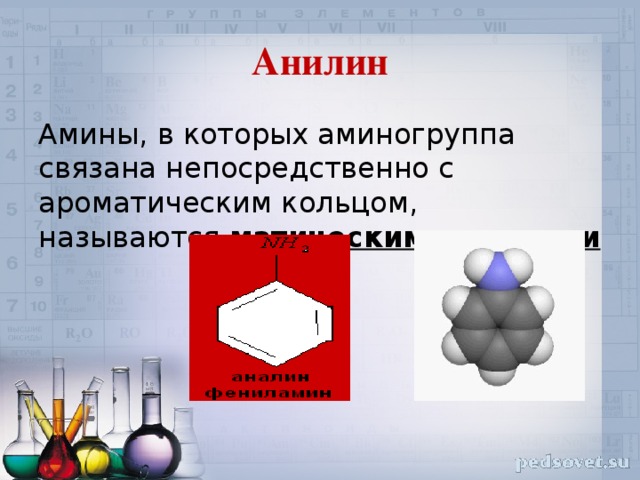
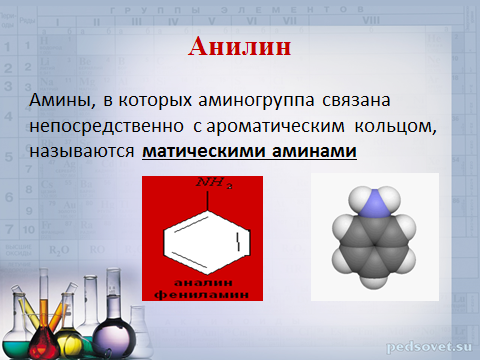
Анилин
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются матическими аминами

Получение анилина
Реакция Зинина
C 6 H 5 NO 2 + 6H C 6 H 5 NH 2 + 2H 2 O

Физические свойства
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.

Свойства анилина
1. Анилин - гораздо более слабое основание, чем алифатические амины (K b = 5,2 . 10 -10 ). Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо.
Анилин реагирует с сильными кислотами, образуя соли фениламмония C 6 H 5 NH 3 + , которые хорошо растворимы в воде, но нерастворимы в неполярных органических растворителях:
С 6 Н 5 NН 2 + HCl → С 6 Н 5 NН 3 Сl.

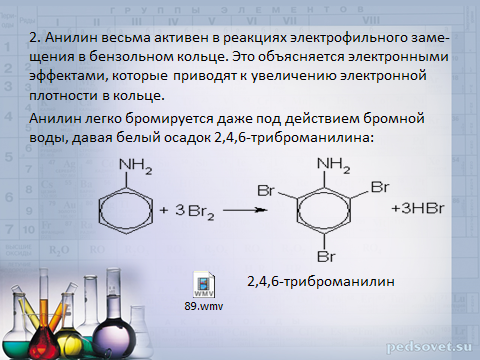
2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце.
Анилин легко бромируется даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина:
2,4,6-триброманилин
![3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C 6 H 5 N 2 + : C 6 H 5 NH 2 + NaNO 2 + 2HCl → [C 6 H 5 -N≡N] + Cl - + NaCl + 2H 2 O. 4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это — качественная реакция на анилин.](https://fhd.multiurok.ru/a/0/6/a06e321f6bc8c277776501b86ddb4f34dc326ba6/img_phpzmr9Np_urok-aminy-anilin_0_27.jpg)
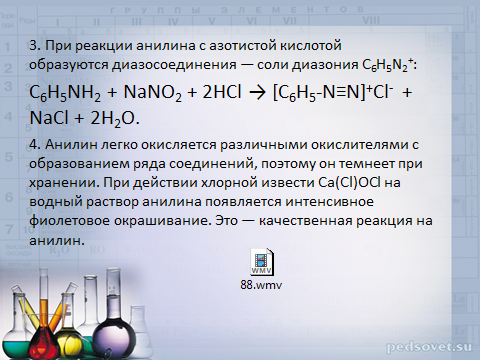
3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C 6 H 5 N 2 + :
C 6 H 5 NH 2 + NaNO 2 + 2HCl → [C 6 H 5 -N≡N] + Cl - + NaCl + 2H 2 O.
4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это — качественная реакция на анилин.

Применение анилина
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).

Закрепление знаний
I. С какими из перечисленных веществ реагируют амины предельного ряда:
- H 2 O ; 2. NaOH, 3. Cu(OH) 2 , 4. HCl, 5.H 2 SO 4 , 6.O 2
II. Какие виды изомерии у аминов?
- Углеродного скелета
- Положения заместителей
- Пол ож ения кратных связей

III. Этил амин можно получить:
- Хлорэтана; 2. Из пропена; 3. Из бутина.
IV. «Узнай своего»
1.NH 2 CH 3 2.CH 2 NH 2 COOH. 3.CH 3 NO 2 4.C 6 H 5 NH 5.CH 3 C 2 H 5 NH 2 6.CH 3 NHC 2 H 4 . 7.C 3 H 6 NH 2 COOH 8.C 6 H 5 NH 2 9.C 3 H 6 NH 2 COOH. 10. NH 2 CH 10 COOH
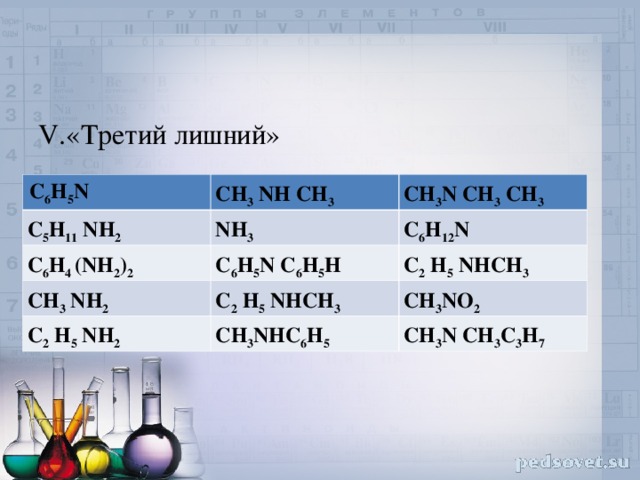
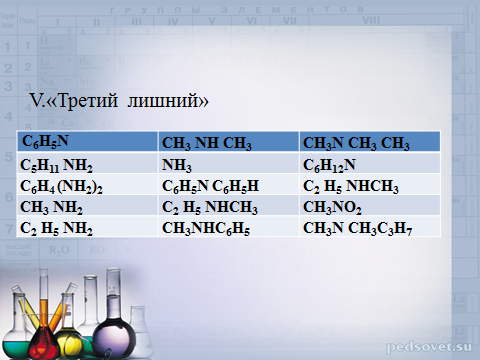
V.«Третий лишний»
С 6 Н 5 N
СН 3 N H СН 3
С 5 Н 11 N H 2
СН 3 N СН 3 СН 3
NH 3
С 6 Н 4 ( N H 2 ) 2
С 6 Н 5 N С 6 Н 5 H
С 6 Н 12 N
СН 3 N H 2
С 2 Н 5 N HCH 3
С 2 Н 5 N HCH 3
С 2 Н 5 N H 2
СН 3 N H С 6 Н 5
СН 3 N O 2
СН 3 N СН 3 C 3 H 7

Взаимопроверка ответов
- - 2,4
- -1,2
- -1
- -1,4,5,6,8,
V.
1-1, 2-2, 3-2, 4-3, 5-2

Домашнее задание
О.С. Габриелян, И.Г. Остроумов учебник «Химия» для учреждений НПО и СПО для профессий технического цикла стр.171 – 175.
Подготовить презентации по теме: «Применение аминокислот».
Найти видео материалы по применению аминокислот.

СПАСИБО ЗА ВНИМАНИЕ,
ДАЛЬНЕЙШИХ ВАМ УСПЕХОВ











































![Основное свойство аминов (взаимодействие с кислотами) H 3 CNH 2 + HCl [CH 3 NH 3 ] + Cl - хлорид метиламмония C 6 H 5 NH 2 + HCl [C 6 H 5 NH 3 ] + Cl - хлорид фениламмония](https://fhd.multiurok.ru/a/0/6/a06e321f6bc8c277776501b86ddb4f34dc326ba6/img_phpzmr9Np_urok-aminy-anilin_0_15.jpg)











![3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C 6 H 5 N 2 + : C 6 H 5 NH 2 + NaNO 2 + 2HCl → [C 6 H 5 -N≡N] + Cl - + NaCl + 2H 2 O. 4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это — качественная реакция на анилин.](https://fhd.multiurok.ru/a/0/6/a06e321f6bc8c277776501b86ddb4f34dc326ba6/img_phpzmr9Np_urok-aminy-anilin_0_27.jpg)

















