МБОУ «СОШ № 1 с.п. Надтеречное» Надтеречного Муниципального района
Урок химии в 8 классе.
ТЕМА: « Кислород. Физические и химические свойства».
Учитель химии Идрисова Хадишат Альхазуровна
Цель: Продолжить формирование понятий «химический элемент», «простое вещество», познакомить с физическими свойствами и распространением, открытием, кислорода и получением.
Научить правильно «собирать» кислород и доказывать его наличие.
Совершенствовать умения учащихся работать с лабораторным оборудованием, соблюдая правила техники безопасности при получении и сборе кислорода, развивать умения наблюдать, сравнивать, анализировать, делать выводы.
Воспитание умения оценивать результаты своего труда, положительного отношения к знаниям.
Оборудование: лабораторное оборудование и реактивы для получения кислорода, периодическая таблица, презентация.
(Урок изучения нового материала с элементами беседы и лабораторным опытом)
ХОД УРОКА:
ОРГАНИЗАЦИОННЫЙ МОМЕНТ: Приветствие учащихся, проверка готовности, настрой на восприятие материала урока.
АКТУАЛИЗАЦИЯ ЗНАНИЙ:
Фронтальный опрос по пройденным темам
РАБОТА ПО ТЕМЕ УРОКА: ( в тетради записываем тему урока)
ПЛАН РАБОТЫ записан на доске:
-Нахождение кислорода в природе
-Общая характеристика элемента кислорода
-Открытие кислорода
-Получение кислорода в лаборатории и в промышленности
- Физические и химические свойства кислорода.
- Применение
НАХОЖДЕНИЕ КИСЛОРОДА В ПРИРОДЕ.
Кислород самый распространённый химический элемент на нашей планете, его массовая доля составляет 49%. Он содержится в воде, углекислом газе, кремнезёме (формулы записывают на доске, читают), в органических веществах: белках, жирах, углеводах, нуклеиновых кислотах и многих других……….. Простое вещество кислород содержится в воздухе и составляет 21% от объёма воздуха. Он необходим для дыхания всем живым организмам, в то числе и нам с вами.
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА КИСЛОРОДА.
Переходим к работе с периодической таблицей. Учащиеся записывают химический знак кислорода, его порядковый номер, относительную атомную массу, молекулярную формулу, относительную молекулярную массу, валентность.
ОТКРЫТИЕ КИСЛОРОДА.
Официально открытие кислорода датируется 1 августа 1774 года. Английский химик Джозеф Пристли разлагал различные вещества путём обжига сфокусированными солнечными лучами. Ему удалось получить газ, в присутствии которого свеча горела ярким пламенем. 2 HgО = 2Hg + O2
Пристли удалось выявить индивидуальные признаки кислорода. Это в первую очередь характерные особенности горения в его присутствии, растворимость в воде, взаимодействие с оксидом азота.
Следует отметить, что независимо от Пристли кислород был описан шведским химиком Карлом Шееле, который назвал его «огненный воздух». Но по ряду причин, его исследования были опубликованы позже, чем работы Пристли. Поэтому приоритет открытия принадлежит Пристли.
Современное название кислороду дал Антуан Лавуазье, который показал, что кислород – основной функциональный компонент кислот. Поэтому он предложил название – «oxygene», что означает образующий кислоты. Отсюда произошло и русское название кислорода.
ПОЛУЧЕНИЕ КИСЛОРОДА.
В лаборатории кислород получают разложением сложных веществ.
-электролиз воды 2H2O = 2H2 +O2
-разложение пероксида водорода 2H2O2 = 2H2O+O2
Для протекания этой реакции необходимо присутствие МпО2. В ходе реакции вещество не расходуется, а лишь ускоряет химическую реакцию. Такие вещества называют катализаторами. Катализаторы широко применяются в химической промышленности. С их помощью удаётся повысить производительность химических процессов, снизить себестоимость выпускаемой продукции и более полно использовать сырьё. Кислород можно получить в лабораторных условиях разложением перманганата калия
2КМпО4 = К2МпО4 + МпО2 + О2
(учащиеся записывают в тетради уравнения реакций, самостоятельно расставляют коэффициенты, читают)
Проведение лабораторного эксперимента «Получение кислорода из перманганата калия».
Вспоминаем технику безопасности. Собираем полученный газ вытеснением воздуха или вытеснением воды, подтверждаем присутствие кислорода тлеющей лучиной, которая вспыхивает при внесении в кислород. Учащиеся описывают, полученный в результате лабораторного опыта, кислород. Наблюдения записывают в тетрадь.
В промышленности кислород получают из воздуха, который представляет собой смесь газов (азота и кислорода).
ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА.
-бесцветный газ, без вкуса и запаха.
-немного тяжелее воздуха
-малорастворимый в воде (в 100 объёмах воды при температуре 20 С растворяется 3,5 объёма кислорода, с понижением температуры растворимость кислорода в воде возрастает)
-tкипения = -183 С, tплавления = -218,8 С
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА.
Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и горение.
Горение – это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Сера горит в О2 ярким синим пламенем с образованием газа – оксида серы (IV):
S + O2 = SO2
Фосфор сгорает в О2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора (V)
4P + 5O2 = 2P2O5
Как мы видим, в большинстве случаев при взаимодействии веществ с О2 образуются оксиды.
Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА.
(Работаем по пунктам плана на доске, опора на записи в тетради)
1) Приведите примеры доказывающие, что кислород самое распространённый химический элемент на нашей планете.
2) 1моль воздуха весит 29 г /моль, рассчитайте во сколько раз кислород тяжелее воздуха.
3) Из чего можно получить кислород в лаборатории? (а в промышленности?)
4) Какие правила техники безопасности нужно помнить при обращении со спиртовкой?
5) Опишите полученный кислород по физическим признакам.
ДОМАШНЕЕ ЗАДАНИЕ: параграф 18-21 (готовимся опираясь на конспект) стр.59-60 вопросы 1-4, задача1
(выполняем письменно в тетради)
Карточка
Расшифруйте слова – основное предназначение кислорода. Ключ к разгадке, по порядковый номер элемента.
О2



31, 8, 45, 63, 28, 53, 63 53 105, Ы, 108, 13, 28, 53, 63
Лабораторная работа
«Получение и свойства кислорода»
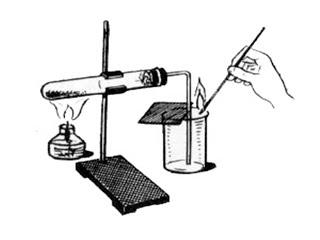
Оборудование:
штатив лабораторный с лапкой;
пробирка с газоотводной трубкой;
колба;
спиртовка (или сухое топливо)
спички;
лучинка.
Вещество: перманганат калия (КМnO4)
Меры предосторожности
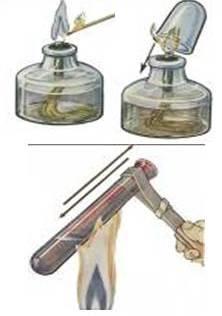
Работа с нагревательными приборами:
Спиртовка:
не переносите горящую спиртовку с места на место
гасите спиртовку только с помощью колпачка
при нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки.
дно пробирки должно находиться в верхней части пламени и не должно касаться фитиля.
Работа со стеклом:
Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке.
Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть.
Ход работы
В пробирку насыпьте примерно 1\4 ее объема перманганата калия, вложите внутрь пробирки вблизи отверстия рыхлый тампон ваты.
Закройте пробирку плотно пробкой , в которую вставлена газоотводная трубка.
После этого укрепите пробирку в лапке штатива так, чтобы газоотводная трубка была направлена вниз. Конец газоотводной трубки должен доходить почти до самого дна для обирания кислорода.
Зажгите спиртовку и начните прогревать пробирку.
Нагрейте перманганат калия
Выделяющийся при разложении перманганата калия кислород постепенно заполняет пробирку и газоотводную трубку и по мере накопления он начинает вытеснять воздух из стакана.
Подожгите лучинку, дождитесь появления на конце красного уголька и тут же гасите.
Поднесите тлеющую лучинку к краю стакана. Если лучинка вспыхнет, прекратите нагревание перманганата калия.
Реакция : 2KMnO4 = K2MnO4 + MnO2 + O2
Оформите работу по плану :
Название опыта
Что делаю
Что наблюдаю
Уравнение реакции
Вывод






















