Дата:
Класс: 9
Учитель:
Предмет: Химия
Тема: «Химические реакции, лежащие в основе промышленного способа получения серной кислоты. Химическое загрязнение окружающей среды соединениями серы».
Контролируемые элементы содержания
Химические свойства неметаллов: водорода,кислорода, галогенов, серы, азота, фосфора, углерода, кремния.
Проведение расчётов на основе формул и уравнений реакций
Контролируемые умения
Формирование первоначальных систематизированных представлений о веществах, их превращениях и практическом применении.
Проверяемые элементы содержания
Химические реакции, лежащие в основе промышленного способа получения серной кислоты. Нахождение серы и её соединений в природе.
Применение серы и её соединений в быту и промышленности
Вычисления по уравнениям химических реакций; массовой доли выхода продукта реакции
Предметные умения
Искать и анализировать информацию о свойствах веществ, имеющих важное промышленное значение, и химических реакциях, лежащих в основе промышленных способов получения веществ, в целях определения рациональных подходов к использованию природных ресурсов
Производить вычисления по химическим уравнениям
Личностные результаты
Ориентация в деятельности на современную систему научных представлений об основных закономерностях развития человека, природы и общества, взаимосвязях человека с природной и социальной средой
Функциональная грамотность
Объяснить потенциальные применения естественнонаучного знания для общества
Вспомнить и применить соответствующие естественнонаучные знания
Тип урока: Комбинированный урок
Библиотека ЦОК: https://m.edsoo.ru/00adec8a
БЛОЧНО-МОДУЛЬНОЕ ОПИСАНИЕ УРОКА:
Вхождение в тему урока и создание условий для осознанного восприятия нового материала
Мотивация на учебную деятельность
Проверяет готовность к уроку.
Организация учащихся на усвоение новых знаний.
Актуализация опорных знаний
Проверка домашнего задания.
Фронтальная работа с классом: Показывает карточки с формулами.
Целеполагание
1.Вспомните, какие физические свойства характерны для серной кислоты.
2.Вспомните, какие химические свойства характерны для раствора серной кислоты.
3.Назовите области применения серной кислоты.
4.Почему серную кислоту называют «хлебом промышленности»? (Вывод. Ни одна отрасль промышленности практически не может обойтись без серной кислоты, особенно широко серная кислота применяется в химической промышленности, поэтому ее часто справедливо называют «хлебом» химии или «хлебом промышленности».)
Освоение нового материала
Осуществление учебных действий по освоению нового материала
С ерная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная. Серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O 1 — раствор SO3 в серной кислоте (олеум).
ерная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная. Серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O 1 — раствор SO3 в серной кислоте (олеум).
Потребность в H2SO4 велика. В природе она не встречается .Скажите ребята, какие ранее изученные вещества могут быть использованы в качестве сырья, для получения серной кислоты.

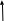
 Железный колчедан FeS2 Сера S Сульфиды
Железный колчедан FeS2 Сера S Сульфиды
цветных металлов
Сырьё CuS, ZnS, PbS


Гипс CaSO4*2H2O Сероводород H2S
Рассмотрим подробно реакции , лежащие в основе получения серной кислоты , которые протекают в 3 стадии.
(учащиеся записывают реакции в тетрадь)
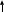
4FeS2 + 11O2 = 8S02 + 2F2O3
Уравнять методом электролитного баланса .Проверяем у доски.

2SO2 + O2 2SO3 + Q

Дать характеристику этой реакции. Какие условия необходимы определить для смещения химического равновесия.
Учащиеся:
Реакция обратимая, экзотермическая , идущая с уменьшением ρ .Согласно принципа Ле – Шателье при уменьшении t и повышении ρ равновесие смещается в сторону экзотермической реакции, т. е. в сторону получения ангидрида.
Учитель:
Правильно!
SO3 + H2O = H2SO4 + Q
Олеум
Вопрос! Почему для поглощения SO3 нельзя использовать H2O ?
ОТВЕТ:
Оксид серы(IV) до соприкосновения с водой реагирует с её парами, образуются мелкие капельки серной кислоты - сернокислый туман , который водой не поглощается. Оксид серы поглощается концентрированной серной кислотой, реагирует с содержащейся в ней водой и образуется олеум , т. е. 98% серная кислота.
Производство серной кислоты небезопасно!!!!Поэтому необходимо проводить мероприятия по охране окружающей среды.
Охране окружающей среды в нашей стране уделяется большое внимание. На сернокислых заводах предотвратить загрязнение окружающей среды удаётся путём:
Установление герметичной аппаратуры
Применение газоочистительных установок.
Процесс проходит на специальных катализаторах, обычно из ванадия.
2.2. Проверка первичного усвоения
Применение изученного материала.
Применение знаний, в том числе в новых ситуациях
Выполнить задание: Серную кислоту можно получить из следующих исходных продуктов а)сульфида цинка; б) сероводорода; в)сульфида сурьмы Sb2S3. Составьте соответствующие уравнения реакций.
ОТВЕТ: А) 2ZnS + 3O 2= 2ZnO + 2SO 2
SO 2+ O 2 = SO3
Растворяя полученный оксид в воде получим серную кислоту: SO 3+ H 2 O = H 2 SO 4.
Б,В решить самостоятельно.
Выполнение заданий в форме ГИА (ОГЭ, ЕГЭ)

С
истематизация знаний и умений





Проверка приобретенных знаний, умений и навыков
4.1 Диагностика/самодиагностика
Проверь себя


П
одведение итогов, домашнее задание
Рефлексия

Домашнее задание.
Информация по теме : «Химическое загрязнение окружающей среды соединениями серы»






 ерная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная. Серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O 1 — раствор SO3 в серной кислоте (олеум).
ерная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная. Серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O 1 — раствор SO3 в серной кислоте (олеум).
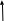
 Железный колчедан FeS2 Сера S Сульфиды
Железный колчедан FeS2 Сера S Сульфиды