Практическая работа №1.
Изучение влияния условий проведения химической реакции на ее скорость
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Опыт 1.
Зависимость скорости реакции от природы реагирующих веществ
1. В одну пробирку налить раствор соляной кислоты, а в другую – столько же уксусной (примерно одинаковой концентрации).
2. Одновременно поместить в них по грануле цинка.
3. Описать и объяснить происходящее в обеих пробирках с помощью уравнений реакций
4. Чем можно объяснить, что в пробирке с уксусной кислотой водород выделяется с меньшей скоростью?
5.В две пробирки налить одинаковое количество соляной кислоты и одновременно поместить в них по кусочку металлов: цинка и магния.
6.Почему реакция соляной кислоты с магнием протекает с большей скоростью?
Опыт 2.
Зависимость скорости реакции от площади поверхности соприкосновения реагирующих веществ
1.В две пробирки налить примерно по 2 мл раствора медного купороса CuSO4.
2. Одновременно поместить в одну пробирку кусок железной проволоки, а в другую – железный порошок.
3. В обеих пробирках протекает реакция замещения. Записать уравнение.
4. В какой пробирке признаки реакции появились быстрее? Почему? Как измельчение вещества влияет на скорость реакции?
Опыт 3.
Зависимость скорости реакции от концентрации исходных веществ
1. В две пробирки поместить по 2 гранулы цинка и осторожно прилить растворы уксусной кислоты: в первую пробирку – 9%-ный уксус, а во вторую – 70%-ную кислоту.
2. В какой пробирке признаки реакции появились быстрее? Почему? Как концентрация уксусной кислоты.
влияет на скорость реакции?
Опыт 4.
Зависимость скорости реакции от температуры
1.В две пробирки с соляной кислотой одинаковой концентрации добавить по 1 грануле цинка.
2. Одну из пробирок поместить в стакан с горячей водой.
3. Наблюдайте, что происходит (изменяется) при нагревании? Увеличивается ли скорость выделения водорода?
4. Как зависит скорость реакции от температуры, при которой она проводится?
Опыт 5.
Зависимость скорости реакции от участия катализатора
1. На дно стакана налить 3%-ный раствор перекиси водорода. Пероксид водорода – очень непрочное вещество и легко разлагается на воду и кислород. Записать уравнения данной реакции.
2. Наблюдаются ли признаки реакции (т. е. выделения пузырьков газа) при обычных условиях?
3. Добавить в стакан с перекисью водорода немного черного порошка оксида марганца (IV) MnO2
Что наблюдается?
4. Внести в стакан тлеющую лучинку? Что происходит? Сделать вывод о природе выделяющегося газа. Назвать его.
5. Почему при внесении в стакан оксида марганца скорость реакции увеличилась?
Отчёт о проделанной работе оформите в произвольной форме
ВЫВОД:
Практическая работа № 2.
Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Задание 1.
1. Налить в пробирку 1 мл соляной кислоты и опустить гранулу цинка.
2. Описать наблюдения.
3. Составить уравнение реакции в молекулярном, ионном и сокращенном ионном виде, показать переход электронов и указать окислитель.
Задание 2.
1. Последовательно осуществить реакции для карбоната натрия:
Na2CO3 →BaCO3↓
Na2CO3 → CO2↑
2. Последовательно осуществите реакции для соляной кислоты:
HCl + NaOH =
HCl + CaCO3 =
Описать и объяснить наблюдения
Задание 3.
Осуществить реакции, соответствующие сокращенным ионным уравнениям:
Cu2+ + 2OH- = Cu(OH)2↓
Fe3+ + 3OH- = Fe(OH)3↓
Задание 4.
1. Используя следующие реактивы, получить посредством реакции обмена газообразное вещество: хлорид натрия, соляная кислота, оксид магния, карбонат кальция.
2. Написать уравнения реакций в молекулярном, полном и сокращенном ионном виде. Указать условия их протекания.
Задание 5.
1. Используя следующие реактивы, провести реакцию нейтрализации в присутствии фенолфталеина: хлорид натрия, серная кислота, гидроксид натрия, карбонат кальция.
2. Написать уравнение реакции в молекулярном, полном и сокращенном ионном виде.
Отчёт о проделанной работе оформите в произвольной форме
ВЫВОД:
Практическая работа № 3.
Получение соляной кислоты и изучение ее свойств
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Опыт 1.
Получение соляной кислоты
1. В пробирку насыпьте 2—3 г хлорида натрия и прилить столько концентрированной серной кислоты (2:1), чтобы она смочила всю соль.
2. Закрыть пробирку пробкой с газоотводной трубкой. Конец трубки опустить в другую пробирку с водой так, чтобы он был примерно на расстоянии 0,5—1 см от поверхности воды.
3 . Смесь в первой пробирке осторожно нагреть в течение 5—6 мин (следить, чтобы кислоту не перебросило в пробирку с водой!).
. Смесь в первой пробирке осторожно нагреть в течение 5—6 мин (следить, чтобы кислоту не перебросило в пробирку с водой!).
4. Написать уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях и при сильном нагревании.
5. Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Опыт 2.
Изучение свойств соляной кислоты
1. Полученную соляную кислоту разлить поровну в шесть пробирок.
а) В первую пробирку опустить лакмусовую бумажку.
б) Во вторую пробирку положить кусочек цинка или магниевые стружки, а в третью — кусочек меди.
в) В четвертую пробирку внести немного оксида меди (II) и нагреть раствор.
г) В пятую пробирку поместить немного свежеприготовленного гидроксида меди(II), в шестую — немного мела или другого карбоната.
Ответить на вопросы и выполнить задания:
1. Со всеми ли металлами реагирует соляная кислота? Составить уравнения реакций, протекающих между соляной кислотой и указанными металлами.
2. Как объяснить образование в четвертой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? Составить уравнения соответствующих реакций.
Опыт 3.
Проведение реакции по распознаванию соляной кислоты и ее солей.
1. В одну пробирку налить 1—2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция.
2. Во все пробирки добавить по нескольку капель раствора нитрата серебра(I).
3. Проверить, растворяется ли выпавший осадок в концентрированной азотной кислоте.
4. Написать уравнения проведенных реакций и указать, как можно отличить: а) соляную кислоту от других кислот, б) хлориды от других солей, в) растворы хлоридов от соляной кислоты.
5. Почему вместо раствора нитрата серебра( I) можно также использовать раствор нитрата свинца (ІІ)?
Отчёт о проделанной работе оформите в произвольной форме
ВЫВОД:
Практическая работа № 4.
Решение экспериментальных задач по теме «Кислород и сера»
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Задание 1
1. Опытным путем с помощью качественных реакций определить, в какой пробирке находится каждое из указанных веществ: серная кислота, сульфат натрия, хлорид бария.
2. Составить уравнения реакций в молекулярном, ионном и сокращенном ионном виде.
3. Результаты выполнения задачи оформить в виде таблицы:
| № | Что делали | Что наблюдали | Выводы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задание 2
1. Провести эксперимент, осуществив цепочку превращений:
Оксид меди CuO→ Сульфат меди CuSO4→ хлорид меди CuCl2.
2. Составить уравнения реакций в молекулярном, ионном и сокращенном ионном виде.
3. Результаты выполнения задачи оформить в виде таблицы:
| № | Уравнение реакции | Признак протекания реакции |
|
|
|
|
|
|
|
|
ВЫВОД:
Практическая работа №5
Получение аммиака и исследование его свойств.
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Задание 1
Получение аммиака и растворение его в воде
1. Собрать прибор, как показано на рисунке.

2. Нагреть смесь в пробирке. Как только почувствуете запах аммиака, закрыть пробирку большим пальцем и опустить в кристаллизатор с водой, осторожно отпуская палец.
3. Проверить получившийся раствор фенолфталеином.
4. Зарисовать прибор для получения аммиака.
5. Составить химические уравнения:
1) получения аммиака
2) растворение его в воде
Задание 2
Исследование водного раствора аммиака.
1. Разделить образовавшийся раствор аммиака на три пробирки.
2. Первую пробирку нагреть до разложения водного раствора. Какой признак позволяет определить, что реакция протекает?
3. Во вторую пробирку добавить небольшое количество соляной кислоты. Что наблюдаете?
4. В третью пробирку прилить небольшое количество раствора хлорида алюминия. Записать наблюдения.
Составить уравнения проделанных реакций в молекулярном, ионном и сокращённом ионном виде.
5.Какими свойствами обладает аммиак?
Отчёт о проделанной работе оформите в произвольной форме
ВЫВОД:
Практическая работа № 6.
Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Задание 1
Получение оксида углерода (IV) и изучение его свойств.
1. Добавить немного соляной кислоты к кусочку мела, находящемуся в пробирке и быстро закрыть газоотводной трубкой, конец которой поместить в пробирку с известковой водой.
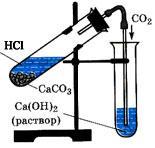
2. Составить уравнение реакции взаимодействия углекислого газа с известковой водой.
Как изменяется известковая вода?
3. Газоотводную трубку поместить в раствор щёлочи, подкрашенный фенолфталеином.
Составить уравнение происходящей реакции. Как изменилась окраска фенолфталеина и почему?
4. Газоотводную трубку поместить в воду, подкрашенную лакмусом. Составить химическое уравнение растворения углекислого газа в воде. Как меняется окраска лакмуса и почему?
Задание 2
Распознавание карбонатов.
В трёх пробирках находятся вещества: карбонат натрия, сульфат натрия и хлорид натрия.
1. Определить, какое вещество находится в каждой пробирке.
2. Составить уравнения реакций в молекулярном, ионном и сокращённом ионном виде.
Отчёт о проделанной работе оформите в виде таблицы
| Что делали (название реагента) | Что наблюдали | Выводы |
| Пробирка №1 | Пробирка №2 | Пробирка №3 | Пробирка №1 | Пробирка №2 | Пробирка №3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Какими свойствами обладает углекислый газ?
ВЫВОД:
Практическая работа №7 Решение экспериментальных задач по теме «Металлы»
Цель работы:
Оборудование и реактивы:
Инструктаж по ТБ:
ХОД РАБОТЫ
Задание 1
В математике действует правило – «от перемены мест слагаемых сумма не изменяется». Справедливо ли оно в химии?
1. Проверить это на примере реакции взаимодействия хлорида алюминия с гидроксидом натрия.
2. Записать уравнение проделанной реакции в молекулярном, ионном и сокращённом ионном виде
Задание 2
1. Провести реакции, подтверждающие качественный состав хлорида меди (II), находящегося в пробирке, предварительно растворив его в воде.
2. Записать уравнения проделанных реакции в молекулярном, ионном и сокращённом ионном виде, указав цвет осадков.
Задание 3
1. Получить сульфат железа (II) двумя способами:
1) из железного гвоздя
2)из хлорида железа (II), растворив его в воде.
2. Записать уравнения проделанных реакции в молекулярном, ионном и сокращённом ионном виде, указав цвет осадков.
Задание 4
1. Провести реакции, подтверждающие качественный состав сульфата железа (II).
2. Записать уравнения проделанных реакции в молекулярном, ионном и сокращённом ионном виде, указав цвет осадков.
Отчёт о проделанной работе оформите в произвольной форме
ВЫВОД:







 . Смесь в первой пробирке осторожно нагреть в течение 5—6 мин (следить, чтобы кислоту не перебросило в пробирку с водой!).
. Смесь в первой пробирке осторожно нагреть в течение 5—6 мин (следить, чтобы кислоту не перебросило в пробирку с водой!).











