

Подумай и ответь на следующие вопросы:
- Какие степени окисления проявляет азот в соединениях с кислородом?
- Запишите формулы возможных оксидов азота.
Задание . Проверьте правильность ответов, используя слайд презентации.
Зафиксируйте в тетради новую для себя информацию.

Оксиды азота
Азот образует шесть кислородных соединений.
степени окисления + 1 N 2 O
+ 2 NO
+ 3 N 2 O 3
+ 4 NO 2 , N 2 O 4
+ 5 N 2 O 5

Оксиды азота
+ 1 N 2 O
+ 2 NO
+ 3 N 2 O 3
+ 4 NO 2
+ 5 N 2 O 5
Несолеобразующие оксиды
Солеобразующие оксиды

N 2 O
оксид азота (I), закись азота или «веселящий
газ», возбуждающе действует на нервную
систему человека, используют в медицине как
анестезирующее средство.
Физические свойства: Бесцветный газ со слабым запахом и
сладковатым вкусом, растворим в воде.
Получение: NH 4 NO 3 = N 2 O +2H 2 O
несолеобразующий
Химические свойства:
1. разложение при нагревании
2N 2 +1 O = 2N 2 0 +O 2
2. с водородом
(проявляет окислительные свойства)
N 2 +1 O +H 2 = N 2 0 +H 2 O

NO
Бесцветный газ, без запаха. Малорастворим в воде. Быстро окисляется на воздухе. Ядовит!
Получение:
N 2 + O 2 2NO
1. В природе:
4NH 3 + 5O 2 = 4NO +6H 2 O
2. В промышленности:
несолеобразующий
Химические свойства:
2N +2 O + O 2 = 2N +4 O 2
1. Легко окисляется:
2N +2 O + 2SO 2 = 2SO 3 +N 2 0
2. окислитель:

N 2 O 3
жидкость темно-синего цвета хорошо растворимая в воде , термически неустойчивая, t кип.= 3,5 0С,
т. е. существует в жидком состоянии только при охлаждении, в обычных условиях переходит в газообразное состояние.
NO 2 + NO N 2 O 3
Получение :
кислотный оксид
Химические свойства:
ВСЕ свойства кислотных оксидов.

NO 2
Газ бурого цвета, со специфическим
запахом. Хорошо растворим в воде. Ядовит!
2NO + O 2 = 2NO 2
Получение:
Cu + 4HNO 3(к) = Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O
Химические свойства:
Оксид азота (IV) NO 2 является смешанным оксидом. При взаимодействии его с водой, образуются две кислоты .
2NO 2 + H 2 O = HNO 2 + HNO 3
При взаимодействии NO 2 с водой в присутствии кислорода образуется только азотная кислота.
4NO 2 + 2H 2 O + О 2 = 4HNO 3
При растворении оксида в щелочи, образуются две соли.
2NO 2 + 2NaOH = NaNO 2 + NaNO 3 + H 2 O
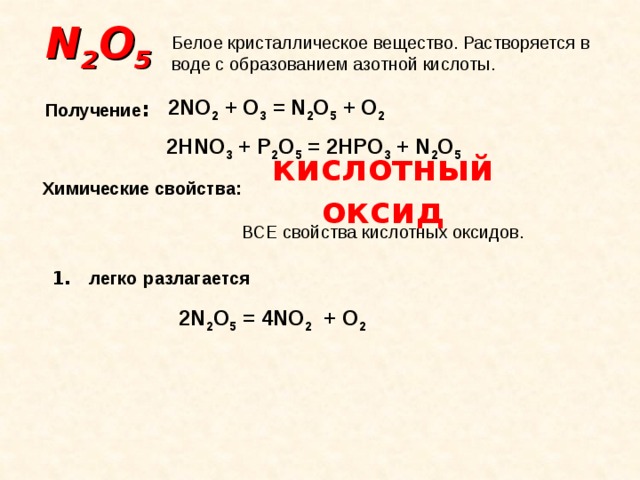
N 2 O 5
Белое кристаллическое вещество. Растворяется в воде с образованием азотной кислоты.
2NO 2 + O 3 = N 2 O 5 + O 2
Получение :
2HNO 3 + P 2 O 5 = 2HPO 3 + N 2 O 5
кислотный оксид
Химические свойства:
ВСЕ свойства кислотных оксидов.
1. легко разлагается
2N 2 O 5 = 4NO 2 + O 2
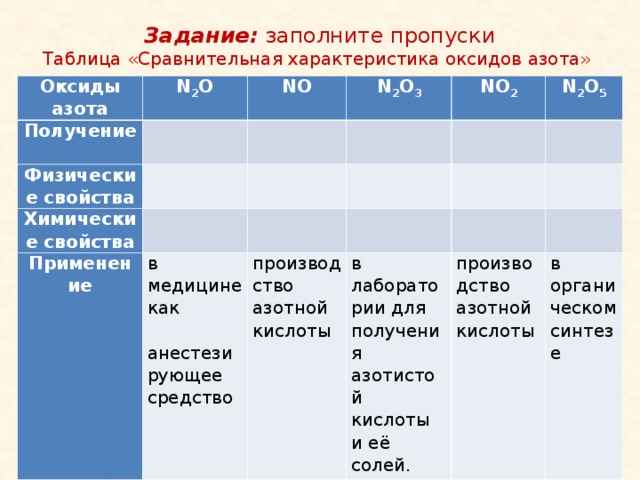
Задание: заполните пропуски
Таблица «Сравнительная характеристика оксидов азота»
Оксиды азота
Получение
N 2 O
NO
Физические свойства
Химические свойства
N 2 O 3
NO 2
Применение
N 2 O 5
в медицине как анестезирующее средство
производство
азотной кислоты
в лаборатории для получения азотистой кислоты и её солей.
производство
азотной кислоты
в органическом синтезе

HNO 3
Классификация по:
наличию кислорода:
кислородсодержащая
основности:
одноосновная
растворимости в воде:
растворимая
летучести:
летучая
степени электролитической диссоциации:
сильная

HNO 3
Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде. Температура плавления −41,59 °C, кипения +82,6 °C с частичным разложением. Азотная кислота ядовита.
При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
4HNO 3 = 4NO 2 + O 2 + 2H 2 O
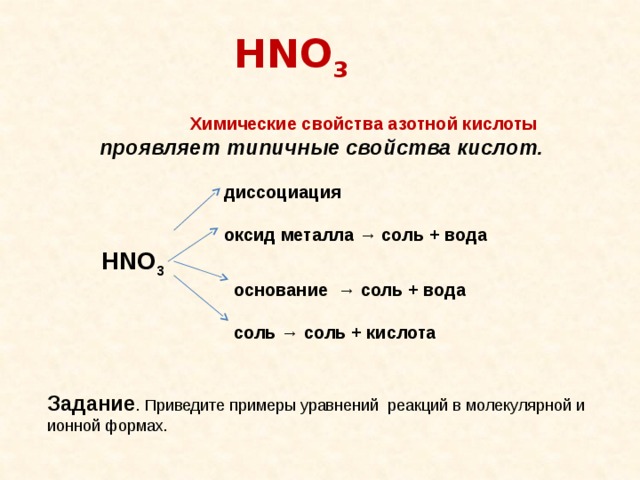
HNO 3
Химические свойства азотной кислоты проявляет типичные свойства кислот.
диссоциация
оксид металла → соль + вода
HNO 3
основание → соль + вода
соль → соль + кислота
Задание . Приведите примеры уравнений реакций в молекулярной и
ионной формах.

Домашнее задание:
1. Заполните таблицу в тетради.
2. Задание . Приведите примеры уравнений реакций , характеризующие общие кислотные свойства азотной кислоты, в молекулярной и ионной формах.































