Просмотр содержимого документа
«Презентация "Химические реакции в водных растворах" 9 класс"»

02.11.20
ХИМИЧЕСКИЕ РЕАКЦИИ В ВОДНЫХ РАСТВОРАХ
ТЕМА 2

02.11.20
Урок №7
9 класс
Сущность процесса электролитической диссоциации
Чернецова Н.И., Учитель химии 2019г.

Цель
- Сформировать понятие о процессе электролитической диссоциации;
- формировать знания об электролитах и неэлектролитах;

Планируемые результаты
- Знать понятия: «электролиты», «неэлектролиты», «катион», «анион», «электролитическая диссоциация»; гидратация, кристаллогидраты, кристаллизационная вода.
- Уметь: составлять реакции характеризующие свойства веществ
- Понимать: взаимосвязь строения и свойства веществ.

Вариант 1
1. N 2 ( г) +3 H 2 (г) 2NH 3 (г) + Q
Вариант 2
1. H 2 ( г ) + S ( тв) Н 2 S ( г ) + Q
2. C тв + 2 Н 2(г) СН 4 (г) + Q
3. N 2 O 4 ( г ) 2 NO 2 - Q
2. 2 NO ( г ) + С l 2 2 NOCl + Q
3. PCl 3( г) + С l 2 PCl 5 ( тв) + Q
- 1. Куда сместится равновесие при понижении температуры.
- 2. При повышении давления.
- 3. При повышении температуры.
- 4. При использовании катализатора.
- 5. При повышении концентрации продукта реакции.

Актуализация знаний
- Природа электрического тока и строение вещества.
- Что такое электрический ток?
- - (упорядоченное движение носителей электрических зарядов).
- Металлы проводят электрический ток?
- К акие частицы являются переносчиками тока в металлах?
- - (в металлах переносчиками электрического тока являются электроны.
- Металлы — это проводники первого рода.

Оказавается…
- что электрический ток могут переносить не только электроны, но и любые заряженные частицы (ионы).
- Повторим…..
- Объясните, чем отличается ион от нейтрального атома?
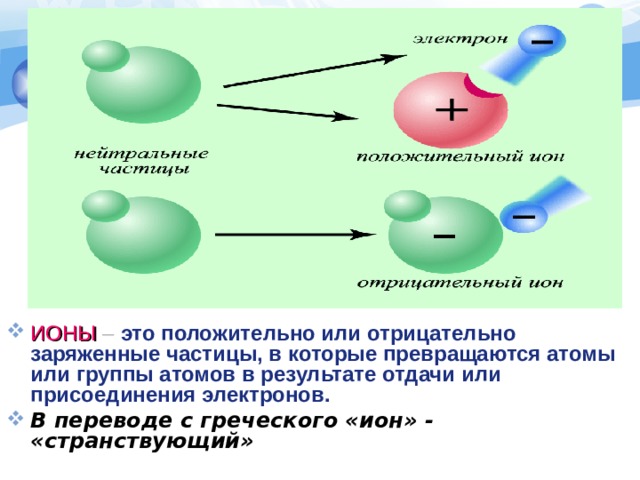
- ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в результате отдачи или присоединения электронов.
- В переводе с греческого «ион» - «странствующий»

ЭЛЕКТРОННЫЕ ФОРМУЛЫ
+ 11 Na 0 2 ē 8ē 1ē +11 Na + 2 ē 8ē
атом - 1е ион
+17 Cl 0 2 ē 8ē 7ē +17 Cl - 2 ē 8ē 8ē
атом + 1е ион

ИОНЫ (по составу и знаку)
Например:
- PO 3- 4
- NO 3 -
- SO 4 2-
- С O 2 3 -
Например:
- Н +
- Cl -
- K +
- Na + ;
- Fe 2 + ;

Опыт 1. (рис.3 стр. 20)
- Опыты по проверке электропроводности веществ с ионной и со слабополярной связью:
- Сахар (кристаллический и раствор)
- хлорида натрия (кристаллического),
- дистиллированной воды;
- водного раствора хлорида натрия.

- Электропроводность раствора можно установить с помощью прибора, изображенного на рисунке.
- Два металлических или угольных электрода помещают в раствор и соединяют с источником тока.
- Если раствор проводит электрический ток, то цепь замыкается, о чем свидетельствует показание вольтметра в цепи или загорание лампочки.
- Схема прибора для определения электропроводности раствора: 1 - источник тока; 2 - гальванометр или лампочка; 3 - электроды; 4 - исследуемый раствор

- При погружении электродов в дистиллированную воду лампочка не загорается.
- Чистая вода не проводит электрический ток.
Дистиллированная вода

- Не проводит ток и сухая поваренная соль NaCl , если в нее погрузить электроды.
Сухая соль NaCl

- Механизм диссоциации веществ с ионной связью
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
Cl -
Na+
Na+
+ -
Cl -
Cl -
Na+
+ -
+ -
Na+
Cl -
Na+
Cl -
Cl -
Na+
Na+
Cl -
Na+
Na+
+ -
Cl -
Cl -
- Ориентация молекул- диполей воды около ионов кристалла
- Гидратация ионов поверхностного слоя кристалла
- Диссоциация кристалла
NaCl → Na + + Cl -
Рис.4 (а), стр.21

- Сущность процесса электролитической диссоциации веществ с ковалентной полярной связью
- ориентация молекул воды вокруг полюсов молекулы электролита
- гидратация (взаимодействие) молекул воды с молекулами электролита
- ионизация молекул электролита (превращение ковалентной полярной связи в ионную)
- диссоциация (распад) молекул электролита на гидратированные ионы

+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
- Механизм диссоциации веществ с ковалентной сильнополярной связью
+
+ δ
+
− δ
+
−
- Ориентация молекул- диполей воды вокруг полюсов молекулы-диполя электролита
- Гидратация молекул воды с молекулами электролита
- Ионизация молекул электролита (КПС → ИС)
- Диссоциация молекул электролита
HCl → H + + Cl -
Рис.4 (б),стр. 21

- Причины распада веществ на ионы в расплавах
- Нагревание усиливает колебания ионов в узлах кристаллической решётки - кристаллическая решётка разрушается.

Фарадей Майкл
22. IX. 1791 – 25. VIII. 1867
Английский физик и химик.
В первой половине 19 в. ввел понятие
об электролитах и неэлектролитах.
Вещества, водные растворы или расплавы которых не проводят электрический ток
Вещества, водные растворы или расплавы которых проводят электрических то к
Учебник, стр.22, схема 1. разобрать

- не проводят эл. ток в растворах и расплавах
- Тип химической связи
- ковалентная неполярная и слабополярная
- К ним относятся вещества:
- простые вещества (неметаллы)
- оксиды неметаллов
- органические вещества
- проводят эл.ток в растворах и расплавах
- Тип химической связи:
- ионная, ковалентная сильнополярная
- К ним относятся вещества:
- соли
- кислоты
- основания

Химический словарь
- Процесс распада электролита на ионы при растворении его в воде или расплавлении называют электролитической диссоциацией.
- А + Б - → А + + Б -
молекула → ионы

История открытия теории электролитической диссоциации
- В 1887 году шведский химик Сванте Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
- В дальнейшем эта теория была
развита многими учёными.
- И сформулировал основные положения теории электролитической диссоциации
Сванте Аррениус

- Электролиты и неэлектролиты
- Сванте Аррениус (1877г) объяснил,что
- Причина электропроводности растворов - наличие в растворе ионов, которые образуются при растворении электролита в воде
- А + Б - + Н 2 О → А + + Б -
молекула → гидратированные ионы
- HCl → H + + Cl -
- NaCl → Na + + Cl -

- Электролиты- вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов обладающие положительным (катионы) или отрицательным (анионы) зарядом.
электролиты диссоциируют
- NaCl = Na + + Cl -
- Н Cl = Н + + Cl -
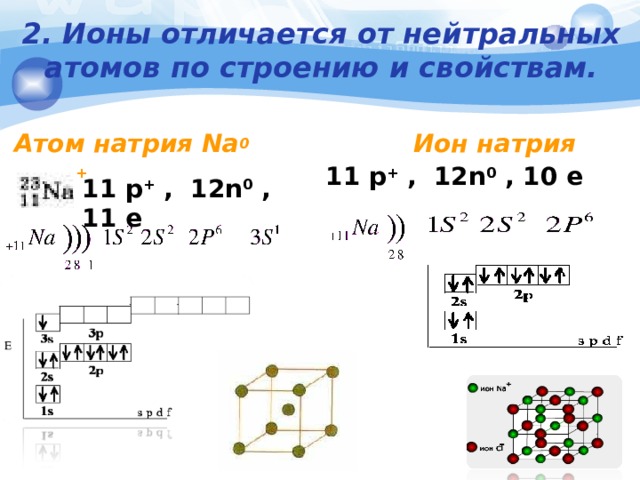
2. Ионы отличается от нейтральных атомов по строению и свойствам.
Атом натрия Na 0 Ион натрия Na +
11 p + , 12n 0 , 10 e
11 p + , 12n 0 , 11 e

─ ─ ─ 2е,8е,1е
─ ─
2е,8 е
Na +
Ион не отдает электроны, при взаимодействии с водой не образует
NaOH и H 2
Na 0
- Атом легко отдает электроны, взаимодействует с водой
- (образуется NaOH и H 2 )

3. Положение (рис.5)
- В растворе и расплаве электролита ионы движутся хаотически.
- При пропускании постоянного электрического тока через раствор или расплав положительно заряженные ионы (катионы) движутся к отрицательному полюсу источника тока – катоду.
- Отрицательно заряженные ионы (анионы) движутся к положительному полюсу источника тока – аноду . (рис.6)
ИОНЫ
ИОНЫ
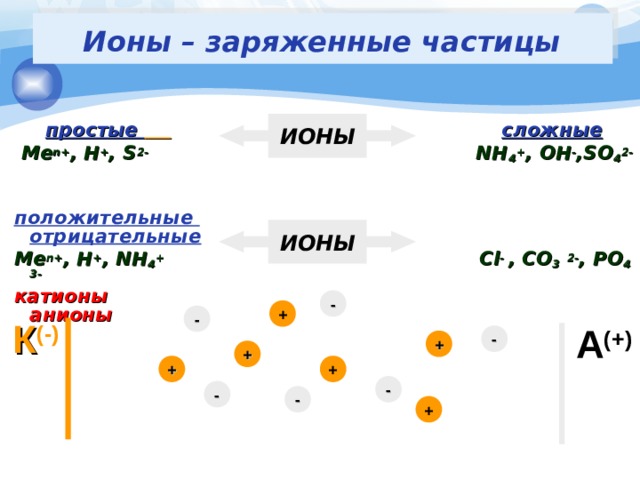
Ионы – заряженные частицы
простые сложные
Me n+ , H + , S 2- NH 4 + , OH - ,SO 4 2-
положительные отрицательные
Me n+ , H + , NH 4 + Cl - , CO 3 2- , PO 4 3-
катионы анионы
-
+
-
К (-)
А (+)
-
+
+
+
+
-
-
-
+

- Растворение как физики-химический процесс.
- Учебник § 6, стр. 23 - 25. самостоятельно.

Рефлексия
- Я умею определять ….. и …..
- Я умею записывать строение … и ….
- Я знаю, что электролиты …. …… …., а неэлектролиты ……..

- §6 прочитать,
- выучить основные определения.
- Выполнить № 1,2 (устно)
- № 3,4 (письменно), стр. 25
















































