Просмотр содержимого документа
«Презентация к открытому уроку по теме "Сера. Свойства. Применение"»

- Сера расположена в ПСХЭ Д.И.Менделеева во VI группе главной подгруппе.
- На внешнем энергетическом уровне атома серы находится 6 электронов.
- Сера белого цвета.
- Для кислорода характерна аллотропия.
- Самый сильный окислитель среди элементов VI группы главной подгруппы селен
- Формула озона О5
- Сера может проявлять в соединениях степень окисления +6
- Для кислорода характерна степень окисления +4
- Озон можно получить из кислорода
- Степень окисления серы в формуле H2SO4 равна +4

«халькогены»
Общее название элементов главной подгруппы VI группы –
" В переводе с греческого обозначает " рождающие руды".

Сера.

Сегодня мы узнаем: -аллотропные модификации серы -нахождение серы в природе -физические свойства серы -химические свойства -применение серы

Нахождение серы в природе
Сера является на 16-м месте по распространённости в земной коре. Встречается в свободном (самородном) состоянии и связанном виде .

Сера в природе
Сульфидная:
Cульфатная:
Сероводород
H 2 S
Самородная
Глауберова соль(мирабилит)
Na 2 SO 4 ·10H 2 O
Цинковая
обманка
ZnS
Гипс
CaSO 4 ·2H 2 O
Свинцовый блеск PbS
Пирит FeS 2
Киноварь HgS

Физические свойства серы
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (порошок серы в воде не тонет и плавает на поверхности воды)

Аллотропные модификации
пластическая
кристаллическая
моноклинная
ромбическая

Аллотропия серы
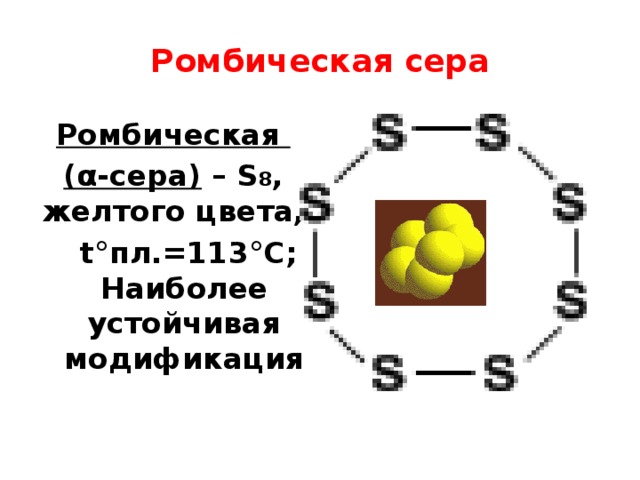
Ромбическая сера
Ромбическая
( α-сера) – S 8 , желтого цвета,
t°пл.=113°C; Наиболее устойчивая модификация
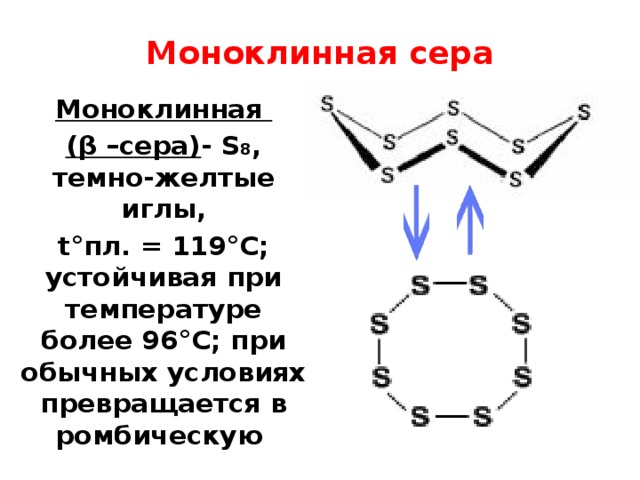
Моноклинная сера
Моноклинная
( β –сера) - S 8 , темно-желтые иглы,
t°пл. = 119°C; устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую

Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива и через некоторое время становится хрупкой, приобретёт желтый цвет, т.е
превращается в ромбическую серу

Сера
Химические свойства
Химические свойства

Взаимодействие с натрием
Видео (полный экран)

Взаимодействие с цинком

Взаимодействие серы с медью

Закончите уравнения реакции
- Na + S = …
- Cu + S = …
- Zn + S = …
- Н2 + S = …

Закончите уравнения реакций

Способы получения серы
- Неполное окисление сероводорода (при недостатке кислорода).
2H 2 S + O 2 = 2S + 2H 2 O
2H 2 S + SO 2 = 3S + 2H 2 O

Сера
Применение
Применение

S
Применение

Выберите правильный ответ
1. Электронная формула 1S 2 2S 2 2P 6 3S 2 3P 4 соответствует атому:
А) кислорода
Б) серы
В) азота
Г) фосфора

Выберите правильный ответ
2. Аллотропными модификациями являются:
А) озон и вода
Б) кристаллическая и пластическая сера
В) оксиды SO 3 и SO 2
Г) гидриды H 2 S, H 2 Se, H 2 Te

Выберите правильный ответ
3. Сера реагирует со следующими веществами:
А) Al и O 2
Б) H 2 и Au
В) Na и CO 2 ,
Г) Na и H 2 O

Выберите правильный ответ
4. Установите соответствие между степенью окисления серы и формулой
1) H 2 SO 4 А) 0
2) H 2 S Б) +4
3) Na 2 SO 3 В) +6
Г) -2

Домашнее задание
- Параграф 18,
- стр. 67 вопросы 1-3,
- тестовые задания.

Рефлексия
- Что вам на уроке удалось лучше всего?
- Что вам понравилось на уроке?
- С каким настроением заканчиваете урок?
Рефлексия

Спасибо за урок












































