
Алканы – углеводороды с общей формулой: С n H 2n+2 , в молекулах которых атомы связаны одинарными связями.
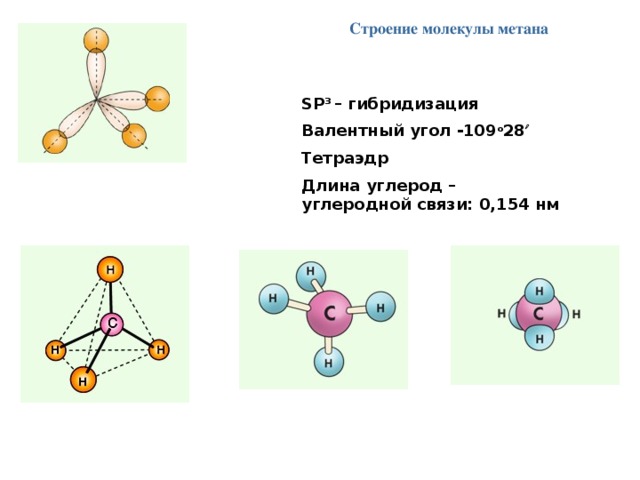
Строение молекулы метана
SР 3 – гибридизация
Валентный угол -109 о 28
Тетраэдр
Длина углерод – углеродной связи: 0,154 нм
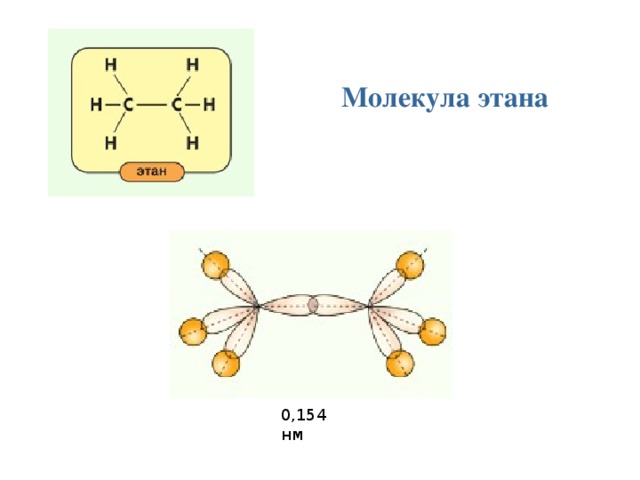
Молекула этана
0,154 нм

Алкены (этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь.
Общая формула ряда алкенов СnH2n
Простейшие представители:
С 2 Н 4 С 3 Н 6 С 4 Н 8
СН 2 =СН 2 СН 2 =СН–СН 3 СН 2 =СН–СН 2 –СН 3
этилен пропилен бутилен-1
(этен) (пропен) (бутен-1)

В отличие от предельных углеводородов алкены содержат двойную связь С=С, которая осуществляется четырьмя общими электронами.

В образовании такой связи участвуют атомы углерода в sp 2 -гибридизованном состоянии. Каждый из них имеет по три sp 2 -гибридных орбитали, направленных друг к другу под углом 120 , и одну негибридизованную р -орбиталь, расположенную под углом 90 к плоскости гибридных АО.
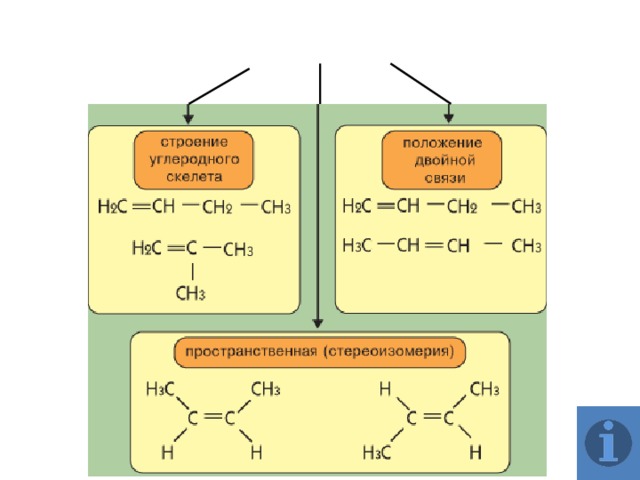
Изомерия алкенов
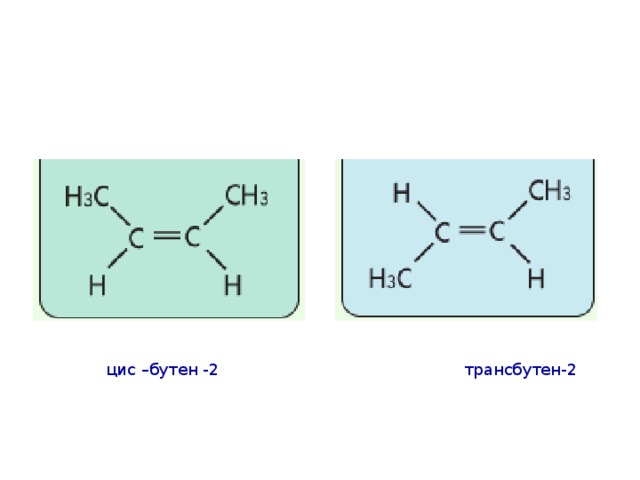
Пространственная стерео-изомерия
цис –бутен -2 трансбутен-2
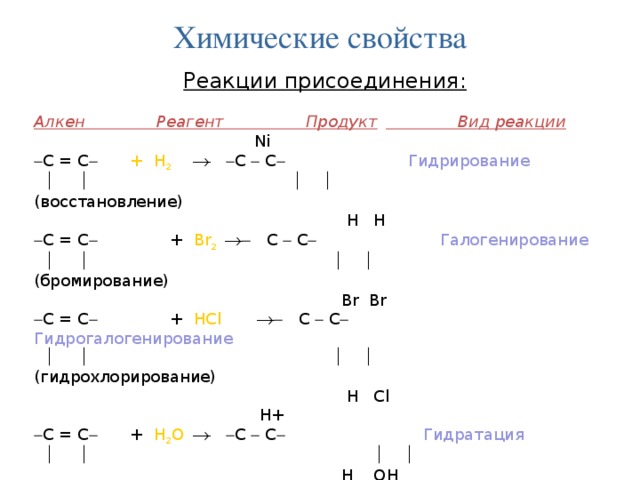
Химические свойства
Реакции присоединения:
Алкен Реагент Продукт Вид реакции
Ni
С = С + Н 2 С С Гидрирование
(восстановление)
Н Н
С = С + Br 2 С С Галогенирование
(бромирование)
Br Br
С = С + HCl С С Гидрогалогенирование
(гидрохлорирование)
H Cl
H+
С = С + H 2 О С С Гидратация
H ОН
катализатор
n ( С = С ) ( С С )n Полимеризация
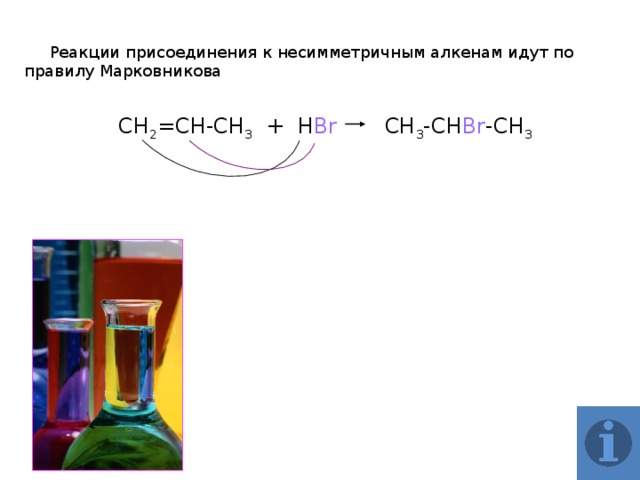
Реакции присоединения к несимметричным алкенам идут по правилу Марковникова
СН 2 =СН-СН 3 + Н Вr CH 3 -CH Br -CH 3
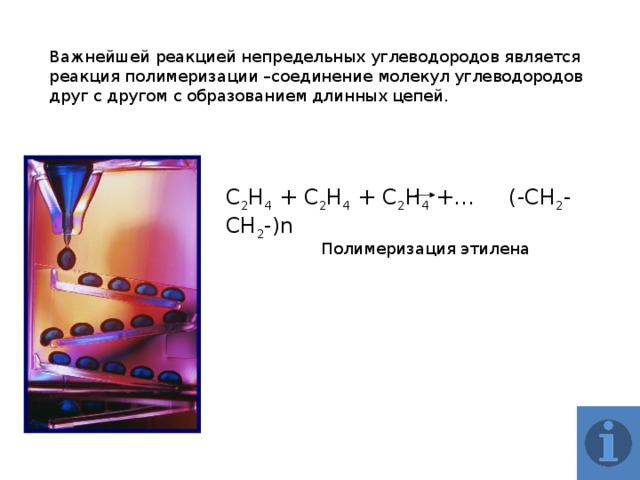
Важнейшей реакцией непредельных углеводородов является реакция полимеризации –соединение молекул углеводородов друг с другом с образованием длинных цепей.
С 2 Н 4 + С 2 Н 4 + С 2 Н 4 +… (-СН 2 -СН 2 -)n
Полимеризация этилена
 3. Различают диены с примыкающими друг к другу двойными связями, сопряженными и изолированными двойными связями. Особенностью диенов с сопряженными двойными связями является образование общего -электронного облака p-электронами двойной связи (сопряжение). " width="640"
3. Различают диены с примыкающими друг к другу двойными связями, сопряженными и изолированными двойными связями. Особенностью диенов с сопряженными двойными связями является образование общего -электронного облака p-электронами двойной связи (сопряжение). " width="640"
Алкадиены – это соединения с двумя двойными связями. Общая формула алкадиенов - С n Н 2n-2 , причем n3.
Различают диены с примыкающими друг к другу двойными связями, сопряженными и изолированными двойными связями.
Особенностью диенов с сопряженными двойными связями является образование общего -электронного облака p-электронами двойной связи (сопряжение).

Изомерия
Структурная изомерия
1. Изомерия положения сопряженных двойных связей:
СН 2 =СН–СН=СН–СН 2 –СН 3 СН 3 –СН=СН–СН=СН–СН 3
гексадиен-1,3 гексадиен-2,4
2. Изомерия углеродного скелета:
СН 2 =СН–СН=СН–СН 3 СН 2 =С–СН=СН 2
пентадиен-1,3
СН 3
2-метилбутадиен-1,3 (изопрен)
3. Межклассовая изомерия с алкинами и циклоалкенами .
Например, формуле С 4 Н 6 соответствуют следующие соединения:
СН = СН
СН 2 =СН–СН=СН 2 СН С–СН 2 –СН 3
СН 2 –СН 2
бутадиен-1,3 бутин-1 циклобутен
4. Пространственная изомерия
![Химические свойства По химическим свойствам диеновые углеводороды подобны алкенам. Они легко окисляются и вступают в реакции присоединения . 1. Гидрирование Н 2 СН 2 =СН СН=СН 2 [ СН 2 СН СН СН 2 ] СН 3 СН=СН СН 3 Н Н бутен-2 В присутствии катализатора получается продукт полного гидрирования: Ni СН 2 =СН СН=СН 2 + 2Н 2 СН 3 СН 2 СН 2 СН 3 н-бутан 2. Галогенирование 1,4-присоединение: СН 2 =СН СН=СН 2 + Br 2 СН 2 СН=СН СН 2 Br Br 1,2-присоединение: СН 2 =СН СН=СН 2 + Br 2 СН 2 СН СН=СН 2 Br Br](https://fsd.multiurok.ru/html/2017/03/22/s_58d1d98d990e2/img13.jpg)
Химические свойства
По химическим свойствам диеновые углеводороды подобны алкенам. Они легко окисляются и вступают в реакции присоединения .
1. Гидрирование
Н 2
СН 2 =СН СН=СН 2 [ СН 2 СН СН СН 2 ] СН 3 СН=СН СН 3
Н Н бутен-2
В присутствии катализатора получается продукт полного гидрирования:
Ni
СН 2 =СН СН=СН 2 + 2Н 2 СН 3 СН 2 СН 2 СН 3
н-бутан
2. Галогенирование
1,4-присоединение:
СН 2 =СН СН=СН 2 + Br 2 СН 2 СН=СН СН 2
Br Br
1,2-присоединение:
СН 2 =СН СН=СН 2 + Br 2 СН 2 СН СН=СН 2
Br Br
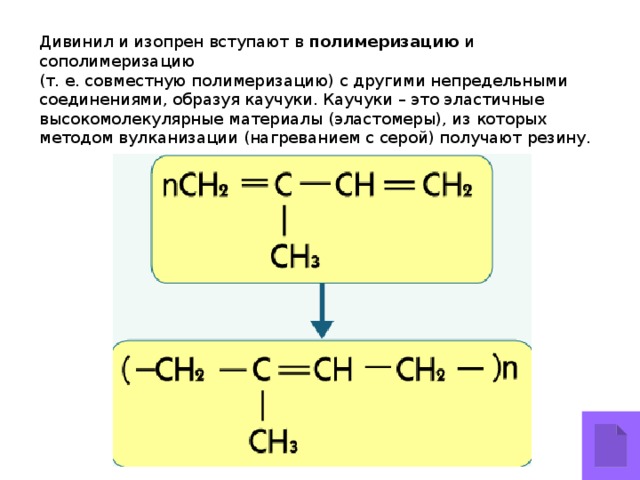
Дивинил и изопрен вступают в полимеризацию и сополимеризацию
(т. е. совместную полимеризацию) с другими непредельными соединениями, образуя каучуки. Каучуки – это эластичные высокомолекулярные материалы (эластомеры), из которых методом вулканизации (нагреванием с серой) получают резину.
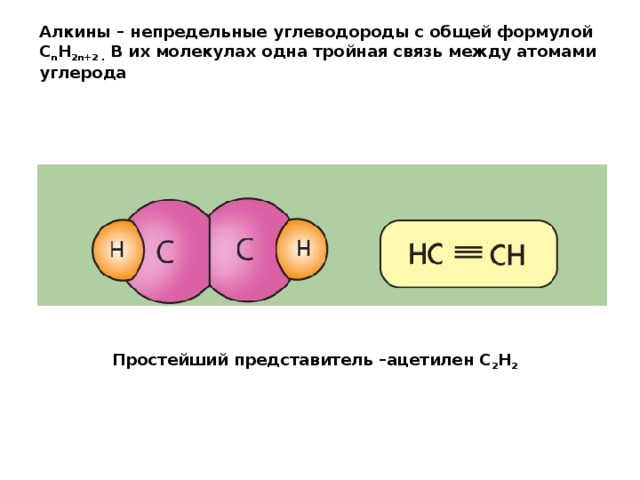
Алкины – непредельные углеводороды с общей формулой C n H 2n+2 . В их молекулах одна тройная связь между атомами углерода
Простейший представитель –ацетилен С 2 Н 2
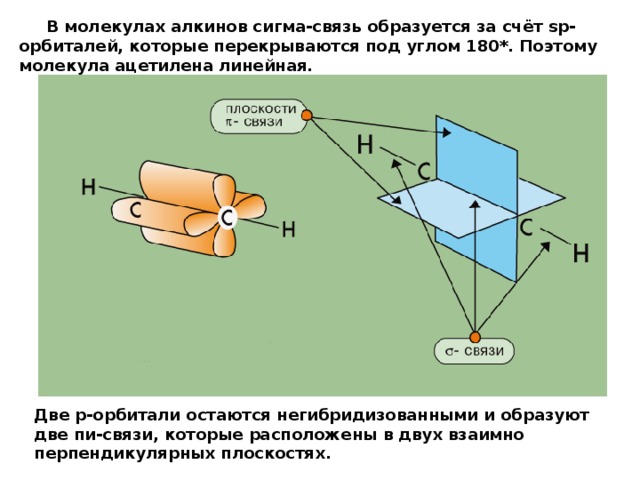
В молекулах алкинов сигма-связь образуется за счёт sp-орбиталей, которые перекрываются под углом 180*. Поэтому молекула ацетилена линейная.
Две р-орбитали остаются негибридизованными и образуют две пи-связи, которые расположены в двух взаимно перпендикулярных плоскостях.

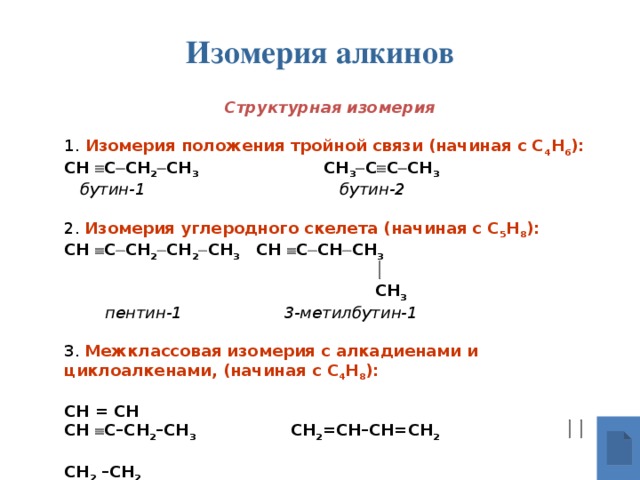
Изомерия алкинов
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С 4 Н 6 ):
СН С СН 2 СН 3 СН 3 С С СН 3
бутин-1 бутин-2
2. Изомерия углеродного скелета (начиная с С 5 Н 8 ):
СН С СН 2 СН 2 СН 3 СН С СН СН 3
СН 3
пентин-1 3-метилбутин-1
3. Межклассовая изомерия с алкадиенами и циклоалкенами, (начиная с С 4 Н 8 ):
СН = СН
СН С–СН 2 –СН 3 СН 2 =СН–СН=СН 2
СН 2 –СН 2
бутин-1 бутадин-1,3 циклобутен
![Реакции присоединения 1. Гидрирование H 2 (Ni) H 2 (Ni) R C C R' R CН=CН R' R CН 2 CН 2 R' 2. Галогенирование Br 2 Br 2 R C C R' R CBr=CBr R' R CBr 2 CBr 2 R' Алкины обесцвечивают бромную воду. 3. Гидрогалогенирование HCl HCl CH 3 C CH CH 3 CCl=CH 2 CH 3 CCl 2 CH 3 4. Гидратация (реакция Кучерова ) HgSO 4 Н C C H + H 2 O [H C=C H] CH 3 C H H OH O Виниловый спирт Уксусный альдегид HgSO 4 CH 3 C CH + H 2 O [CH 3 C=CH 2 ] CH 3 C CH 3 OH O Ацетон (кетон)](https://fsd.multiurok.ru/html/2017/03/22/s_58d1d98d990e2/img19.jpg)
Реакции присоединения
1. Гидрирование
H 2 (Ni) H 2 (Ni)
R C C R' R CН=CН R' R CН 2 CН 2 R'
2. Галогенирование
Br 2 Br 2
R C C R' R CBr=CBr R' R CBr 2 CBr 2 R'
Алкины обесцвечивают бромную воду.
3. Гидрогалогенирование
HCl HCl
CH 3 C CH CH 3 CCl=CH 2 CH 3 CCl 2 CH 3
4. Гидратация (реакция Кучерова )
HgSO 4
Н C C H + H 2 O [H C=C H] CH 3 C H
H OH O
Виниловый спирт Уксусный альдегид
HgSO 4
CH 3 C CH + H 2 O [CH 3 C=CH 2 ] CH 3 C CH 3
OH O
Ацетон (кетон)
5. Полимеризация
- Димеризация под действием водного раствора CuCl и NH 4 Cl:
НC CH + НC CH Н 2 C=CH C CH (винилацетилен)
- Тримеризация ацетилена над активированным углем приводит
к образованию бензола (реакция Зелинского ):
600*
3 С 2 Н 2 С 6 Н 6
акт. уголь
![Реакции окисления Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот: R C C R’ + 3[O] + H 2 O R COOH + R’ COOH Алкины обесцвечивают раствор KMnO 4 , что используется для их качественного определения. При сгорании (полном окислении) ацетилена выделяется большое количества тепла: HC CH + 2О 2 2СО 2 + Н 2 О + Q](https://fsd.multiurok.ru/html/2017/03/22/s_58d1d98d990e2/img21.jpg)
Реакции окисления
Ацетилен и его гомологи окисляются перманганатом калия с
расщеплением тройной связи и образованием карбоновых кислот:
R C C R’ + 3[O] + H 2 O R COOH + R’ COOH
Алкины обесцвечивают раствор KMnO 4 , что используется
для их качественного определения.
При сгорании (полном окислении) ацетилена выделяется большое
количества тепла:
HC CH + 2О 2 2СО 2 + Н 2 О + Q

Предельные углеводороды с замкнутыми цепями (циклами) называют циклоалканами (циклопарафинами).
Общая формула циклоалканов С n H 2n
Пропан Цикло пропан

Примеры циклоалканов
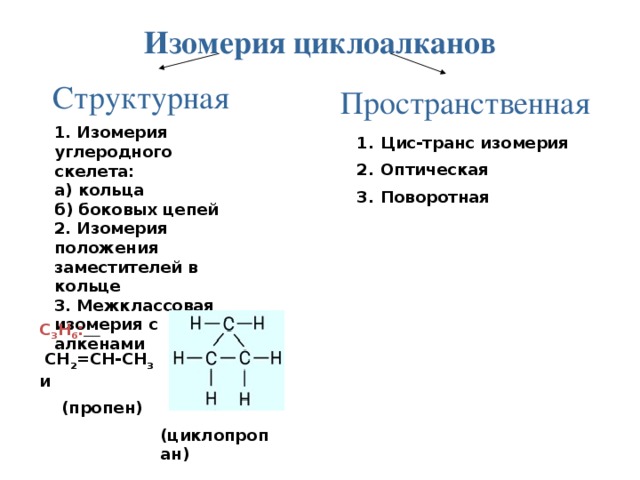
Изомерия циклоалканов
Структурная
Пространственная
1. Изомерия углеродного скелета:
а) кольца
б) боковых цепей
2. Изомерия положения заместителей в кольце
3. Межклассовая изомерия с алкенами
- Цис-транс изомерия
- Оптическая
- Поворотная
С 3 Н 6 :
СН 2 =СН-СН 3 и
(пропен)
(циклопропан)
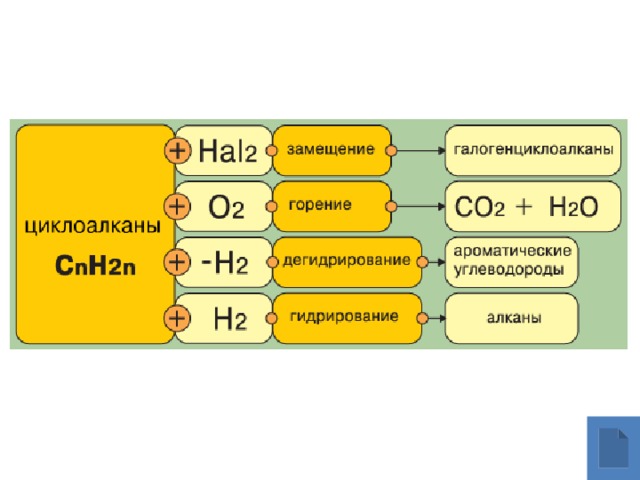
Химические свойства

Реакция горения

Галогенирование малых циклов идёт как реакция присоединения
Например, бромирование циклопропана
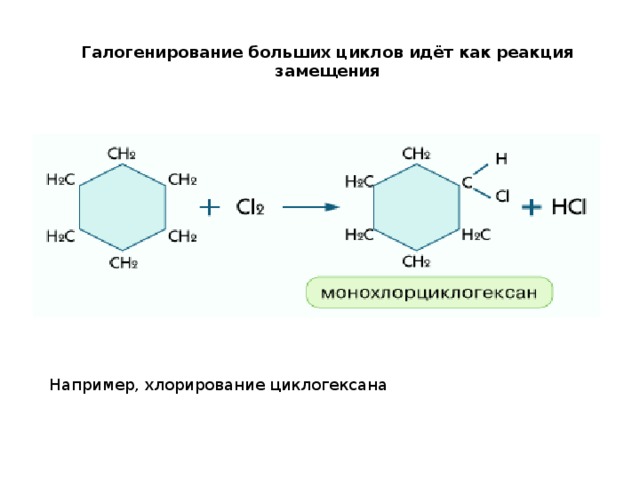
Галогенирование больших циклов идёт как реакция замещения
Например, хлорирование циклогексана
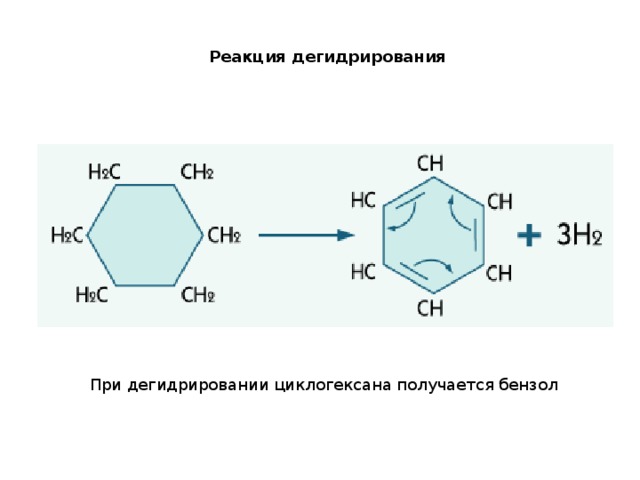
Реакция дегидрирования
При дегидрировании циклогексана получается бензол

















 3. Различают диены с примыкающими друг к другу двойными связями, сопряженными и изолированными двойными связями. Особенностью диенов с сопряженными двойными связями является образование общего -электронного облака p-электронами двойной связи (сопряжение). " width="640"
3. Различают диены с примыкающими друг к другу двойными связями, сопряженными и изолированными двойными связями. Особенностью диенов с сопряженными двойными связями является образование общего -электронного облака p-электронами двойной связи (сопряжение). " width="640"

![Химические свойства По химическим свойствам диеновые углеводороды подобны алкенам. Они легко окисляются и вступают в реакции присоединения . 1. Гидрирование Н 2 СН 2 =СН СН=СН 2 [ СН 2 СН СН СН 2 ] СН 3 СН=СН СН 3 Н Н бутен-2 В присутствии катализатора получается продукт полного гидрирования: Ni СН 2 =СН СН=СН 2 + 2Н 2 СН 3 СН 2 СН 2 СН 3 н-бутан 2. Галогенирование 1,4-присоединение: СН 2 =СН СН=СН 2 + Br 2 СН 2 СН=СН СН 2 Br Br 1,2-присоединение: СН 2 =СН СН=СН 2 + Br 2 СН 2 СН СН=СН 2 Br Br](https://fsd.multiurok.ru/html/2017/03/22/s_58d1d98d990e2/img13.jpg)





![Реакции присоединения 1. Гидрирование H 2 (Ni) H 2 (Ni) R C C R' R CН=CН R' R CН 2 CН 2 R' 2. Галогенирование Br 2 Br 2 R C C R' R CBr=CBr R' R CBr 2 CBr 2 R' Алкины обесцвечивают бромную воду. 3. Гидрогалогенирование HCl HCl CH 3 C CH CH 3 CCl=CH 2 CH 3 CCl 2 CH 3 4. Гидратация (реакция Кучерова ) HgSO 4 Н C C H + H 2 O [H C=C H] CH 3 C H H OH O Виниловый спирт Уксусный альдегид HgSO 4 CH 3 C CH + H 2 O [CH 3 C=CH 2 ] CH 3 C CH 3 OH O Ацетон (кетон)](https://fsd.multiurok.ru/html/2017/03/22/s_58d1d98d990e2/img19.jpg)

![Реакции окисления Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот: R C C R’ + 3[O] + H 2 O R COOH + R’ COOH Алкины обесцвечивают раствор KMnO 4 , что используется для их качественного определения. При сгорании (полном окислении) ацетилена выделяется большое количества тепла: HC CH + 2О 2 2СО 2 + Н 2 О + Q](https://fsd.multiurok.ru/html/2017/03/22/s_58d1d98d990e2/img21.jpg)


















