

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Рабочая программа по химии 10-11 класс ,углубленный уровень
Углубленная программа изучения химии по учебникам:
1.Химия. 10 класс . Углубленный уровень : учебник / О.С.Габриелян, И.Г.Остроумов, С.Ю.Понамарев.-М.: Дрофа,2018.
2. Химия . Углубленный уровень. 11 кл. : учебник / О.С.Габриелян, Г.Г.Лысова .-М.: Дрофа,2019.
Общее количество часов на изучение предмета на профильном уровне с 10-11 класс 340 ч., в том числе 10 класс - 170 ч, 11 класс – 170 ч.
Просмотр содержимого документа
«Рабочая программа по химии 10-11 класс ,углубленный уровень»
Пояснительная записка
Рабочая программа по химии составлена в соответствии со следующими нормативными документами:
федеральный государственный образовательный стандарт среднего общего образования (далее - ФГОС СОО), утвержденным приказом Минобрнауки России от 17.05.2012 № 413 (с изменениями и дополнениями);
основная образовательная программа среднего общего образования (далее – ООП СОО), утвержденной приказом МАОУ «Гимназия № 31» от 24.04.2017 № 167 (с изменениями и дополнениями);
примерная основная образовательная программа среднего общего образования ( одобрена решением федерального учебно-методического объединения по общему образованию (протокол от 28 июня 2016 г. № 2/16-з)
В данной программе прослеживается преемственность между видами деятельности обучаемых, предусмотренных программой основного общего образования и видами деятельности, обеспечивающих реализацию образовательной траектории, связанной с углублённым изучением химии. Содержание данной рабочей программы учитывает не только предметное содержание и возрастные психологические особенности обучаемых, но и профильную подготовку к обучению в высшей школе, в которой химия является профилирующей дисциплиной.
Теоретическое и экспериментальное содержание курса изучается на основе
познавательной деятельности обучающихся: применять теоретические знания понятий, законов и теорий химии углублённого уровня для прогнозирования свойств химических объектов и подтверждение этих прогнозов при выполнении химического эксперимента; планировать и проводить химический эксперимент и интерпретировать его результаты; уметь характеризовать и классифицировать химические элементы, вещества и процессы; полно и точно выражать и аргументировать свою точку зрения; находить источники, получать, представлять и сообщать химическую информацию в устной и письменной речи и др.
Данный курс позволяет подготовить обучающихся к осознанному и ответственному выбору профессиональной подготовки к поступлению в вуз, в котором химия является профильной дисциплиной, успешному обучению в нём и выбору профессии.
Согласно образовательному стандарту главные цели среднего (полного) общего образования состоят:
в формировании целостного представления о мире, основанного на приобретённых знаниях, умениях и способах деятельности;
в приобретении опыта разнообразной деятельности, опыта познания и самопознания;
в подготовке к осуществлению осознанного выбора индивидуальной образовательной или профессиональной траектории.
Изучение химии на углублённом уровне вносит большой вклад в достижение этих целей среднего (полного) общего образования и призвано обеспечить:
формирование научной картины мира на основе системы химических знаний (химической картины мира) как её неотъемлемого компонента;
выработке у обучающихся гуманистических отношений и экологически грамотного поведения в быту и трудовой деятельности, нравственного совершенствования и развития личности обучающихся;
понимание общественной потребности у обучающихся в развитии химии и химической промышленности;
формирование у обучающихся отношения к химии как возможной области профессиональной подготовки и практической деятельности;
формирование успешного участия в публичном представлении результатов экспериментальной и исследовательской деятельности,;
участие в химических олимпиадах различных уровней в соответствии с желаемыми результатами и адекватной самооценкой собственных возможностей;
использование химических знаний для объяснения особенностей объектов и процессов природной, социальной, культурной, технической среды;
понимание ценности химического языка, выраженного в вербальной и знаковой формах, как составной части речевой культуры современного специалиста высокой квалификации.
Для реализации данной программы используется учебно-методический комплекс под редакцией О.С.Габриеляна.
1.Химия. Рабочие программы. Предметная линия учебников О. С. Габриеляна и др. 10—11 классы : учеб. пособие для общеобразоват. организаций / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение, 2019.
2. Химия. 10 класс . Углубленный уровень : учебник / О.С.Габриелян, И.Г.Остроумов, С.Ю.Понамарев.-М.: Дрофа,2018.
3. Химия . Углубленный уровень. 11 кл. : учебник / О.С.Габриелян, Г.Г.Лысова .-М.: Дрофа,2019.
4. Химия.10 класс .Углубленный уровень : методическое пособие / О.С.Габриелян, И.Г.Остроумов.-М.: Дрофа,2017.
5. Химия . Углубленный уровень. 11 кл. : методическое пособие / О.С.Габриелян, Г.Г.Лысова .-М.: Дрофа,2019.
6. Химия . Углубленный уровень. 10 кл. :контрольные работы / О.С.Габриелян, С.А.Сладков, А.М.Бонару.-М.: Дрофа,2016.
7. Химия . Углубленный уровень. 11 кл. : контрольные и проверочные работы / О.С.Габриелян, Л.И.Асанова .-М.: Дрофа,2015.
8. Химия . Углубленный уровень. 11 кл. : контрольные работы / О.С.Габриелян, Л.И.Асанова .-М.: Дрофа,2016.
Общая характеристика курса
Содержание углублённого курса химии в средней (полной) школе строится на основе изучения состава и строения веществ, зависимости их свойств от строения, практического значения этих свойств, а также способов лабораторного и промышленного получения важнейших веществ, изучения закономерностей химических процессов и путей управления ими. Основные содержательные линии рабочей программы:
«Вещество» — система знаний о составе и строении веществ, их свойствах и биологическом значении;
«Химическая реакция» — система знаний об условиях протекания химических процессов и способах управления ими;
«Применение веществ» — система знаний о практическом применении веществ на основе их свойств и их значения в бытовой и производственной сферах;
«Получение веществ» — система знаний о химических производственных процессах;
«Язык химии» — система знаний о номенклатуре неорганических о органических соединений и химической терминологии, а также умение отражать их с помощью химической символики (знаков, формул и уравнений); навыков перевода информации с языка химии на естественный и обратно
«Количественные отношения» — система расчётных умений и навыков для характеристики взаимосвязи качественной и количественной сторон химических объектов (веществ, материалов и процессов);
«Теория и практика» — взаимосвязь теоретических знаний и химического эксперимента как критерия истинности и источника познания.
Место предмета в учебном плане МАОУ «Гимназия № 31»: общее количество часов на изучение предмета на профильном уровне с 10-11 класс 340 ч., в том числе 10 класс - 170 ч, 11 класс – 170 ч.
Планируемые результаты освоения курса
Деятельность учителя в обучении химии в средней (полной) школе должна быть направлена на достижение обучающимися следующих личностных результатов:
в ценностно-ориентационной сфере — осознание российской гражданской идентичности, патриотизма, чувства гордости за российскую химическую науку;
в трудовой сфере — готовность к осознанному выбору дальнейшей образовательной траектории в высшей школе, где химия является профилирующей дисциплиной;
в познавательной (когнитивной, интеллектуальной) сфере — умение управлять своей познавательной деятельностью, готовность и способность к образованию, в том числе самообразованию, на протяжении всей жизни; сознательное отношение к непрерывному образованию как условию успешной профессиональной и общественной деятельности; формирование навыков экспериментальной и исследовательской деятельности; участие в публичном представлении результатов самостоятельной познавательной деятельности; участие в профильных олимпиадах различных уровней в соответствии с желаемыми результатами и адекватной самооценкой собственных возможностей;
в сфере здоровьесбережения — принятие и реализация ценностей здорового и безопасного образа жизни, неприятие вредных привычек (курения, употребления алкоголя, наркотиков) благодаря знанию свойств наркологических и наркотических веществ; соблюдение правил техники безопасности в процессе работы с веществами, материалами в учебной (научной) лаборатории и на производстве.
Метапредметными результатами освоения выпускниками ступени среднего (полного) общего образования курса химии являются:
использование умений и навыков различных видов познавательной деятельности, применение основных методов познания (системно-информационный анализ, наблюдение, измерение, проведение эксперимента, моделирование, исследовательская деятельность) для изучения различных сторон окружающей действительности;
владение основными интеллектуальными операциями: формулировка гипотез, анализ и синтез, сравнение и систематизация, обобщение и конкретизация, выявление причинно-следственных связей и поиск аналогов;
познание объектов окружающего мира от общего через особенное к единичному;
умение генерировать идеи и определять средства, необходимые для их реализации;
умение определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике;
использование различных источников для получения химической информации, понимание зависимости содержания и формы представления информации от целей коммуникации и адресата;
умение продуктивно общаться и взаимодействовать в процессе совместной деятельности, учитывать позиции других участников деятельности, эффективно разрешать конфликты;
готовность и способность к самостоятельной информационно-познавательной деятельности, включая умение ориентироваться в различных источниках информации, критически оценивать и интерпретировать информацию, получаемую из различных источников;
умение использовать средства информационных и коммуникационных технологий (далее – ИКТ) в решении когнитивных, коммуникативных и организационных задач с соблюдением требований эргономики, техники безопасности, гигиены, ресурсосбережения, правовых и этических норм, норм информационной безопасности;
владение языковыми средствами, включая и язык химии — умение ясно, логично и точно излагать свою точку зрения, использовать адекватные языковые средства, в том числе и символьные (химические знаки, формулы и уравнения).
Предметными результатами изучения химии на углублённом уровне на ступени среднего (полного) общего образования являются:
1) знание (понимание) характерных признаков важнейших химических понятий: вещество, химический элемент, атом, молекула, относительные атомные и молекулярные массы, ион, изотопы, химическая связь (ковалентная полярная и неполярная, ионная, металлическая, водородная), электроотрицательность, аллотропия, валентность, степень окисления, моль, молярная масса, молярный объем, вещества ионного, молекулярного и немолекулярного строения, растворы, электролиты и неэлектролиты, электролитическая диссоциация, гидролиз, окислитель и восстановитель, окисление и восстановление, электролиз, скорость химической реакции, катализаторы и катализ, обратимость химических реакций, химическое равновесие, смещение равновесия, тепловой эффект реакции, углеродный скелет, функциональная группа, изомерия (структурная и пространственная) и гомология, основные типы (соединения, разложения, замещения, обмена), виды (гидрирования и дегидрирования, гидратации и дегидратации, полимеризации и деполимеризации, поликонденсации и изомеризации, каталитические и некаталитические, гомогенные и гетерогенные) и разновидности (ферментативные, горения, этерификации, крекинга, риформинга) реакций в неорганической и органической химии, полимеры, биологически активные соединения;
2) выявление взаимосвязи химических понятий для объяснения состава, строения, свойств отдельных химических объектов и явлений;
3) применение основных положений химических теорий: теории строения атома и химической связи, периодического закона и периодической системы химических элементов Д. И. Менделеева, теории электролитической диссоциации, протонной теории, теории строения органических соединений, закономерностей химической кинетики — для анализа состава, строения и свойств веществ и протекания химических реакций;
4) умение классифицировать неорганические и органические вещества
по различным основаниям;
5) установление взаимосвязей между составом, строением, свойствами, практическим применением и получением важнейших веществ;
6) знание основ химической номенклатуры (тривиальной и международной) и умение назвать неорганические и органические соединения по формуле, и наоборот;
7) определение: валентности, степени окисления химических элементов, зарядов ионов; видов химических связей в соединениях и типов кристаллических решёток; пространственного строения молекул; типа гидролиза и характера среды водных растворов солей; окислителя и восстановителя; процессов окисления и восстановления, принадлежности веществ к различным классам неорганических и органических соединений; гомологов и изомеров; типов, видов и разновидностей химических реакции в неорганической и органической химии;
8) умение характеризовать:
‒ s-, p- и d-элементы по их положению в периодической системе Д. И. Менделеева;
‒ общие химические свойства простых веществ — металлов и неметаллов;
‒ химические свойства основных классов неорганических и органических соединений в плане общего, особенного и единичного;
9) объяснение:
‒ зависимости свойств химических элементов и их соединений от положения элемента в периодической системе Д. И. Менделеева;
‒ природы химической связи (ионной, ковалентной, металлической, водородной);
‒ зависимости свойств неорганических и органических веществ от их состава и строения;
‒ сущности изученных видов химических реакций: электролитической диссоциации, ионного обмена, окислительно-восстановительных;
‒ влияния различных факторов на скорость химической реакции и на смещение химического равновесия;
‒ механизмов протекания реакций между органическими и неорганическими веществами;
10) умение:
‒ составлять уравнения окислительно-восстановительных реакций с помощью метода электронного баланса;
‒ проводить расчёты по химическим формулам и уравнениям;
‒ проводить химический эксперимент (лабораторные и практические работы) с соблюдением требований к правилам техники безопасности при работе в химическом кабинете (лаборатории).
В результате изучения учебного предмета «Химия» на уровне среднего общего образования:
Выпускник на углубленном уровне научится:
- раскрывать на примерах роль химии в формировании современной научной картины мира и в практической деятельности человека, взаимосвязь между химией и другими естественными науками;
- иллюстрировать на примерах становление и эволюцию органической химии как науки на различных исторических этапах ее развития;
- устанавливать причинно-следственные связи между строением атомов химических элементов и периодическим изменением свойств химических элементов и их соединений в соответствии с положением химических элементов в периодической системе;
- анализировать состав, строение и свойства веществ, применяя положения основных химических теорий: химического строения органических соединений А.М. Бутлерова, строения атома, химической связи, электролитической диссоциации кислот и оснований; устанавливать причинно-следственные связи между свойствами вещества и его составом и строением;
- применять правила систематической международной номенклатуры как средства различения и идентификации веществ по их составу и строению;
- составлять молекулярные и структурные формулы неорганических и органических веществ как носителей информации о строении вещества, его свойствах и принадлежности к определенному классу соединений;
- объяснять природу и способы образования химической связи: ковалентной (полярной, неполярной), ионной, металлической, водородной – с целью определения химической активности веществ;
- характеризовать физические свойства неорганических и органических веществ и устанавливать зависимость физических свойств веществ от типа кристаллической решетки;
- характеризовать закономерности в изменении химических свойств простых веществ, водородных соединений, высших оксидов и гидроксидов;
- приводить примеры химических реакций, раскрывающих характерные химические свойства неорганических и органических веществ изученных классов с целью их идентификации и объяснения области применения;
- определять механизм реакции в зависимости от условий проведения реакции и прогнозировать возможность протекания химических реакций на основе типа химической связи и активности реагентов;
- устанавливать зависимость реакционной способности органических соединений от характера взаимного влияния атомов в молекулах с целью прогнозирования продуктов реакции;
- устанавливать зависимость скорости химической реакции и смещения химического равновесия от различных факторов с целью определения оптимальных условий протекания химических процессов;
- устанавливать генетическую связь между классами неорганических и органических веществ для обоснования принципиальной возможности получения неорганических и органических соединений заданного состава и строения;
- подбирать реагенты, условия и определять продукты реакций, позволяющих реализовать лабораторные и промышленные способы получения важнейших неорганических и органических веществ;
- определять характер среды в результате гидролиза неорганических и органических веществ и приводить примеры гидролиза веществ в повседневной жизни человека, биологических обменных процессах и промышленности;
- приводить примеры окислительно-восстановительных реакций в природе, производственных процессах и жизнедеятельности организмов;
- обосновывать практическое использование неорганических и органических веществ и их реакций в промышленности и быту;
- выполнять химический эксперимент по распознаванию и получению неорганических и органических веществ, относящихся к различным классам соединений, в соответствии с правилами и приемами безопасной работы с химическими веществами и лабораторным оборудованием;
- проводить расчеты на основе химических формул и уравнений реакций: нахождение молекулярной формулы органического вещества по его плотности и массовым долям элементов, входящих в его состав, или по продуктам сгорания; расчеты массовой доли (массы) химического соединения в смеси; расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси); расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного; расчеты теплового эффекта реакции; расчеты объемных отношений газов при химических реакциях; расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества;
- использовать методы научного познания: анализ, синтез, моделирование химических процессов и явлений – при решении учебно-исследовательских задач по изучению свойств, способов получения и распознавания органических веществ;
- владеть правилами безопасного обращения с едкими, горючими и токсичными веществами, средствами бытовой химии;
- осуществлять поиск химической информации по названиям, идентификаторам, структурным формулам веществ;
- критически оценивать и интерпретировать химическую информацию, содержащуюся в сообщениях средств массовой информации, ресурсах Интернета, научно-популярных статьях с точки зрения естественно-научной корректности в целях выявления ошибочных суждений и формирования собственной позиции;
- устанавливать взаимосвязи между фактами и теорией, причиной и следствием при анализе проблемных ситуаций и обосновании принимаемых решений на основе химических знаний;
- представлять пути решения глобальных проблем, стоящих перед человечеством, и перспективных направлений развития химических технологий, в том числе технологий современных материалов с различной функциональностью, возобновляемых источников сырья, переработки и утилизации промышленных и бытовых отходов.
Выпускник на углубленном уровне получит возможность научиться:
- формулировать цель исследования, выдвигать и проверять экспериментально гипотезы о химических свойствах веществ на основе их состава и строения, их способности вступать в химические реакции, о характере и продуктах различных химических реакций;
- самостоятельно планировать и проводить химические эксперименты с соблюдением правил безопасной работы с веществами и лабораторным оборудованием;
- интерпретировать данные о составе и строении веществ, полученные с помощью современных физико-химических методов;
- описывать состояние электрона в атоме на основе современных квантово-механических представлений о строении атома для объяснения результатов спектрального анализа веществ;
- характеризовать роль азотосодержащих гетероциклических соединений и нуклеиновых кислот как важнейших биологически активных веществ;
- прогнозировать возможность протекания окислительно-восстановительных реакций, лежащих в основе природных и производственных процессов.
Основной формой организации учебного процесса является классно-урочная система. В качестве дополнительных форм организации образовательного процесса используется система консультационной поддержки, индивидуальных занятий, самостоятельная работа учащихся с использованием современных информационных технологий.
Преобладающей формой контроля выступают письменный (самостоятельные и контрольные работы) и устный опрос (собеседование), тестирование.
Содержание программы. 10—11 классы. Углубленный уровень.
Органическая химия. 10 класс
(5 ч в неделю всего 170 ч, из них 3 ч — резервное время)
Введение (9 ч)
Предмет органической химии. Особенности строения и свойств органических соединений. Значение и роль органической химии в системе естественных наук и в жизни общества. Краткий очерк истории развития органической химии. Предпосылки создания теории строения: теория радикалов и теория типов, работы А. Кекуле, Э. Франкланда и А. М. Бутлерова, съезд врачей и естествоиспытателей в г. Шпейере. Основные положения теории строения органических соединений А. М. Бутлерова. Химическое строение и свойства органических веществ. Изомерия на примере н-бутана и изобутана. Электронное облако и орбиталь, их формы: s- и р-. Электронные и электронно-графические формулы атома углерода в нормальном и возбужденном состояниях. Ковалентная химическая связь и ее разновидности: σ- и π-. Образование молекул Н2, Сl2, N2, HCl, H2O, NH3, CH4, C2H4, C2H2. Водородная связь. Образование ионов NH и H3O+. Сравнение обменного и донорно-акцепторного механизмов образования ковалентной связи. Первое валентное состояние — sp3-гибридизация — на при- мере молекулы метана и других алканов. Второе валентное состояние — sp2-гибридизация — на примере молекулы этиле- на. Третье валентное состояние — sp-гибридизация — на при- мере молекулы ацетилена. Геометрия молекул этих веществ и характеристика видов ковалентной связи в них. Модель Гиллеспи для объяснения взаимного отталкивания гибридных орбиталей и их расположения в пространстве с минимумом энергии. Демонстрации. Коллекция органических веществ, материалов и изделий из них. Модели молекул CH4 и СН3ОН; C2H2, C2H4 и C6H6; н-бутана и изобутана. Взаимодействие натрия с этанолом и отсутствие взаимодействия с диэтиловым эфиром. Коллекция полимеров, природных и синтетических каучуков, лекарственных препаратов, красителей. Шаростержневые и объ- емные модели молекул Н2, Cl2, N2, H2O, CH4. Шаростержневые и объемные модели CH4, C2H4, C2H2. Модель отталкивания гибридных орбиталей, выполненная с помощью воздушных шаров.
Требования к уровню подготовки обучающихся
Предметные
Уметь:
использовать при характеристике органических веществ понятия «органическая химия», «природные, искусственные и синтетические органические соединения»;
отличать особенности, характеризующие органические соединения.
Метапредметные
Уметь:
строить логические цепи рассуждений;
самостоятельно формулировать познавательную цель и строить свои действия в соответствии с ней;
составлять план действий;
определять значение и роль органической химии.
Тема 1. Строение и классификация органических соединений (15ч)
Классификация органических соединений по строению «углеродного скелета»: ациклические (алканы, алкены, алкины, алкадиены), карбоциклические (циклоалканы и арены) и гетероциклические. Классификация органических соединений по функциональным группам: спирты, фенолы, простые эфиры, альдегиды, кетоны, карбоновые кислоты, сложные эфиры.
Номенклатура тривиальная, рациональная и ИЮПАК. Рациональная номенклатура как предшественник номенклатуры ИЮПАК. Принципы образования названий органических соединений по ИЮПАК: замещения, родоначальной структуры, старшинства характеристических групп (алфавитный порядок).
Структурная изомерия и ее виды: изомерия «углеродного скелета», изомерия положения (кратной связи и функциональной группы), межклассовая изомерия. Пространственная изомерия и ее виды: геометрическая и оптическая. Биологическое значение оптической изомерии. Отражение особенностей строения молекул геометрических и оптических изомеров в их названиях.
Демонстрации. Образцы представителей различных классов органических соединений и шаростержневые или объемные модели их молекул. Таблицы «Название алканов и алкильных заместителей» и «Основные классы органических соединений». Шаростержневые модели органических соединений различных классов. Модели молекул изомеров разных видов изомерии.
Требования к уровню подготовки обучающихся
Предметные
Уметь:
называть основные положения теории строения органических соединений;
использовать понятия: «валентность», «углеродный скелет», «гомология»;
называть вид связи в органических веществах.
Метапредметные
Уметь:
выбирать смысловые единицы и устанавливать отношения между ними;
определять последовательность промежуточных целей с учетом конечного результата;
интегрироваться в коллектив, учитывая наличие других точек зрения на решения поставленной задачи.
Тема 2 Химические реакции в органической химии (10 ч)
Понятие о реакциях замещения. Галогенирование алканов и аренов, щелочной гидролиз галогеналканов.
Понятие о реакциях присоединения. Гидрирование, гидрогалогенирование, галогенирование. Реакции полимеризации и поликонденсации.
Понятие о реакциях отщепления (элиминирования). Дегидрирование алканов. Дегидратация спиртов. Дегидрохлорирование на примере галогеналканов. Понятие о крекинге алканов и деполимеризации полимеров.
Реакции изомеризации.
Гомолитический и гетеролитический разрыв ковалентной химической связи; образование ковалентной связи по донорно-акцепторному механизму. Понятие о нуклеофиле и электрофиле. Классификация реакций по типу реагирующих частиц (нуклеофильные и электрофильные) и принципу изменения состава молекулы. Взаимное влияние атомов в молекулах органических веществ. Индуктивный и мезомерный эффекты. Правило Марковникова.
Расчетные задачи. 1. Вычисление выхода продукта реакции от теоретически возможного. 2. Комбинированные задачи.
Демонстрации. Взрыв смеси метана с хлором. Обесцвечивание бромной воды этиленом и ацетиленом. Получение фенолоформальдегидной смолы. Деполимеризация полиэтилена. Получение этилена и этанола. Крекинг керосина. Взрыв гремучего газа. Горение метана или пропанобутановой смеси (из газовой зажигалки). Взрыв смеси метана или пропанобутановой смеси с кислородом (воздухом).
Требования к уровню подготовки обучающихся
Предметные
Уметь:
называть основные положения теории строения органических соединений;
использовать понятия: «валентность», «углеродный скелет», «гомология»;
называть вид связи в органических веществах.
Метапредметные
Уметь:
выбирать смысловые единицы и устанавливать отношения между ними;
определять последовательность промежуточных целей с учетом конечного результата;
интегрироваться в коллектив, учитывая наличие других точек зрения на решения поставленной задачи
Тема 3. Углеводороды (36 ч)
Понятие об углеводородах.
Природные источники углеводородов. Нефть и ее промышленная переработка. Фракционная перегонка, термический и каталитический крекинг. Природный газ, его состав и практическое использование. Каменный уголь. Коксование каменного угля. Происхождение природных источников углеводородов. Риформинг, алкилирование и ароматизация нефтепродуктов. Экологические аспекты добычи, переработки и использования полезных ископаемых.
Алканы. Гомологический ряд и общая формула алканов. Строение молекулы метана и других алканов. Изомерия алканов. Физические свойства алканов. Алканы в природе. Промышленные способы получения: крекинг алканов, фракционная перегонка нефти. Лабораторные способы получения алканов: синтез Вюрца, декарбоксилирование солей карбоновых кислот, гидролиз карбида алюминия. Реакции замещения. Горение алканов в различных условиях. Термическое разложение алканов. Изомеризация алканов. Применение алканов. Механизм реакции радикального замещения, его стадии. Практическое использование знаний о механизме (свободно-радикальном) реакций в правилах техники безопасности в быту и на производстве.
Алкены. Гомологический ряд и общая формула алкенов. Строение молекулы этилена и других алкенов. Изомерия алкенов: структурная и пространственная. Номенклатура и физические свойства алкенов. Получение этиленовых углеводородов из алканов, галогеналканов и спиртов. Поляризация π-связи в молекулах алкенов на примере пропена. Понятие об индуктивном (+I) эффекте на примере молекулы пропена. Реакции присоединения (галогенирование, гидрогалогенирование, гидратация, гидрирование). Реакции окисления и полимеризации алкенов. Применение алкенов на основе их свойств. Механизм реакции электрофильного присоединения к алкенам. Окисление алкенов в «мягких» и «жестких» условиях.
Алкины. Гомологический ряд алкинов. Общая формула. Строение молекулы ацетилена и других алкинов. Изомерия алкинов. Номенклатура ацетиленовых углеводородов. Получение алкинов: метановый и карбидный способы. Физические свойства алкинов. Реакции присоединения: галогенирование, гидрогалогенирование, гидратация (реакция Кучерова), гидрирование. Тримеризация ацетилена в бензол. Применение алкинов. Окисление алкинов. Особые свойства терминальных алкинов.
Алкадиены. Общая формула алкадиенов. Строение молекул. Изомерия и номенклатура алкадиенов. Физические свойства. Взаимное расположение π-связей в молекулах алкадиенов: кумулированное, сопряженное, изолированное. Особенности строения сопряженных алкадиенов, их получение. Аналогия в химических свойствах алкенов и алкадиенов. Полимеризация алкадиенов. Натуральный и синтетический каучуки. Вулканизация каучука. Резина. Работы С.В. Лебедева. Особенности реакций присоединения к алкадиенам с сопряженными π-связями.
Циклоалканы. Понятие о циклоалканах и их свойствах. Гомологический ряд и общая формула циклоалканов. Напряжение цикла в С3Н6, С4Н8 и С5Н10, конформации С6Н12. Изомерия циклоалканов (по «углеродному скелету», цис-, транс-, межклассовая). Химические свойства циклоалканов: горение, разложение, радикальное замещение, изомеризация. Особые свойства циклопропана, циклобутана.
Арены. Бензол как представитель аренов. Строение молекулы бензола. Сопряжение π-связей. Изомерия и номенклатура аренов, их получение. Гомологи бензола. Влияние боковой цепи на электронную плотность сопряженного π-облака в молекулах гомологов бензола на примере толуола. Химические свойства бензола. Реакции замещения с участием бензола: галогенирование, нитрование и алкилирование. Применение бензола и его гомологов. Радикальное хлорирование бензола. Механизм и условия проведения реакции радикального хлорирования бензола. Каталитическое гидрирование бензола. Механизм реакций электрофильного замещения: галогенирования и нитрования бензола и его гомологов. Сравнение реакционной способности бензола и толуола в реакциях замещения. Ориентирующее действие группы атомов СН3— в реакциях замещения с участием толуола. Ориентанты I и II рода в реакциях замещения с участием аренов. Реакции боковых цепей алкилбензолов.
Расчетные задачи. 1. Нахождение молекулярной формулы органического соединения по массе (объему) продуктов сгорания. 2. Нахождение молекулярной формулы вещества по его относительной плотности и массовой доле элементов в соединениях. 3. Комбинированные задачи.
Демонстрации. Коллекция «Природные источники углеводородов». Сравнение процессов горения нефти и природного газа. Образование нефтяной пленки на поверхности воды. Каталитический крекинг парафина. Растворение парафина в бензине и испарение растворителя из смеси. Плавление парафина и его отношение к воде (растворение, сравнение плотностей, смачивание). Разделение смеси бензин — вода с помощью делительной воронки.
Получение метана из ацетата натрия и гидроксида натрия. Модели молекул алканов — шаростержневые и объемные. Горение метана, пропанобутановой смеси, парафина в условиях избытка и недостатка кислорода. Взрыв смеси метана с воздухом. Отношение метана, пропанобутановой смеси, бензина, парафина к бромной воде и раствору перманганата калия. Взрыв смеси метана и хлора, инициируемый освещением. Восстановление оксида меди (II) парафином.
Шаростержневые и объемные модели молекул структурных и пространственных изомеров алкенов. Объемные модели молекул алкенов. Получение этена из этанола. Обесцвечивание этеном бромной воды. Обесцвечивание этеном раствора перманганата калия. Горение этена.
Получение ацетилена из карбида кальция. Физические свойства. Взаимодействие ацетилена с бромной водой. Взаимодействие ацетилена с раствором перманганата калия. Горение ацетилена. Взаимодействие ацетилена с раствором соли меди или серебра.
Модели (шаростержневые и объемные) молекул алкадиенов с различным взаимным расположением π-связей. Деполимеризация каучука. Модели (шаростержневые и объемные) молекул алкадиенов с различным взаимным расположением π-связей. Коагуляция млечного сока каучуконосов (молочая, одуванчиков или фикуса).
Шаростержневые модели молекул циклоалканов и алкенов. Отношение циклогексана к раствору перманганата калия и бромной воде.
Шаростержневые и объемные модели молекул бензола и его гомологов. Разделение с помощью делительной воронки смеси бензол — вода. Растворение в бензоле различных органических и неорганических (например, серы) веществ. Экстрагирование красителей и других веществ (например, иода) бензолом из водных растворов. Горение бензола. Отношение бензола к бромной воде и раствору перманганата калия. Получение нитробензола. Обесцвечивание толуолом подкисленного раствора перманганата калия и бромной воды.
Лабораторные опыты. 1. Построение моделей молекул алканов. 2. Сравнение плотности и смешиваемости воды и углеводородов. 3. Построение моделей молекул алкенов. 4. Обнаружение алкенов в бензине. 5. Получение ацетилена и его реакции с бромной водой и раствором перманганата калия.
Практические работы. 1. Качественный анализ органических соединений. 2. Углеводороды
Требования к уровню подготовки обучающихся
Предметные
Уметь:
важнейшие вещества: метан, этилен, ацетилен, пластмассы, каучуки, бензол по международной или «тривиальной» номенклатуре;
характеризовать строение и химические свойства изученных органических соединений;
объяснять зависимость свойств веществ от их состава и строения;
определять принадлежность к различным классам органических соединений.
Метапредметные
Уметь:
выделять и формулировать проблему; самостоятельно составлять алгоритм деятельности при решении проблемы;
сличать свои действия с эталоном и, при необходимости, вносить корректировки; проводить самооценку своих знаний и умений;
анализировать объекты, выделяя существенные признаки
представлять конкретное содержание и представлять его в устной и письменной форме.
Тема 4 Спирты и фенолы (14ч)
Спирты. Состав и классификация спиртов. Изомерия спиртов (положение гидроксильных групп, межклассовая, «углеродного скелета»). Физические свойства спиртов, их получение. Межмолекулярная водородная связь. Особенности электронного строения молекул спиртов. Химические свойства спиртов, обусловленные наличием в молекулах гидроксильных групп: образование алкоголятов, взаимодействие с галогеноводородами, межмолекулярная и внутримолекулярная дегидратация, этерификация, окисление и дегидрирование спиртов. Особенности свойств многоатомных спиртов. Качественная реакция на многоатомные спирты. Важнейшие представители спиртов. Физиологическое действие метанола и этанола. Алкоголизм, его последствия. Профилактика алкоголизма.
Фенолы. Фенол, его физические свойства и получение. Химические свойства фенола как функция его строения. Кислотные свойства. Взаимное влияние атомов и групп в молекулах органических веществ на примере фенола. Поликонденсация фенола с формальдегидом. Качественная реакция на фенол. Применение фенола. Классификация фенолов. Сравнение кислотных свойств веществ, содержащих гидроксильную группу: воды, одно- и многоатомных спиртов, фенола. Электрофильное замещение в бензольном кольце. Применение производных фенола.
Расчетные задачи. Вычисления по термохимическим уравнениям.
Демонстрации. Физические свойства этанола, пропанола-1 и бутанола-1. Шаростержневые модели молекул изомеров с молекулярными формулами С3Н8О и С4Н10О. Количественное вытеснение водорода из спирта натрием. Сравнение реакций горения этилового и пропилового спиртов. Сравнение скоростей взаимодействия натрия с этанолом, пропанолом-2, глицерином. Получение простого эфира. Получение сложного эфира. Получение этена из этанола. Растворимость фенола в воде при обычной и повышенной температуре. Вытеснение фенола из фенолята натрия угольной кислотой. Реакция фенола с хлоридом железа (III). Реакция фенола с формальдегидом.
Лабораторные опыты. 6. Построение моделей молекул изомерных спиртов. 7. Растворимость спиртов с различным числом атомов углерода в воде. 8. Растворимость многоатомных спиртов в воде. 9. Взаимодействие многоатомных спиртов с гидроксидом меди (II). 10. Взаимодействие водного раствора фенола с бромной водой.
Практические работы. 3. Спирты и фенолы
Требования к уровню подготовки обучающихся
Предметные
Уметь:
называть важнейшие кислородосодержащие органические вещества:
объяснять понятие «функциональная группа».
называть изученные вещества по международной или «тривиальной» номенклатуре;
характеризовать строение и химические свойства изученных органических соединений;
объяснять зависимость свойств веществ от их состава и строения;
определять принадлежность к различным классам органических соединений.
Метапредметные
Уметь:
извлекать необходимую для изучения темы информацию из различных источников;
самостоятельно определять познавательную задачу и строить действия в соответствии с ней;
использовать различные модели и средства для демонстрации своих знаний и умений;
проводить самоанализ качества усвоения знаний;
учитывать наличие других точек зрения на решение поставленных образовательных задач, анализировать их и принимать верное решение.
Тема 5 Альдегиды. Кетоны (14ч)
Строение молекул альдегидов и кетонов, их изомерия и номенклатура. Особенности строения карбонильной группы. Физические свойства формальдегида и его гомологов. Отдельные представители альдегидов и кетонов. Химические свойства альдегидов, обусловленные наличием в молекуле карбонильной группы атомов (гидрирование, окисление аммиачными растворами оксида серебра и гидроксида меди (II)). Качественные реакции на альдегиды. Реакция поликонденсации формальдегида с фенолом. Особенности строения и химических свойств кетонов. Нуклеофильное присоединение к карбонильным соединениям. Присоединение циановодорода и гидросульфита натрия. Взаимное влияние атомов в молекулах. Галогенирование альдегидов и кетонов по ионному механизму на свету. Качественная реакция на метилкетоны.
Демонстрации. Шаростержневые модели молекул альдегидов и изомерных им кетонов. Окисление бензальдегида на воздухе. Реакция «серебряного зеркала». Окисление альдегидов гидроксидом меди (II).
Лабораторные опыты. 11. Построение моделей молекул изомерных альдегидов и кетонов. 12. Реакция «серебряного зеркала». 13. Окисление альдегидов гидроксидом меди (II). 14. Окисление бензальдегида кислородом воздуха.
Практические работы. 4. Альдегиды и кетоны.
Требования к уровню подготовки обучающихся
Предметные
Уметь:
называть важнейшие кислородосодержащие органические вещества:
объяснять понятие «функциональная группа».
называть изученные вещества по международной или «тривиальной» номенклатуре;
характеризовать строение и химические свойства изученных органических соединений;
объяснять зависимость свойств веществ от их состава и строения;
определять принадлежность к различным классам органических соединений.
Метапредметные
Уметь:
извлекать необходимую для изучения темы информацию из различных источников;
самостоятельно определять познавательную задачу и строить действия в соответствии с ней;
использовать различные модели и средства для демонстрации своих знаний и умений;
проводить самоанализ качества усвоения знаний;
учитывать наличие других точек зрения на решение поставленных образовательных задач, анализировать их и принимать верное решение
Тема 6 Карбоновые кислоты, сложные эфиры и жиры (18 ч)
Карбоновые кислоты. Строение молекул карбоновых кислот и карбоксильной группы. Классификация и номенклатура карбоновых кислот. Физические свойства карбоновых кислот и их зависимость от строения молекул. Карбоновые кислоты в природе. Биологическая роль карбоновых кислот. Общие свойства неорганических и органических кислот (взаимодействие с металлами, оксидами металлов, основаниями, солями). Влияние углеводородного радикала на силу карбоновой кислоты. Реакция этерификации, условия ее проведения. Химические свойства непредельных карбоновых кислот, обусловленные наличием π-связи в молекуле. Реакции электрофильного замещения с участием бензойной кислоты.
Сложные эфиры. Строение сложных эфиров. Изомерия сложных эфиров («углеродного скелета» и межклассовая). Номенклатура сложных эфиров. Обратимость реакции этерификации, гидролиз сложных эфиров. Равновесие реакции этерификации — гидролиза; факторы, влияющие на него. Решение расчетных задач на определение выхода продукта реакции (в %) от теоретически возможного, установление формулы и строения вещества по продуктам его сгорания (или гидролиза).
Жиры. Жиры — сложные эфиры глицерина и карбоновых кислот. Состав и строение жиров. Номенклатура и классификация жиров. Масла. Жиры в природе. Биологические функции жиров. Свойства жиров. Омыление жиров, получение мыла. Объяснение моющих свойств мыла. Гидрирование жидких жиров. Маргарин. Понятие о CMC. Объяснение моющих свойств мыла и CMC (в сравнении).
Демонстрации. Знакомство с физическими свойствами некоторых карбоновых кислот: муравьиной, уксусной, пропионовой, масляной, щавелевой, лимонной, олеиновой, стеариновой, бензойной. Возгонка бензойной кислоты. Отношение различных карбоновых кислот к воде. Сравнение кислотности среды водных растворов муравьиной и уксусной кислот одинаковой молярности. Получение приятно пахнущего сложного эфира. Отношение к бромной воде и раствору перманганата калия предельной и непредельной карбоновых кислот. Шаростержневые модели молекул сложных эфиров и изомерных им карбоновых кислот. Отношение сливочного, подсолнечного и машинного масла к водным растворам брома и перманганата калия.
Лабораторные опыты. 15. Построение моделей молекул изомерных карбоновых кислот и сложных эфиров. 16. Сравнение силы уксусной и соляной кислот в реакциях с цинком. 17. Сравнение растворимости в воде карбоновых кислот и их солей. 18. Взаимодействие карбоновых кислот с основными оксидами, основаниями, амфотерными гидроксидами и солями. 19. Растворимость жиров в воде и органических растворителях.
Экспериментальные задачи. 1. Распознавание растворов ацетата натрия, карбоната натрия, силиката натрия и стеарата натрия. 2. Распознавание образцов сливочного масла и маргарина. 3. Получение карбоновой кислоты из мыла. 4. Получение уксусной кислоты из ацетата натрия.
Практические работы. 5. Карбоновые кислоты.
Требования к уровню подготовки обучающихся
Предметные
Уметь:
называть изученные вещества по международной или «тривиальной» номенклатуре;
характеризовать строение и химические свойства изученных органических соединений;
объяснять зависимость свойств веществ от их состава и строения;
определять принадлежность к различным классам органических соединений;
использовать приобретенные знания и умения безопасного обращения с горючими веществами, лабораторным оборудованием.
Метапредметные
Уметь:
выделять и формулировать проблему;
проводить анализ изучаемого объекта, выделяя существенные и несущественные признаки;
анализировать условия и требования задачи;
определять последовательность промежуточных целей с учетом конечного результата;
определять способы взаимодействия с участниками образовательного процесса.
Тема 7 Углеводы (16 ч)
Моно-, ди- и полисахариды. Представители каждой группы.
Биологическая роль углеводов. Их значение в жизни человека и общества.
Моносахариды. Глюкоза, ее физические свойства. Строение молекулы. Равновесия в растворе глюкозы. Зависимость химических свойств глюкозы от строения молекулы. Взаимодействие с гидроксидом меди (II) при комнатной температуре и нагревании, этерификация, реакция «серебряного зеркала», гидрирование. Реакции брожения глюкозы: спиртового, молочнокислого. Глюкоза в природе. Биологическая роль глюкозы. Применение глюкозы на основе ее свойств. Фруктоза как изомер глюкозы. Сравнение строения молекул и химических свойств глюкозы и фруктозы. Фруктоза в природе и ее биологическая роль.
Дисахариды. Строение дисахаридов. Восстанавливающие и невосстанавливающие дисахариды. Сахароза, лактоза, мальтоза, их строение и биологическая роль. Гидролиз дисахаридов. Промышленное получение сахарозы из природного сырья.
Полисахариды. Крахмал и целлюлоза (сравнительная характеристика: строение, свойства, биологическая роль). Физические свойства полисахаридов. Химические свойства полисахаридов. Гидролиз полисахаридов. Качественная реакция на крахмал. Полисахариды в природе, их биологическая роль. Применение полисахаридов. Понятие об искусственных волокнах. Взаимодействие целлюлозы с неорганическими и карбоновыми кислотами — образование сложных эфиров.
Демонстрации. Образцы углеводов и изделий из них. Взаимодействие сахарозы с гидроксидом меди (II). Получение сахарата кальция и выделение сахарозы из раствора сахарата кальция. Реакция «серебряного зеркала» для глюкозы. Взаимодействие глюкозы с фуксинсернистой кислотой. Отношение растворов сахарозы и мальтозы (лактозы) к гидроксиду меди (II) при нагревании. Ознакомление с физическими свойствами целлюлозы и крахмала. Набухание целлюлозы и крахмала в воде. Получение нитрата целлюлозы.
Лабораторные опыты. 20. Ознакомление с физическими свойствами глюкозы. 21. Взаимодействие глюкозы с гидроксидом меди (II) при обычных условиях и при нагревании. 22. Взаимодействие глюкозы и сахарозы с аммиачным раствором оксида серебра. 23. Кислотный гидролиз сахарозы. 24. Качественная реакция на крахмал. 25. Знакомство с коллекцией волокон.
Экспериментальные задачи. 1. Распознавание растворов глюкозы и глицерина. 2. Определение наличия крахмала в меде, хлебе, маргарине.
Требования к уровню подготовки обучающихся
Предметные
Уметь:
называть важнейшие органические кислоты
использовать приобретенные знания и умения для безопасного обращения с токсичными веществами.
Метапредметные
Уметь:
анализировать объект, выделяя существенные и несущественные признаки;
заменять термины определениями;
самостоятельно формулировать познавательную задачу и строить свои действия в соответствии с ней;
сравнивают свои действия с эталоном, вносят, при необходимости, коррективы;
определяют последовательность промежуточных целей с учетом конечного результата.
Тема 8 Азотсодержащие органические соединения (17 ч)
Амины. Состав и строение аминов. Классификация, изомерия и номенклатура аминов. Алифатические амины. Анилин. Получение аминов: алкилирование аммиака, восстановление нитросоединений (реакция Зинина). Физические свойства аминов. Химические свойства аминов: взаимодействие с водой и кислотами. Гомологический ряд ароматических аминов. Алкилирование и ацилирование аминов. Взаимное влияние атомов в молекулах на примере аммиака, алифатических и ароматических аминов. Применение аминов.
Аминокислоты и белки. Состав и строение молекул аминокислот. Изомерия аминокислот. Двойственность кислотно-основных свойств аминокислот и ее причины. Взаимодействие аминокислот с основаниями. Взаимодействие аминокислот с кислотами, образование сложных эфиров. Образование внутримолекулярных солей (биполярного иона). Реакция поликонденсации аминокислот. Синтетические волокна (капрон, энант и др.). Биологическая роль аминокислот. Применение аминокислот.
Белки как природные биополимеры. Пептидная группа атомов и пептидная связь. Пептиды. Белки. Первичная, вторичная и третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз, качественные (цветные) реакции. Биологические функции белков. Значение белков. Четвертичная структура белков как агрегация белковых и небелковых молекул. Глобальная проблема белкового голодания и пути ее решения.
Нуклеиновые кислоты. Общий план строения нуклеотидов. Понятие о пиримидиновых и пуриновых основаниях. Первичная, вторичная и третичная структуры молекулы ДНК. Биологическая роль ДНК и РНК. Генная инженерия и биотехнология. Трансгенные формы животных и растений.
Демонстрации. Физические свойства метиламина. Горение метиламина. Взаимодействие анилина и метиламина с водой и кислотами. Отношение бензола и анилина к бромной воде. Окрашивание тканей анилиновыми красителями. Обнаружение функциональных групп в молекулах аминокислот. Нейтрализация щелочи аминокислотой. Нейтрализация кислоты аминокислотой. Растворение и осаждение белков. Денатурация белков. Качественные реакции на белки. Модели молекулы ДНК и различных видов молекул РНК. Образцы продуктов питания из трансгенных форм растений и животных; лекарств и препаратов, изготовленных с помощью генной инженерии.
Лабораторные опыты. 26. Построение моделей молекул изомерных аминов. 27. Смешиваемость анилина с водой. 28. Образование солей аминов с кислотами. 29. Качественные реакции на белки.
Требования к уровню подготовки обучающихся
Предметные
Уметь:
называть изученные вещества по международной или «тривиальной» номенклатуре;
характеризовать строение и химические свойства изученных органических соединений;
объяснять зависимость свойств веществ от их состава и строения;
определять принадлежность к различным классам органических соединений;
использовать приобретенные знания и умения безопасного обращения с горючими веществами, лабораторным оборудованием.
Метапредметные
Уметь:
выделять и формулировать проблему;
проводить анализ изучаемого объекта, выделяя существенные и несущественные признаки;
анализировать условия и требования задачи;
определять последовательность промежуточных целей с учетом конечного результата;
определять способы взаимодействия с участниками образовательного процесса.
Тема 9 Биологически активные вещества (18ч)
Витамины. Понятие о витаминах. Их классификация и обозначение. Нормы потребления витаминов. Водорастворимые (на примере витамина С) и жирорастворимые (на примере витаминов А и D) витамины. Понятие об авитаминозах, гипер- и гиповитаминозах. Профилактика авитаминозов. Отдельные представители водорастворимых витаминов (С, РР, группы В) и жирорастворимых витаминов (A, D, E). Их биологическая роль.
Ферменты. Понятие о ферментах как о биологических катализаторах белковой природы. Значение в биологии и применение в промышленности. Классификация ферментов. Особенности строения и свойств ферментов: селективность и эффективность. Зависимость активности фермента от температуры и рН среды. Особенности строения и свойств в сравнении с неорганическими катализаторами.
Гормоны. Понятие о гормонах как биологически активных веществах, выполняющих эндокринную регуляцию жизнедеятельности организмов. Классификация гормонов: стероиды, производные аминокислот, полипептидные и белковые гормоны. Отдельные представители гормонов: эстрадиол, тестостерон, инсулин, адреналин.
Лекарства. Понятие о лекарствах как химиотерапевтических препаратах. Группы лекарств: сульфамиды (стрептоцид), антибиотики (пенициллин), аспирин. Безопасные способы применения, лекарственные формы. Краткие исторические сведения о возникновении и развитии химиотерапии. Механизм действия некоторых лекарственных препаратов, строение молекул, прогнозирование свойств на основе анализа химического строения. Антибиотики, их классификация по строению, типу и спектру действия. Дисбактериоз. Наркотики, наркомания и ее профилактика.
Демонстрации. Образцы витаминных препаратов. Поливитамины. Иллюстрации фотографий животных с различными формами авитаминозов. Сравнение скорости разложения Н2О2 под действием фермента (каталазы) и неорганических катализаторов (KI, FeCl3, MnO2). Плакат или кодограмма с изображением структурных формул эстрадиола, тестостерона, адреналина. Взаимодействие адреналина с раствором FeCl3. Белковая природа инсулина (цветные реакции на белки). Плакаты или кодограммы с формулами амида сульфаниловой кислоты, дигидрофолиевой и ложной дигидрофолиевой кислот, бензилпенициллина, тетрациклина, цефотаксима, аспирина.
Лабораторные опыты. 30. Обнаружение витамина А в растительном масле. 31. Обнаружение витамина С в яблочном соке. 32. Обнаружение витамина D в желтке куриного яйца. 33. Ферментативный гидролиз крахмала под действием амилазы. 34. Разложение пероксида водорода под действием каталазы. 35. Действие дегидрогеназы на метиленовый синий. 36. Испытание растворимости адреналина в воде и соляной кислоте. 37. Обнаружение аспирина в готовой лекарственной форме (реакцией гидролиза или цветной реакцией с сульфатом бериллия).
Практикум :
1. Качественный анализ органических соединений. 2. Углеводороды. 3. Спирты и фенолы. 4. Альдегиды и кетоны. 5. Карбоновые кислоты. 6. Углеводы. 7. Амины, аминокислоты, белки. 8. Идентификация органических соединений. 9. Действие ферментов на различные вещества. 10. Анализ некоторых лекарственных препаратов (аспирина, парацетамола).
Проекты по химии:
Анализ белков на полноценность
Анализ качественного состава жевательных резинок основных производителей и их влияние на организм человека.
Буферные растворы в живых организмах.
Буферные системы в организме человека.
Вклад ученых – химиков в победу над фашизмом в Великой Отечественной войне.
Диффузия в тканях растений (окрашивание цветов).
Изучение секретов приготовления клея
Изучение ферментативной активности биологических жидкостей.
Именные реакции в органической химии.
Ферменты – что это?
Цветик-семицветик. Исследование цветовой реакции растительных пигментов группы антоцианов на изменение условий окружающей среды
Что содержится в чашке чая?
Яды и противоядия.
Требования к уровню подготовки обучающихся
Предметные
Уметь:
называть важнейшие искусственные волокна, пластмассы; синтетические волокна, каучуки, пластмассы.
называть вещества: гормоны, ферменты, витамины, лекарства и давать им характеристику;
использовать приобретенные знания и умения для безопасного обращения с токсичными веществами.
Метапредметные
Уметь:
анализировать объект, выделяя существенные и несущественные признаки;
заменять термины определениями;
самостоятельно формулировать познавательную задачу и строить свои действия в соответствии с ней;
сравнивают свои действия с эталоном, вносят, при необходимости, коррективы;
определяют последовательность промежуточных целей с учетом конечного результата.
Общая химия. 11 класс, всего 170 ч, 5 ч в неделю.
Тема 1. Строение атома (17 ч)
Атом - сложная частица. Атом — сложная частица. Доказательства сложности строения атома: катодные и рентгеновские лучи, фотоэффект, радиоактивность. Открытие электрона, протона и нейтрона. Модели строения атома (Томсона, Резерфорда, Бора). Макромир и микромир. Квантово-механические представления о строении атома.
Состояние электронов в атоме. Нуклоны: протоны и нейтроны. Нуклиды. Изобары и изотопы. Квантово-механические представления о природе электрона. Понятие об электронной орбитали и электронном облаке. Квантовые числа: главное, орбитальное (побочное), магнитное и спиновое. Правила заполнения энергетических уровней и орбиталей электронами. Принцип минимума энергии, запрет Паули, правило Хунда, правило Клечковского. Электронные конфигурации атомов и ионов. Особенности электронного строения атомов хрома, меди, серебра и др.
Валентные возможности атомов химических элементов. Валентные электроны. Валентные возможности атомов химических элементов, обусловленные различными факторами. Сравнение понятий «валентность» и «степень окисления».
Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома. Предпосылки открытия Периодического закона. Открытие закона. Первая формулировка Периодического закона. Структура Периодической системы элементов. Современные представления о химическом элементе. Вторая формулировка Периодического закона. Периодическая система и строение атома. Физический смысл порядкового номера элемента, номеров группы и периода. Периодическое изменение свойств элементов: радиуса атома, электроотрицательности. Причины изменения металлических и неметаллических свойств элементов в группах и периодах, в том числе и в больших и сверхбольших. Особенности строения атомов актиноидов и лантаноидов. Третья формулировка Периодического закона. Значение Периодического закона и Периодической системы для развития науки и понимания химической картины мира
Демонстрации. Фотоэффект. Катодные лучи (электронно-лучевые трубки), модели электронных облаков (орбиталей) различной формы. Различные варианты таблиц периодической системы химических элементов Д. И. Менделеева. Образцы простых веществ, оксидов и гидроксидов элементов 3-го периода и демонстрация их свойств.
Требования к уровню подготовки обучающихся
Предметные:
Уметь:
объяснять основные химические понятия;
формулировать и понимать суть периодического закона Д.И.Менделеева;
определять заряд иона;
характеризовать элементы малых периодов по их положению в ПСХЭ.
Метапредметные
Уметь:
выделять и формулировать проблему; искать рациональные пути ее решения;
применять методы информационного поиска;
анализировать объект, выделяя существенные и несущественные свойства;
определять последовательность промежуточных целей с учетом конечного результата;
работать в коллективе, брать на себя ответственность, учитывать наличие других точек зрения на решение поставленной задачи, принимать правильное решение.
Тема 2. Строение вещества. Дисперсные системы и растворы (27 ч)
Химическая связь. Единая природа химической связи. Понятие о химической связи как процессе взаимодействия атомов с образованием молекул, ионов и радикалов. Виды химической связи. Аморфные и кристаллические вещества. Ионная химическая связь. Дипольный момент связи. Свойства веществ с ионной кристаллической решеткой. Ковалентная связь. Метод валентных связей в образовании ковалентной связи. Электроотрицательность и разновидности ковалентной связи по этому признаку: полярная и неполярная. Способ перекрывания электронных орбиталей и классификация ковалентных связей по этому признаку: σ- и π- связи. Кратность ковалентных связей и их классификация по этому признаку: одинарная, двойная, и т. д. Механизмы образования ковалентной связи: обменный и донорно-акцепторный. Основные свойства ковалентной связи: насыщаемость, направленность, дипольный момент. Полярность связи и полярность молекулы. Кристаллическое строение веществ с этим типом связи, их физические свойства. Металлическая связь и ее особенности. Физические свойства металлов как функция металлической связи и металлической кристаллической решетки Водородная связь и механизм ее образования. Межмолекулярная и внутримолекулярная водородные связи. Физические свойства веществ с водородной связью. Биологическая роль во- дородной связи в организации структур биополимеров. Ван-дер-ваальсово взаимодействие. Ориентационное, индукционное и дисперсионное взаимодействие между молекулами. Условность разделения веществ по типам связи, единая природа химической связи.
Гибридизация орбиталей. Геометрия молекул. Теория гибридизации и отталкивания валентных пар. Типы гибридизации электронных орбиталей и геометрия органических и неорганических молекул.
Теория строения химических соединений. Предпосылки создания теории строения химических соединений: работы предшественников А. М. Бутлерова (Ж. Б. Дюма, Ф. Велер, Ш. Ф. Жерар, Ф. А. Кекуле), съезд естествоиспытателей в г. Шпейере. Личностные качества А. М. Бутлерова. Основные положения теории химического строения органических соединений и современной теории строения. Изомерия в органической и неорганической химии. Взаимное влияние атомов в молекулах органических и неорганических веществ. Основные направления развития теории строения органических соединений (зависимость свойств веществ не только от химического, но и от их электронного и пространственного строения). Индукционный и мезомерный эффекты. Стереорегулярность.
Диалектические основы общности двух ведущих теорий химии. Диалектические основы общности периодического закона Д. И. Менделеева и теории строения А. М. Бутлерова в становлении (работы предшественников, накопление фактов, участие в съездах, русский менталитет), предсказании (новые элементы — Ga, Se, Ge и новые вещества — изомеры) и развитии (три формулировки).
Полимеры органические и неорганические. Полимеры. Основные понятия химии высокомолекулярных соединений: «мономер», «полимер», «макромолекула», «структурное звено», «степень полимеризации», «молекулярная масса». Способы получения полимеров: реакции полимеризации и поликонденсации. Строение полимеров: геометрическая форма макромолекул, кристалличность и аморфность, стереорегулярность. Полимеры органические и неорганические. Каучуки. Пластмассы. Волокна. Биополимеры: белки и нуклеиновые кислоты. Неорганические полимеры атомного строения (аллотропные модификации углерода, кристаллический кремний, селен и теллур цепочечного строения, диоксид кремния и др.) и молекулярного строения (сера пластическая и др.).
Дисперсные системы. Чистые вещества и смеси. Классификация химических веществ по чистоте. Состав смесей. Растворы. Растворимость веществ. Классификация растворов в зависимости от состояния растворенного вещества (молекулярные, молекулярно-ионные, ионные). Типы растворов по содержанию растворенного вещества. Концентрация растворов. Понятие «дисперсная система». Классификация дисперсных систем в зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы, а так же по размеру частиц. Грубодисперсные системы: эмульсии и суспензии. Тонкодисперсные коллоидные системы: золи и гели. Эффект Тиндаля. Коагуляция в коллоидных растворах. Синерезис в гелях.
Расчетные задачи. 1. Расчеты по химическим формулам. 2. Расчеты, связанные с понятиями «массовая доля» и «объемная доля» компонентов смеси. 3. Вычисление молярной концентрации растворов.
Демонстрации. Модели кристаллических решеток веществ с различным типом связей. Модели молекул различной геометрии. Модели кристаллических решеток алмаза и графита. Модели молекул изомеров структурной и пространственной изомерии. Модели кристаллических решеток металлов. Модели из воздушных шаров, отражающие пространственное расположение sp3-, sp2-, sp- гибридных орбиталей в молекулах органических и неорганических веществ.
Коллекция пластмасс и волокон. Образцы неорганических полимеров: серы пластической, фосфора красного, кварца и др. Модели молекул белков и ДНК. Образцы различных систем с жидкой средой. Коагуляция. Синерезис. Эффект Тиндаля.
Лабораторные опыты. 1. Знакомство с коллекциями пищевых, медицинских и биологических гелей и золей. 2. Получение коллоидного раствора хлорида железа (ІІІ).
Требования к уровню подготовки обучающихся
Предметные
Уметь:
объяснять зависимость свойств веществ от их состава;
характеризовать чистые вещества и смеси;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для приготовления растворов заданной концентрации;
пользоваться лабораторной посудой; четко и правильно выполнять химический эксперимент.
Метапредметные
Уметь:
выделять качественные и количественные характеристики веществ;
анализировать условие поставленной задачи,
самостоятельно составлять план и последовательность действий;
развивают способность при помощи вопросов добывать недостающую информацию.
Тема 3. Химические реакции (37ч)
Классификация химических реакций в органической и неорганической химии. Понятие о химической реакции, отличие ее от ядерной реакции. Расщепление ядер, термоядерный синтез, ядерный обмен. Аллотропные и полиморфные превращения веществ. Классификация реакций в неорганической химии по числу и составу реагирующих веществ (разложения, соединения, замещения, обмена). Классификация химических реакций в органической химии (присоединения, замещения, отщепления, изомеризации). Классификация реакций по тепловому эффекту, по фазовому составу, по участию катализатора. Обратимые и необратимые реакции. Типы реагентов и понятие о механизмах химических реакций (ионном и свободнорадикальном). Окислительно-восстановительные реакции и реакции, идущие без изменения степеней окисления элементов. Межмолекулярные и внутримолекулярные окислительно-восстановительные реакции. Реакции диспропорционирования. Методы составления окислительно-восстановительных реакций: метод электронного баланса и метод полуреакций. Основные понятия химической термодинамики. Первое начало термодинамики. Тепловой эффект химической реакции. Закон Гесса и следствия из него. Теплота (энтальпия) образования вещества. Термохимические расчеты. Понятие энтропии. Второе начало термодинамики. Свободная энергия Гиббса. Расчеты самопроизвольного протекания химической реакции.
Скорость химических реакций. Предмет химической кинетики. Понятие скорости химической реакции. Кинетическое уравнение реакции и константа скорости химической реакции. Факторы, влияющие на скорость химической реакции (природа реагирующих веществ, концентрация, температура, поверхность соприкосновения веществ).
Понятие о катализаторах и катализе. Гомогенный и гетеро- генный катализ. Ферменты. Ферментативный катализ и его механизм. Промоторы. Каталитические яды. Ингибиторы. Механизм действия катализаторов.
Обратимость химических реакций. Обратимые химические реакции, изменение энергии Гиббса в обратимом процессе. Химическое равновесие и его динамический характер. Константа химического равновесия. Принцип Ле Шателье. Смещение химического равновесия.
Электролитическая диссоциация. Электролиты и неэлектролиты. Электролитическая диссоциация, механизм диссоциации веществ с различными видами связи. Сильные и слабые электролиты. Степень диссоциации и ее зависимость от различных факторов. Константа диссоциации. Произведение растворимости. Ионное произведение воды. Понятие рН. Водородный показатель.
Гидролиз. Гидролиз как обменный процесс. Обратимый и необратимый гидролиз органических и неорганических веществ. Гидролиз солей. Гидролиз органических соединений, как химическая основа обмена веществ. Гидролиз АТФ, как основа энергетического обмена в живых организмах. Гидролиз органических соединений в промышленности (омыление жиров, по- лучение гидролизного спирта и т. д.). Усиление и подавление обратимого гидролиза. Значение гидролиза в промышленности и в быту.
Расчетные задачи. 1. Расчеты по термохимическим уравнениям. 2. Вычисление теплового эффекта реакции по теплоте образования реагирующих веществ и продуктов реакции. 3. Определение рН раствора заданной молярной концентрации. 4. Расчет средней скорости реакции по концентрациям реагирующих веществ. 5. Вычисления с использованием понятия «температурный коэффициент скорости реакции». 6. Нахождение константы равновесия реакции по равновесным концентрациям и определение исходных концентраций веществ.
Демонстрации. Аллотропные превращения серы и фосфора. Реакции, идущие с образованием газа, осадка или воды. Окислительно-восстановительные реакции в неорганической химии (взаимодействие цинка с растворами соляной кислоты и сульфата меди (ІІ). Окислительно-восстановительные реакции в органической химии (окисление альдегида в карбоновую кислоту — реакция «серебряного зеркала» или реакция с гидроксилом меди (ІІ), окисление этанола на медном катализаторе). Изучение зависимости скорости химической реакции от концентрации веществ, температуры (взаимодействие тиосульфата натрия с сер- ной кислотой), поверхности соприкосновения веществ (взаимодействие соляной кислоты с гранулами и порошками алюминия или цинка). Проведение каталитических реакций разложения пероксида водорода, горения сахара, взаимодействия йода и алюминия. Коррозия железа в водной среде с уротропином и без него. Наблюдение смещения химического равновесия в системе: FeCl3 + KSCN Fe(SCN)3 + 3KCl Сравнение электропроводности растворов электролитов. Смещение равновесия диссоциации слабых кислот. Индикаторы и изменение их окраски в разных средах. Ионные реакции и условия их протекания. Гидролиз карбонатов, сульфатов и силикатов щелочных металлов, нитрата свинца (ІІ) или цинка, хлорида аммония. Сернокислый и ферментативный гидролиз углеводов.
Лабораторные опыты. 3. Разложение пероксида водорода с помощью оксида меди (ІІ) и каталазы 4. Знакомство с коллекцией СМС, содержащих энзимы. 5. Реакции, идущие с образованием осадка, газа или воды для органических и неорганических электролитов 6. Различные случаи гидролиза солей. Исследование среды растворов с помощью индикаторной бумаги.
Практическая работа № 1. Скорость химических реакций. Химическое равновесие.
Практическая работа № 2. Решение экспериментальных задач по теме "Гидролиз"
Требования к уровню подготовки обучающихся
Предметные
Уметь:
объяснять понятия: «электролитическая диссоциация», «теория электролитической диссоциации», «окислитель», «восстановитель», «окисление», «восстановление», «скорость химической реакции», «катализ», «химическое равновесие».
определять заряд иона; характер среды в водных растворах неорганических соединении;
объяснять зависимость скорости химической реакции и положения химического равновесия от различных факторов;
пользоваться лабораторной посудой; четко и правильно выполнять химический эксперимент.
Метапредметные
Уметь:
выделять и формулировать проблему; находить рациональные пути ее решения;
анализировать, находить существенное и несущественное;
проводить самоанализ своих достижений, вносить корректировки;
планировать общие способы работы.
Тема 4. Вещества и их свойства (74 ч)
Классификация неорганических веществ. Вещества простые и сложные. Благородные газы. Сравнительная характеристика простых веществ: металлов и неметаллов, относительность этой классификации. Сложные вещества: бинарные соединения (оксиды, галогениды, сульфиды и т. д.), гидроксиды, соли. Понятие о комплексном соединении. Основы координационной теории строения комплексных соединений А. Вернера. Донорно-акцепторное взаимодействие комплексообразователей и лигандов. Координационное число комплексообразователя. Внутренняя и внешняя сфера комплексов. Диссоциация комплексных соединений. Применение комплексных соединений в химическом анализе и в промышленности, их роль в природе.
Классификация органических веществ. Классификация органических веществ по строению углеродной цепи (ациклические и циклические, насыщенные и ненасыщенные, карбоциклические и гетероциклические, ароматические углеводороды). Углеводороды (алканы, алкены, алкины, циклоалканы, алкадиены, арены, галогенопроизводные углеводородов). Функциональные группы (гидроксильная, карбонильная, карбоксильная, нитрогруппа, аминогруппа) и классификация веществ по этому признаку. Гетерофункциональные соединения. Гетероциклические соединения.
Металлы. Положение металлов в Периодической системе Д. И. Менделеева. Особенности строения атомов и кристаллов. Полиморфизм. Общие физические свойства металлов. Ферромагнетики, парамагнетики и диамагнетики. Электрохимический ряд напряжений металлов. Стандартный водородный электрод. Стандартные электродные потенциалы. Общие химические свойства металлов: взаимодействие с неметаллами, водой, бинарными соединениями, кислотами, солями. Взаимодействие некоторых металлов с растворами щелочей. Взаимодействие активных металлов с органическими соединениями. Особенности реакций металлов с азотной и концентрированной серной кислотами.
Коррозия металлов. Понятие коррозии. Химическая и электрохимическая коррозия и способы защиты металлов от коррозии
Общие способы получения металлов. Металлы в природе. Основные способы получения металлов (пирометаллургия, гидрометаллургия, электрометаллургия). Электролиз, как окислительно-восстановительный процесс. Электролиз расплавов электролитов. Электролиз растворов электролитов с инертными и активными электродами. Использование электролиза в промышленности. Гальванические элементы. Процессы на электродах в гальваническом элементе. Аккумулятор. Топливные элементы.
Металлы главных подгрупп. Щелочные металлы, общая характеристика на основе положения в Периодической системе элементов Д. И. Менделеева и строения атомов. Получение, физические и химические свойства, применение щелочных металлов и их соединений. Бериллий, магний, щелочноземельные металлы, их общая характеристика на основе положения в Периодической системе элементов Д. И. Менделеева и строения атомов. Получение, физические и химические свойства, применение щелочноземельных металлов и их соединений. Алюминий, строение атома, физические и химические свойства, получение и применение.
Металлы побочных подгрупп. Характеристика металлов побочных подгрупп по их положению в Периодической системе элементов Д. И. Менделеева и строению атомов. Медь: физические и химические свойства, получение и применение. Важнейшие соединения меди. Физические и химические свойства, получение и применение цинка. Характеристика важнейших соединений (оксида и гидроксида цинка) Физические и химические свойства, получение и применение хрома. Характеристика важнейших соединений (оксида и гидроксида хрома (ІІІ), дихроматов и хроматов щелочных метал- лов). Особенности восстановления дихроматов в зависимости от среды растворов. Физические и химические свойства, получение и применение марганца. Характеристика важнейших соединений: оксидов, гидроксидов, солей. Особенности восстановления перманганатов в зависимости от среды растворов.
Неметаллы. Положение неметаллов в Периодической системе Д. И. Менделеева. Особенности строения атомов и кристаллов. Аллотропия. Благородные газы. Окислительные и восстановительные свойства неметаллов. Общая характеристика водородных соединений неметаллов. Общая характеристика оксидов и гидроксидов неметаллов.
Галогены. Строение атомов галогенов, их сравнительная характеристика. Свойства простых веществ образованных галогенами. Окислительные свойства галогенов. Галогеноводороды, их свойства, сравнительная характеристика. Хлор и его соединения, нахождение в природе, получение, свойства, применение. Хлороводород и соляная кислота. Хлориды. Кислородные соединения хлора.
Халькогены. Нахождение кислорода и серы в природе, получение их в промышленности и лаборатории. Свойства кислорода и серы: аллотропия и физические свойства аллотропных модификаций; окислительные свойства кислорода и серы в реакциях с простыми веществами. Восстановительные свойства серы. Окисление кислородом сложных веществ. Окислительные свойства озона. Применение кислорода и озона. Применение серы. Сероводород, нахождение в природе, получение, строение молекулы и свойства: физические и химические. Сероводородная кислота и сульфиды. Оксид серы (ІV), его свойства. Сернистая кислота и ее соли. Серная кислота: промышленное производство, физические и химические свойства (окислительные и обменные). Применение серной кислоты. Соли серной кислоты.
Азот. Нахождение в природе, получение. Строение молекулы. Окислительные и восстановительные свойства азота. Применение азота. Аммиак: получение, строение молекулы, свойства (основные, реакции комплексообразования, восстановительные, окислительные, реакции с органическими веществами и с углекислым газом). Соли аммония и их применение. Оксиды азота, их строение и свойства. Азотная кислота: получение, строение молекулы и свойства. Нитраты, их термическое раз- ложение. Распознавание нитратов и их применение.
Фосфор. Нахождение в природе, получение. Аллотропия и физические свойства модификаций. Окислительные свойства (реакции с металлами) и восстановительные свойства фосфора (реакции с галогенами, кислородом, концентрированной серной и азотной кислотами). Оксид фосфора (V). Фосфорные кислоты и их соли.
Углерод. Нахождение в природе. Аллотропия и физические свойства модификаций (повторение). Химические свойства углерода: восстановительные (взаимодействие с галогенами, кислородом, серой, азотом, водой, оксидом меди (ІІ), концентрированной серной и азотной кислотами) и окислительные (взаимодействие с металлами, водородом, кремнием, бором). Получение, свойства и применение оксидов углерода. Угольная кислота и ее соли.
Кремний. Нахождение кремния в природе и его получение. Аллотропия и свойства аллотропных модификаций кремния. Восстановительные (реакции с галогенами, кислородом, растворами щелочей) и окислительные свойства кремния (реакции с металлами). Применение кремния. Оксид кремния, кремниевая кислота и ее соли. Силикатная промышленность.
Кислоты органические и неорганические. Состав, классификация и номенклатура неорганических и органических кислот. Получение важнейших органических и неорганических кислот. Химические свойства (реакции с металлами, с оксидами металлов, с основаниями, с солями, со спиртами). Окислительно-восстановительные свойства кислот. Особенности свойств серной и азотной кислот, муравьиной и щавелевой кислоты.
Основание органические и неорганические. Состав, классификация, номенклатура неорганических и органических оснований. Основные способы получения гидроксидов металлов (щелочей — реакциями металлов и их оксидов с водой, нерастворимых оснований — реакцией обмена). Получение аммиака и аминов. Химические свойства оснований: щелочей (реакции с кислотами, кислотными оксидами, растворами солей, с простыми веществами, с галоидопроизводными углеводородов, фенолом, жирами); нерастворимых оснований (реакции с кислотами, реакции разложения).
Амфотерные органические и неорганические соединения. Способы получения амфотерных соединений (амфотерных оснований и аминокислот), их химические свойства. Относительность деления соединений на кислоты и основания.
Генетическая связь между классами органических и неорганических соединений. Понятия «генетической связи» и «генетического ряда». Основные признаки генетического ряда. Генетические ряды металлов (на примере кальция и железа) и неметаллов (на примере серы и кремния) и переходного элемента (на примере алюминия). Генетические ряды и генетическая связь в органической химии. Единство мира веществ.
Расчетные задачи. 1. Вычисление массы или объема продуктов реакции по известной массе или объему исходного вещества, содержащего примеси. 2. Вычисление массы исходного вещества, если известен практический выход и массовая его доля от теоретически возможного. 3. Вычисления по химическим уравнениям реакций, если одно из реагирующих веществ дано в избытке. 4. Определение молекулярной формулы вещества по массовым долям элементов. 5. Определение молекулярной формулы газообразного вещества по известной относительной плотности и массовым долям элементов. 6. Нахождение молекулярной формулы вещества по массе (объему) продуктов сгорания. 7. Комбинированные задачи.
Демонстрации. Коллекция «Классификация неорганических веществ». Получение комплексных органических и неорганических соединений. Демонстрация сухих кристаллогидратов. Коллекция «Классификация органических веществ». Модели кристаллических решеток металлов. Коллекция металлов с разными физическими свойствами. Взаимодействие металлов с неметаллами (цинка с серой, алюминия с йодом), с растворами кислот и щелочей. Горение металлов (цинка, железа, магния в кислороде). Взаимодействие азотной и концентрированной серной кис- лот с медью. Коррозия металлов в различных условиях и методы защиты от нее. Коллекция руд. Восстановление меди из оксида меди (ІІ) углем и водородом. Алюминотермия. Взаимодействия сульфата меди (ІІ) с железом. Составление гальванических элементов. Электролиз раствора сульфата меди (ІІ). Образцы щелочных металлов. Реакция окрашивания пламени солями щелочных металлов. Взаимодействие лития и натрия с водой и этиловым спиртом. Взаимодействие натрия с серой. Образцы металлов IIA группы. Взаимодействие кальция с водой. Горение магния в воде и твердом углекислом газе. Качественные реакции на катионы магния, кальция, бария. Реакции окрашивания пламени солями металлов IIА группы. Использование гидроксида меди (II) в качественных реакциях органических соединений. Переход хромата в дихромат и обратно. Получение и исследование свойств гидроксида хрома (ІІІ). Окислительные свойства дихромата калия. Окислительные свойства перманганата калия в реакциях с органическими и неорганическими соединениями. Модели кристаллических решеток иода, алмаза, графита. Взрыв смеси водорода с кислородом (гремучего газа). Горение серы, фосфора и угля в кислороде. Обесцвечивание бромной (иодной) воды этиленом. Галогены (простые вещества). Окислительные свойства хлорной воды. Получение соляной кислоты и ее свойства. Получение кислорода. Получение оксидов горением простых и сложных веществ. Взаимодействие серы с металлами (алюминием, цинком, железом). Получение сероводорода и сероводородной кислоты, доказательство наличия сульфидиона в растворе. Свойства серной кислоты. Схема промышленной установки фракционной перегонки воздуха. Получение и разложение хлорида аммония. Получение оксида азота (ІV) реакцией взаимодействия меди с концентрированной азотной кислотой. Взаимодействие оксида азота (ІV) с водой. Разложение нитрата натрия, горение черного пороха. Горение фосфора, растворение оксида фосфора (V) в воде и исследование полученного раствора индикатором. Коллекция природных со- единений углерода. Кристаллические решетки алмаза и графита. Адсорбция оксида азота (ІV) активированным углем. Переход карбоната в гидрокарбонат и обратно. Коллекции природных силикатов и продукции силикатной промышленности. Взаимо- действие концентрированных азотной и серной кислот, а также разбавленной азотной кислоты с медью. Реакция «серебряного зеркала» для муравьиной кислоты. Взаимодействие аммиака и метиламина с хлороводородом и водой. Взаимодействие рас- твора гидроксида натрия с амфотерным гидроксидом цинка или алюминия. Осуществление превращений
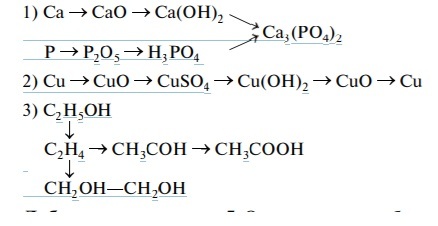
Лабораторные опыты. 7. Ознакомление с образцами представителей разных классов неорганических веществ. 8. Взаимодействие многоатомных спиртов и глюкозы с фелинговой жидкостью. 9. Качественные реакции на ионы Fe2+ и Fe3+. 10. Ознакомление с образцами представителей разных классов органических веществ. 11. Взаимодействие металлов с растворами кислот и солей. 12. Ознакомление с коллекцией руд. 13. Ознакомление с коллекцией химических источников тока (батарейки, свинцовые аккумуляторы и т. д.). 14. Взаимодействие алюминия с растворами кислот и щелочей. 15. Получение и изучение свойств гидроксида алюминия. 16. Качественные реакции на катионы меди. 17. Разложение гидроксида меди (II). 18. Получение и исследование свойств гидроксида цинка. 19. Качественные реакции на галогенид-ионы. 20. Ознакомление с коллекцией природных соединений серы. 21. Качественные реакции на сульфид-, сульфит- и сульфат-анионы. 22. Качественная реакция на ион аммония. 23. Распознавание нитратов. 24. Качественная реакция на фосфат- анион. 25. Получение углекислого газа взаимодействием мрамора с соляной кислотой и исследование его свойств. 26. Качественная реакция на карбонат-анион. 27. Получение кремниевой кислоты взаимодействием раствора силиката натрия с сильной кислотой. 28. Растворение кремниевой кислоты в щелочи.
Практическая работа № 3. Получение газов и изучение их свойств.
Практическая работа № 4. Решение экспериментальных задач по органической химии.
Практическая работа № 5. Решение экспериментальных задач по неорганической химии.
Практическая работа № 6 Сравнение свойств неорганических и органических соединений
Практическая работа № 7 Генетическая связь между классами неорганических и органических соединений
Требования к уровню подготовки обучающихся
Предметные
Уметь:
объяснять химические свойства: кислот, щелочей, солей, металлов и их сплавов.
называть изученные вещества по «тривиальной» или международной номенклатуре;
определять принадлежность веществ к различным классам;
объяснять зависимость свойств веществ от их состава и строения;
выполнять химический эксперимент.
Метапредмедные
Уметь:
выделять и формулировать проблему; находить рациональные пути ее решения;
анализировать, находить существенное и несущественное;
проводить самоанализ своих достижений, вносить корректировки;
представлять конкретное содержание и представлять его в устной и письменной форме;
планировать общие способы работы.
Тема 5. Химия и общество (12 ч)
Химия и производство. Химическая промышленность. Химическая технология. Сырье для химической промышленности. Вода в химической промышленности. Энергия для химического производства. Научные принципы химического производства. Защита окружающей среды и охрана труда при химическом производстве. Производство аммиака и метанола в сравнении. Биотехнология. Нанотехнология.
Химия и сельской хозяйство. Основные направления химизации сельского хозяйства. Удобрения и их классификация. Химическая мелиорация почв. Пестициды и их классификация. Химизация животноводства.
Химия и проблемы окружающей среды. Основные факторы химического загрязнения окружающей среды. Охрана атмосферы, водных ресурсов, земельных ресурсов от химического загрязнения.
Химия и повседневная жизнь. Лекарства. Моющие и чистящие средства. Химические средства гигиены и косметики. Международная символика по уходу за текстильными изделиями. Маркировка на упаковках пищевых продуктов и информация, которую она символизирует. Демонстрации. Видеофрагменты по производству аммиака и метанола. Слайды и другие видеоматериалы, иллюстрирующие био- и нанотехнологии. Коллекция «Минеральные удобрения». Коллекция пестицидов. Видеофрагменты по химической мелиорации почв и химизации животноводства. Видеофрагменты и слайды экологической тематики. Домашняя, автомобильная аптечки и аптечка химического кабинета. Коллекция моющих и чистящих средств.
Лабораторные опыты. 29. Ознакомление с образцами средств бытовой химии и лекарственных препаратов, изучение инструкций к ним по правильному и безопасному применению. 30. Изучение международной символики по уходу за текстильными изделиями и маркировки на упаковках пищевых продуктов.
Проекты . Примерные темы.
Вредна ли губная помада?
Гальванопластика и гальваностегия.
Где можно использовать отработавшие автомобильные шины?
География химических названий.
Значение растворов для биологии и медицины
Искусство фотографии и химия
Как выделяют эфирные масла из растений
Какие вещества называют душистыми?
Какие волокна можно получить из целлюлозы?
Какие масла называют эфирными?
Какие молекулы можно назвать гигантами?
Токсиканты и аллергены в окружающей среде.
Уникальный мед.
Химические вещества вокруг нас.
Чем дамы пудрят носик?
Чем можно заменить натуральный каучук?
Учебно-тематический план 10 класс,170 часов.
| Наименование темы | Всего часов | Практические работы | Контрольные работы |
| Введение | 9 |
|
|
| Тема 1. Строение и классификация органических соединений | 15 |
| Контрольная работа № 1 по теме :«Строение и классификация органических соединений» |
| Тема 2. Химические реакции в органической химии | 10 |
| Контрольная работа № 2 по теме : « Химические реакции в органической химии» |
| Тема 3. Углеводороды | 36 | Практическая работа № 1 «Качественный анализ органических соединений» Практическая работа № 2 «Получение этилена и изучение его свойств» | Контрольная работа №3 по теме "Углеводороды" |
| Тема 4. Спирты и фенолы | 14 | Практическая работа № 3 «Спирты» |
|
| Тема 5 . Альдегиды. Кетоны. | 14 | Практическая работа № 4 «Альдегиды и кетоны» | Контрольная работа № 4 по теме: «Спирты. Фенолы. Карбонильные соединения» |
| Тема 6 . Карбоновые кислоты, сложные эфиры и жиры | 18 | Практическая работа № 5 «Карбоновые кислоты» | Контрольная работа № 5 «Карбоновые кислоты, сложные эфиры, жиры». |
| Тема 7 . Углеводы | 16 | Практическая работа № 6 «Углеводы» | Контрольная работа № 6 «Углеводы» |
| Тема 8. Азотсодержащие органические соединения | 17 | Практическая работа № 7 «Амины. Аминокислоты. Белки» Практическая работа № 8 «Идентификация органических веществ» | Контрольная работа № 7 «Азотсодержащие органические соединения» |
| Тема 9. Биологически активные вещества | 18 | Практическая работа № 9 "Действие ферментов на различные вещества"Практическая работа № 10. Анализ некоторых лекарственных препаратов (аспирина, парацетамола). | Итоговая контрольная работа за курс 10 класса |
| Резерв | 3 |
|
|
Учебно-тематический план 11 класс,170 часов.
| Наименование темы | Всего часов | Практические работы | Контрольные работы |
| Тема 1. Строение атома. | 17 |
| Контрольная работа №1 по теме «Строение атома». |
| Тема 2.Строение вещества. Дисперсные системы и растворы. | 27 |
| Контрольная работа №2 по теме «Строение вещества. Дисперсные системы и растворы». |
| Тема 3. Химические реакции. | 37 | Практическая работа №1 «Скорость химических реакций. Химическое равновесие». Практическая работа №2 Решение экспериментальных задач по теме «Гидролиз». | Контрольная работа №3 по теме «Химические реакции». |
| Тема 4. Вещества и их свойства. | 74 | Практическая работа №3 «Получение, собирание, распознавание газов и изучение их свойств». Практическая работа №4 Решение экспериментальных задач по органической химии. Практическая работа №5 Решение экспериментальных задач по неорганической химии. Практическая работа №6 Сравнение свойств органических и неорганических соединений. Практическая работа №7 Генетическая связь между классами неорганических и органических соединений. | Контрольная работа №4 по теме «Химия элементов». Контрольная работа № 5 по теме «Вещества и их свойства» |
| Тема 5 .Химия и общество. | 12 |
|
|
| Резерв | 3 |
|
|
Учебно-методическое и материально-техническое обеспечение учебного предмета химия
|
Дидактический и раздаточный материал:
10 класс Контрольные работы Теория строения органических соединений Кислородсодержащие соединения и их нахождение в живой природе Вывод молекулярных формул веществ. Тестовые работы Виды изомерии. Алканы. Алкены. Алкины. Алкадиены. Ароматические углеводороды. Предельные одноатомные спирты. Многоатомные спирты. Альдегиды. Карбоновые кислоты. Сложные эфиры. Амины. Аминокислоты. 11 класс Контрольные работы Теоретические основы химии Гидролиз неорганических и органических соединений. Классификация химических реакций в неорганической и органической химии. Тестовые работы в формате ЕГЭ Строение атома Химическая связь в неорганической и органической химии. Электролитическая диссоциация. Ионные уравнения реакций. Классификация химических реакций в неорганической и органической химии. Металлы Неметаллы. Сборник КИМов ЕГЭ |
| Презентации 10 класс Предмет органической химии. Виды изомерии. Алканы. Метан. Природные источники углеводородов. Нефть. Алкены. Этилен. Алкины. Ацетилен. Диеновые углеводороды. Каучук. Бензол. Предельные одноатомные спирты. Многоатомные спирты. Альдегиды. Карбоновые кислоты. Сложные эфиры. Жиры. Амины. Анилин. Аминокислоты. Белки. Углеводы Полимеры 11 класс 1. Химическая связь в неорганической и органической химии. 2. Способы выражения концентрации растворов 3. Дисперсные системы. Гидролиз неорганических и органических соединений. 5. Скорость химической реакции 6. Генетическая связь между классами неорганических и органических соединений. 7. Классификация химических реакций в неорганической и органической химии.
|
| Учебно-практическое оборудование: Штатив лабораторный химический - 14 шт. Комплект для демонстрационных опытов по химии универсальный Прибор для опытов по химии с электрическим током Прибор для получения газов Линейный источник питания - 14шт. Весы электронные Магнитная мешалка Комплект мерной посуды Спиртовка Комплект электроснабжения кабинета химии Весы учебные с разновесами Весы электронные Комплект моделирования молекул неорганических соединений Комплект моделирования молекул органических соединений Набор посуды и принадлежностей для лабораторных работ по химии – 25шт. Набор склянок для растворов реактивов Коллекции Алюминий Волокна Каменный угль и продукты его переработки Коллекция видов стекла и изделия из стекла Металлы. Минералы и горные породы Нефть и продукты ее переработки Пластмассы Топливо Чугун и сталь Шкала твердости Модели Кристаллическая решетка каменной соли Модель кристаллической решетки алмаза Модель кристаллической решетки графита Модель кристаллической решетки железа Модель кристаллической решетки йода Модель кристаллической решетки льда Модель кристаллической решетки меди Модель кристаллической решетки углекислого газа Модель кристаллической решетки магния Набор моделей атомов для составления моделей молекул Таблицы Комплект таблиц по курсу неорганической химии Комплект таблиц по курсу органической химии Портреты ученых-химиков |












