Тема урока: Щелочные металлы.
Цель урока: Дать общую характеристику щелочных металлов
Задачи:
Рассмотреть положение Щ.М. в ПСХЭ Д.Менделеева
Изучить физические и химические свойства Щ.М.
Ознакомится с важнейшими соединениями Щ.М. и их применениями
Ход урока
Организационный момент
Фронтальный опрос:
Где расположены металлы в ПСХЭ?
Какими общими физическими свойствами они обладают?
С какими классами веществ могут взаимодействовать металлы?
В виде чего чаще металлы встречаются в природе?
Какие металлы встречаются в природе в виде самородков?
Какая отрасль в промышленности занимается получением металлов из соединений?
На чём основана пирометаллургическая отрасль?
Какие ещё виды получения металлов вы знаете?
Изучение нового материала
Мы с вами вспомнили все важнейшие свойства металлов и выяснили, что они в ПСХЭ занимают 1,2,3 группы.
Как вы думаете, что мы с вами будем изучать на сегодняшнем уроке? (Металлы 1 группы)
А как они называются ? (Щелочные металлы)
Давайте с вами сформулируем цель нашего с вами урока? (Рассмотреть общую характеристику Щ,М. и их свойств)
Давайте с вами охарактеризуем положение ЩМ в ПСХЭ (Все ЩМ находятся в 1 группе главной подгруппе)
Перечислите их ( Li,Na,K,Rb, Cs, Fr)
Ребята, самостоятельно напишите строение атомов первых трёх элементов (работа в тетрадях и у доски)
+3 Li 2е,1е +11 Na 2е, 8е, 1е +19 K 2е, 8е, 8е, 1е
Что общего в строение у всех атомов ЩМ? (Наличие 1 электрона на последнем уровне)
На что нам указывает наличие этого электрона? (Все ЩМ легко смогут отдать это электрон, тем самым будут проявлять восстановительные свойства и степень окисления +1)
Все щелочные металлы очень активны, поэтому их хранят под слоем керосина, а литий – под слоем вазелина. Объясняется это тем что у них маленькая плотность
|
| Li | Na | K | Rb | Cs | Fr |
| Величина p (г/см3) | 0,534 | 0,968 | 0,8698 | 1,472 | 1,873 | 2,3-2,5 |
| Tплав. °С | 180,5 | 97,83 | 63,51 | 39,3 | 28,7 | 21 |
Обратите внимания, что все ЩМ, кроме лития имеют температуру плавления меньше температуры кипения воды.
Из всех ЩМ металлов Fr – радиоактивный металл, наиболее долго живущий изотоп его имеет период полураспада 22 минуты.
Общие физические свойства ЩМ
Все ЩМ - серебристо - белые мягкие металлы, легко режутся ножом. Как мы видим из таблицы плотность этих метало увеличивается от лития к францию, а температура плавления уменьшается.
Исходя из электронного строения атомов этих металлов давайте охарактеризуем их химические свойства. Мы выяснили, что металлы 1 группы имеют 1 электрон на внешнем энергетическом уровне, что позволяет им отдавать свой электрон.
(При взаимодействие с другими химическими элементами металлы являются восстановителями, а свойства будут проявлять окислительные)
(франций, самый сильный восстановитель, так как у него больше радиус атома и способность к отдаче электронов лучше)
Химические свойства ЩМ
Если разрезать ЩМ, то его серебристый срез быстро потускнеет, это объясняется тем, что они очень легко взаимодействуют с кислородом, который содержится в воздухе, образуя при этом оксидную плёнку.
Li +O2 = Li2O
Толь литий с кислородом образует оксид, все остальные металлы – пероксиды
Пероксиды – это оксиды, в которых связь осуществляется между двумя атомами кислорода
Na + O2 = Na2O2
Оксиды натрия и калия можно получить путём прокаливания их с соответсвующими металлами
Na + Na2O2 = Na2O
Все ЩМ активно взаимодействуют с неметаллами под действием темепратуры, тем самым образуют соли
2Na+H2= 2NaH
2Li +Cl2 = 2LiCl
2K + S = K2S
Все ЩМ активно взаимодействуют с водой, при этом образуют соответствующие щелочи и выделяется водород.
М + H2O = MOH + H2
Так же щелочи можно получить взаимодействием их оксидов с водой
М2О + H2O = MOH
Литий реагирует спокойно с водой, без пламени. Все последующие за ним элементы реагируют с водой с воспламенением и взрывом.
Щелочи – твёрдые белые вещества. Очень гидроскопичны, хорошо растворимые в воде с выделением тепла. Взаимодействуют с кислотами, кислотными оксидами и солями.
Первичное закрепление знаний
Н а доске написана цепочка превращений. Осуществите переходы с помощью химических реакций.
а доске написана цепочка превращений. Осуществите переходы с помощью химических реакций.
L


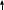 i Li2O LiOH LiCl
i Li2O LiOH LiCl
Важнейшие соединения ЩМ
Как вы считаете ребята, ЩМ в каком виде существуют в природе? (только в виде соединений)
Самые распространенные в природе соединения натрия и лития. Давайте с вами ознакомимся с некоторыми из них, а помогут мне ребята со своими сообщениями.
NaCl – каменная соль
Na2SO4 · 10H2O – глауберова соль
NaNO3 - селитра
NaCl · KCl - сильвинит
K2CO3 - поташ
Закрепление изученного материала
Домашнее задание : п.11, стр.58, упр .№1 б, упр.№2
ТЕСТ
1.К щелочным металлам не относится:
а) рубидий;
в) калий;
б) цезий;
г) медь.
2.Положение электронов в атоме 2е 8е 8е 1е соответствует элементу:
а) литию;
б) калию;
в) натрию;
г) меди.
3.Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра:
а) изменяется периодически;
в) не изменяется;
б) увеличивается;
г) уменьшается.
4.Щелочные металлы проявляют очень сильные:
а) окислительные свойства;
в) восстановительные свойства;
б) амфотерные свойства;
г) нейтральные свойства.
5.Во всех своих соединениях щелочные металлы проявляют степень окисления:
а) +1;
в) +2;
б) +3;
г) +4.
6. К физическим свойствам щелочных металлов не относится:
а) серебристо-белые ;
в) хорошие электропроводники;
б) мягкие и легкие;
г) тугоплавкие.
7. При взаимодействии элементов I группы главной подгруппы с водой образуется:
а) кислота;
в) оксид и выделяется водород;
б) щелочь и выделяется водород;
г) соль.
8. При взаимодействии кислорода со щелочными металлами оксид образуется только с:
а) литием;
в) калием;
б) натрием;
г) рубидием.
9. Щелочные металлы не взаимодействуют с:
а) неметаллами;
в) водой;
б) растворами кислот;
г) концентрированными кислотами.
10. Натрий и калий хранят в керосине или в минеральном масле, потому что они:
а) имеют резкий запах;
в) легко окисляются на воздухе;
б) очень легкие;
г) сильные окислители.






 а доске написана цепочка превращений. Осуществите переходы с помощью химических реакций.
а доске написана цепочка превращений. Осуществите переходы с помощью химических реакций.
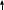 i Li2O LiOH LiCl
i Li2O LiOH LiCl









