
«Кристаллическое состояние веществ»

Распределите вещества по изученным классам: Дайте названия веществам. Ответ оформите в виде таблицы.
CaO
H 2 SO 4
SO 3
Ba(NO 3 ) 2
KOH
H 2 SiO 3
Na 2 SiO 3
MgCI 2
Оксиды
Кислоты
Соли
Основания

Выберите правильный ответ:
- В молекуле H 2 тип связи: а) ковалентная полярная; б) ковалентная неполярная; в) ионная
- 2. В молекуле HCl тип связи:
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
- 3. В молекуле NaCl тип связи: а) ковалентная полярная; б) ковалентная неполярная; в) ионная
- 4. В образовании ковалентной неполярной связи принимают участие : а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
- 5. В образовании ковалентной полярной связи принимают участие :
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
- 6. В образовании ионной связи принимают участие :
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.

Проверьте свои знания:
Если количество правильных ответов равно:
6 – получаете «5»
5 – получаете«4»
4 - получаете«3»
3 и менее - «2»

Что изучает наука химия?
Химия – это наука о веществах, их свойствах и превращениях.
От чего зависят свойства веществ?
От их строения.
В каких агрегатных состояниях могут находится вещества?
жидкое
твёрдое газ

Особенности твёрдого состояния перед жидким и газообразным.
- Расстояние между частицами в твёрдых веществах меньше, чем в газах.
- Межатомные и межмолекулярные взаимодействия в твёрдых веществах гораздо сильнее.
- Чёткое расположение частиц, образующих вещество.

Твёрдые вещества делят на:
не имеют чёткой температуры плавления, при нагревании постепенно размягчаются и переходят в текучее состояние.
имеют строго определённую температуру плавления, характеризуются правильным расположением частиц – в строго определённых точках пространства – узлах.
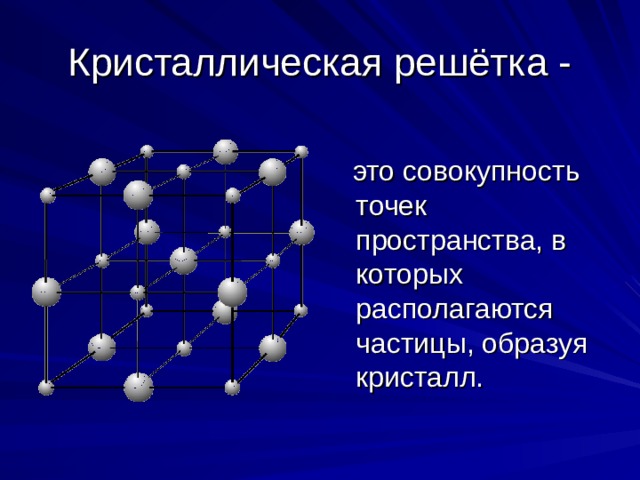
Кристаллическая решётка -
это совокупность точек пространства, в которых располагаются частицы, образуя кристалл.

Типы кристаллических решёток:
Зависимость свойств веществ от их строения.
Тип решётки
Виды частиц в узлах
Молекулярная
Вид связи между частицами
Ионная
Примеры веществ
Атомная
Физические свойства веществ
Металлическая

Зависимость свойств веществ от их строения.
Тип решётки
Виды частиц в узлах
Молекулярная
Вид связи между частицами
Молекулы
Ионная
Примеры веществ
Внутри молекул- ковалентная, между молекулами – слабые силы притяжения
Атомная
Физические свойства веществ
H 2 O, HCl, H 2 S,
H 2 ,Cl 2 ,O 2 ,O 3 ,P 4 ,S 8 и др.
Металлическая
Непрочные, летучие, легкоплавкие, способные к возгонке

Зависимость свойств веществ от их строения.
Тип решётки
Виды частиц в узлах
Молекулярная
Вид связи между частицами
Молекулы
Ионная
Ионы
Примеры веществ
Атомная
Внутри молекул- ковалентная, между молекулами – слабые силы притяжения
Ионная
H 2 O, HCl, H 2 S,
H 2 ,Cl 2 ,O 2 ,O 3 ,P 4 ,S 8 и др.
Физические свойства веществ
Металлическая
Непрочные, летучие, легкоплавкие, способные к возгонке
Все соли, оксиды и гидроксиды металлов.
Твёрдые, прочные, нелетучие, тугоплавкие
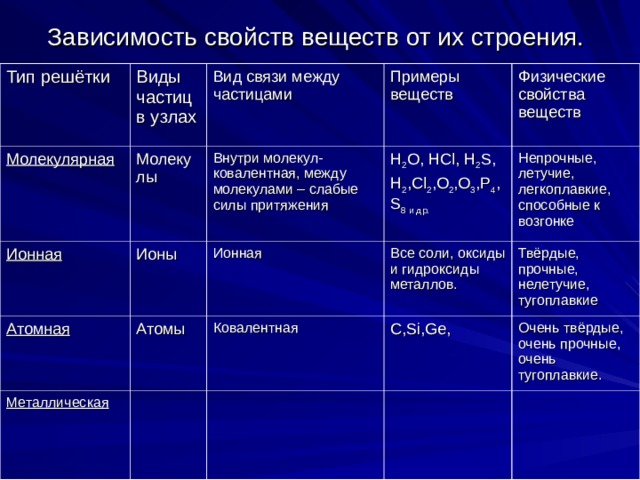
Зависимость свойств веществ от их строения.
Тип решётки
Молекулярная
Виды частиц в узлах
Молекулы
Ионная
Вид связи между частицами
Примеры веществ
Внутри молекул- ковалентная, между молекулами – слабые силы притяжения
Ионы
Атомная
Физические свойства веществ
H 2 O, HCl, H 2 S,
H 2 ,Cl 2 ,O 2 ,O 3 ,P 4 ,S 8 и др.
Ионная
Атомы
Металлическая
Непрочные, летучие, легкоплавкие, способные к возгонке
Все соли, оксиды и гидроксиды металлов.
Ковалентная
Твёрдые, прочные, нелетучие, тугоплавкие
C,Si,Ge,
Очень твёрдые, очень прочные, очень тугоплавкие.

Зависимость свойств веществ от их строения.
Тип решётки
Виды частиц в узлах
Молекулярная
Вид связи между частицами
Молекулы
Ионная
Примеры веществ
Внутри молекул- ковалентная, между молекулами – слабые силы притяжения
Атомная
Ионы
Металлическая
Атомы
Ионная
H 2 O, HCl, H 2 S,
H 2 ,Cl 2 ,O 2 ,O 3 ,P 4 ,S 8 и др.
Физические свойства веществ
Все соли, оксиды и гидроксиды металлов.
Непрочные, летучие, легкоплавкие, способные к возгонке
Ковалентная
Атом-ионы
Твёрдые, прочные, нелетучие, тугоплавкие
C,Si,Ge,
Металлическая
Очень твёрдые, очень прочные, очень тугоплавкие.
Все металлы
Ковкие, пластичные, тягучие, электро- и теплопроводные

Вывод:
- свойства веществ зависят от строения их кристаллической решётки.
- Если известно строение вещества, можно предположить их свойства, и наоборот, если известны свойства, то можно определить их строение.

Домашнее задание
- Прочитать п.48.
- Заполнить таблицу.
- По желанию творческое задание: смоделировать кристаллическую решетку любого вещества и дать ей полную характеристику

































