
Урок-путешествие «Кислоты»

КИСЛОТЫ
I
Проверочная
Историческая
V
Информационная
II
IV
Индикаторная
Правила техники безопасности
СТОП
III

Уксусная_кислота «Древесная кислота» (около 3 тыс. лет)
Самой первой кислотой, которую научился получать и использовать человек, была, уксусная.

Серная кислота
С серной кислотой люди познакомились значительно позже, примерно в 10 веке. Честь её открытия приписывается персидскому химику
Ар-Рази, Абу Бакр Мухаммад

Соляная и Азотная кислоты.
Были выделены и определены химиками примерно в 15 веке. Соляную кислоту назвали соляным спиртом, а азотную-селитряной водкой. Получали эти кислоты с помощью серной кислоты, которую потом поэтично стали называть « матерью всех кислот » .

Угольная_кислота .
Угольную кислоту получил
впервые в конце 18 века
Джозеф Пристли ,
английский химик, он же
священник.

К концу 18 века химики уже знали более десятка кислот. «Первая кислота, с которой познакомился человек, была уксусная , она получилась из вина».

Уксусная кислота
H 3 C – COOH
- Как только не называли эту кислоту: «кислой влажностью», «древесной кислотой», так как долгое время ее получали из древесины. Она имеет широкий спектр применения – растворитель лекарств и душистых веществ, реагент в химическом синтезе при производстве ацетатного шелка, красителей, сложных эфиров, ацетона, хлоруксусной кислоты, уксусного ангидрида. В пищевой промышленности ее применяют в качестве консервирующего средства и как вкусовую добавку .

Кислоты – сложные вещества, состоящие из атомов водорода и кислотных остатков
Классификация кислот по наличию кислорода в кислотном остатке
Классификация кислот по растворимости в воде
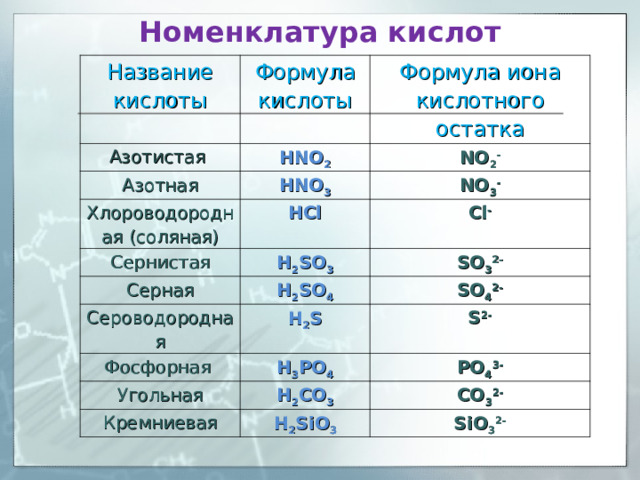
Номенклатура кислот
Название кислоты
Азотистая
Формула кислоты
HNO 2
Азотная
Формула иона кислотного остатка
NO 2 -
HNO 3
Хлороводородная (соляная)
NO 3 -
HCl
Сернистая
Серная
Cl -
H 2 SO 3
Сероводородная
SO 3 2-
H 2 SO 4
SO 4 2-
H 2 S
Фосфорная
S 2-
H 3 PO 4
Угольная
PO 4 3-
H 2 CO 3
Кремниевая
CO 3 2-
H 2 SiO 3
SiO 3 2-

Классификация кислот klassifikaciya
Признаки
классификации
Группы кислот
Наличие кислорода в кислотном остатке
Примеры
А) кислородные;
Б) бескислородные
Основность
А) H 3 PO 4 , H 2 SO 4
Б) HBr, H 2 S
А) одноосновные;
Б) многоосновные
Растворимость в воде
А) HNO 3 , HCl
Б) H 2 SO 4 , H 3 PO 4
А) растворимые;
Б) нерастворимые
Летучесть
Степень диссоциации
А) HNO 3 , HCl ;
Б) H 2 SiO 3
А) летучие;
Б) нелетучие
А) H 2 S, HNO 3
Б) H 2 SO 4 , H 3 PO 4
А) сильные;
Б) средние
В) слабые
Стабильность
А) HNO 3 , HCl
Б) H 2 SO 3 , H 3 PO 4
В) H 2 S, H 2 CO 3
А) стабильные;
Б) нестабильные
А) H 2 SO 4 , HCl
Б) H 2 SO 3 , H 2 CO 3

Правила техники безопасности при работе с кислотами :
1. Необходимо наливать в пробирку количество кислоты, которое указано в инструкции.
2. Заполнять пробирку можно только 1 /3 объема.
3. Взбалтывать вещества следует, слегка покачивая пробиркой, не закрывая ее отверстие пальцем.

4. При разбавлении концентрированной серной кислоты выделяется большое количество теплоты. Поэтому смешивать серною кислоту, добавляя ее в воду, а не наоборот. http://files.school-collection.edu.ru/dlrstore/6ae368db-1a38-5b5c-82c3-aadd474e4be6/034.wmv
5. Концентрированная серная кислота вызывает ожоги. Поэтому попавшую на кожу или ткань кислоту необходимо тотчас стряхнуть, смыть большим количеством воды, затем раствором питьевой соды и вновь смыть водой. Оказание первой помощи при попадании кислот на кожу

Физминутка
Вновь у нас физкультминутка, И совсем не уставать. Голова устала тоже. Наклонились, ну-ка, ну-ка! Так давайте ей поможем! Распрямились, потянулись, Вправо-влево, раз и два. А теперь назад прогнулись. Думай, думай, голова. Разминаем руки, плечи, Хоть зарядка коротка, Чтоб сидеть нам было легче, Отдохнули мы слегка. Чтоб писать, читать, считать.

Индикаторы («указатели») –
вещества, которые под
действием кислот и щелочей
меняют свой цвет.
Открыты Робертом
Бойлем.
http://files.schoolcollection.edu.ru/dlrstore/
273e6145-6cc8-fe8a-376e-9765c4e8a054/001.wmv
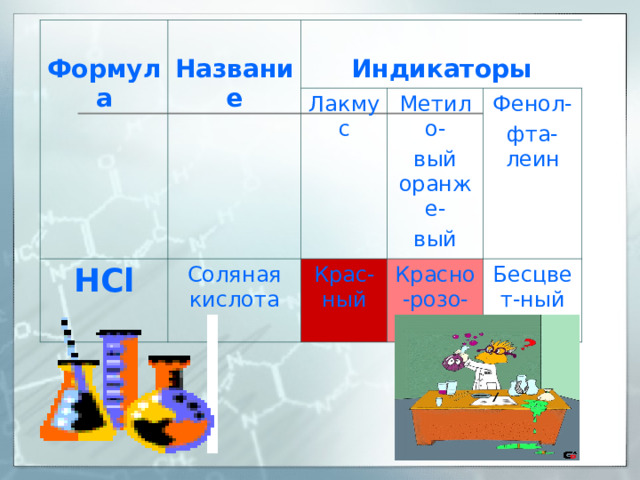
Формула
Название
Индикаторы
HCl
Лакмус
Соляная кислота
Метило-
вый оранже-
вый
Крас-ный
Фенол-
фта-леин
Красно-розо-вый
Бесцвет-ный

ВЫВОД:
Кислоты проявляют общие свойства, обусловленные общностью их строения.

Тест по теме «КИСЛОТЫ»

1. Выберите группу веществ, в которой указаны только формулы кислот .
НС L, H2 O, H2 CO3
НС L, HNO 3 , H 2 CO 3
Na С L, H 3 PO 4 , H 2 SO 3

2 . Выберите группу, в которой указаны формулы только кислородсодержащих кислот
НС L , Н2 S О4 , Н NO3
Н 2 S О 4, Н NO 3 , Н 3 PO 4
НС L , Н 2 S , Н NO 3

3. Под действием растворов кислот лакмус синий становится:
малиновым
не изменяет окраску
красным
фиолетовым

- Прочитать § 20.
- Выполнить задание № 1, 3 письменно.
- Составьте кроссворд по теме «Кислоты».






































