

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Взвешивание в лаборатории
Подготовка Лаборанта химического анализа
Просмотр содержимого документа
«Взвешивание в лаборатории»
Назначение и классификация весов
Любая химическая лаборатория должна быть обязательно оснащена весами. Весы необходимы для взвешивания исходного сырья, продуктов синтеза, проведения анализов в аналитической, органической, физической химии, спецтехнологических дисциплинах. Практически ни одна работа не обходится без определения массы вещества.
Все весы можно разделить на четыре группы по способу уравновешивания гравитационной силы:
с гравитационным уравновешиванием;
автоматическим уравновешиванием;
инерционным уравновешиванием;
силовой компенсацией.
Наибольшее распространение получили весы с гравитационным уравновешиванием и автоматическим уравновешиванием. К первым из них относятся широко распространенные коромысловые весы (часто их называют рычажными). Разновидностями коромысловых весов являются двухпризменные и квадрантные. Конструкции коромысловых весов весьма совершенны. Эти весы высокоточны, надежны, просты в обслуживании, сравнительно недороги и достаточно широко используются в лабораториях предприятий и организаций. К недостаткам этих весов можно отнести их низкое быстродействие.
С середины 1980-х гг. механические коромысловые лабораторные весы стали заменять «электронными» с автоматическим уравновешиванием. Весы этого типа не имеют традиционного рычага, т. е. коромысла или квадранта. В них используются электронные компоненты для преобразования величины взвешиваемой массы в электрические величины (ток, напряжение), удобные для согласования с другими измерительными, вычислительными и управляющими системами. В настоящее время сформировались два направления построения электронных весов: с магнитоэлектрическим обратным преобразователем (компенсатором) усилия; на основе тензометрических датчиков.
Современные электронные весы с цифровым представлением измеряемой массы характеризуются высокой степенью автоматизации и существенным расширением функциональных возможностей: цифровой индикацией результатов взвешивания, полуавтоматической калибровкой, запоминанием значений массы, выборкой массы во всем диапазоне взвешивания, рецептурным взвешиванием, взвешиванием в процентах, подсчетом количества объектов, взвешиванием с функцией усреднения, сопряжением весов с внешними устройствами с помощью интерфейса RS-232C. Выполнение этих функций обеспечивается встроенным специально разработанным микропроцессорным устройством обработки информации.
Требования к характеристикам весов определяются нормативными документами, в частности государственными стандартами и рекомендациями Международной организации законодательной метрологии (МОЗМ).
Согласно действующему государственному стандарту, лабораторные весы подразделяются по назначению на образцовые и общего назначения. Образцовые весы (компараторы массы) предназначены для поверки гирь. Проводить на этих весах другие виды взвешивания запрещается. Весы общего назначения используются для взвешивания. Согласно действующему стандарту, лабораторные весы общего назначения подразделяются на 4 класса точности.
В повседневной практике лабораторные весы подразделяют по назначению на технические (рис. 6.13), аналитические (рис. 6.14) и специальные.
Аналитические весы применяют для проведения научных исследований, в том числе для микрохимических анализов и взвешиваний высшей и высокой точности. В зависимости от значений наибольшего предела взвешивания и цены деления в аналитической группе выделяют весы:

Рисунок 6.13. Технические весы с пределами взвешивания от 0,1 г до 3 кг
макроаналитические с наибольшим пределом взвешивания более 200 г, цена деления не более 0,1 мг;
микроаналитические с наибольшим пределом взвешивания до 20 г, цена деления не более 0,01 мг;

Рисунок 6.14. Аналитические весы
ультрамикроаналитические с наибольшим пределом взвешивания до 1 г, цена деления от 1 до 0,01 мкг.
Технические весы применяются для взвешиваний средней точности. Наиболее распространенные весы имеют наибольший предел взвешивания 0,5-5,0 кг с ценой деления 0,01-0,10 г.
Отдельную группу составляют специальные весы, предназначенные для определения величин, зависящих от массы, и используемые для выполнения одной строго регламентированной операции.
К подобным весам относятся, например, весовые влагомеры, их часто называют анализаторами влажности и др.
Основными характеристиками, которые необходимо знать для правильного выбора и эксплуатации весов, являются их метрологические и эксплутационные характеристики.
Важнейшие метрологические характеристики весов: наименьший и наибольший пределы взвешивания, цена деления или дискретность цифрового отсчета, погрешность измерений, стабильность показаний во времени.
Требования к характеристикам весов определяются нормативными документами, в частности государственными стандартами и рекомендациями МОЗМ.
Цена поверочного деления — е — условная величина, выраженная в единицах массы и предназначенная для расчета погрешности весов. Ее значение е устанавливается производителем весов и в соответствии с требованиями государственного стандарта должно быть указано на весах. На весах также указывается значение дискретности отсчета, обозначаемое буквой d.
В![]()
 зависимости от класса точности весов устанавливаются следующие значения е:
зависимости от класса точности весов устанавливаются следующие значения е:
для весов любого класса точности е = d;
для весов специального и высокого классов точности е выбирается из ряда 2d, 5d, 10d;
для весов специального класса точности с ценой поверочного деления не более 0,1 мг допускается устанавливать следующие значения е: 20d, 50d, 100d, 200d, 500d, 1000d.
Важным моментом для классификации весов является определение числа поверочных делений п. Каждое деление равняется отношению наибольшего предела взвешивания к значению е. Следует обратить внимание на то, что весы, имеющие одинаковое число поверочных делений п, иногда могут быть отнесены по точности к разным классам. Отнесение весов к классу точности, осуществляет производитель весов.
Еще одна характеристика, обязательная для весов, — наименьший предел взвешивания. Наименьший предел взвешивания нормируется через дискретность отсчета d и составляет:
для весов специального класса точности — 100d;
высокого — 20d или 50d в зависимости от величины е;
среднего — 20d.
Самая главная метрологическая характеристика весов — погрешность взвешивания. Весь диапазон взвешивания от наименьшего до наибольшего пределов разбивается на интервалы, характеризующиеся разными величинами предельно допускаемой погрешности. Границы интервалов взвешивания выражаются определенным количеством цен поверочных делений е. В результате такого разбиения весы имеют несколько значений предельно допускаемой погрешности по диапазону взвешивания, нормируемых производителем в долях цены поверочного деления е и выражаемых в единицах массы.
Взвешивание на весах многих конструкций невозможно без набора гирь. Гиря — это однозначная мера, воспроизводящая единицу массы, кратное или дольное ее значение. За единицу массы в системе единиц СИ принят килограмм, представленный массой международного платиноиридиевого прототипа килограмма. За величину килограмма Международным бюро мер и весов в Париже в 1875 г. была принята масса 1,000028 дм3 воды при 4°С.
В 1889 г. Россия получила два экземпляра Международного прототипа килограмма № 12 и № 26 с подробным их описанием. Эти прототипы подвергаются Международным сличениям с прототипом № 1 в Париже раз в 7-10 лет, хранятся в Санкт-Петербурге во ВНИИМ им. Д. И. Менделеева.
Согласно действующему государственному стандарту в зависимости от значений допускаемых отклонений массы гири подразделяются на общего назначения (6 классов) и образцовые (5 разрядов). Гири общего назначения (рабочие гири) применяют при взвешиваниях (на рычажных весах): аналитических, драгоценных камней и металлов, торговых и хозяйственных. Образцовые гири предназначены для поверки лабораторных весов и гирь. При взвешивании на квадрантных или электронных весах оператор обходится в работе без гирь, так как компенсация груза на грузоприемной площадке осуществляется встроенными в весы механическими гирями или электронной гирей на полную нагрузку.
Аналитические весы помещают в специальной весовой комнате по определенным правилам. На полке кроме аналитических весов нельзя размещать ничего, что может повлиять на работу весов: горячие предметы, агрессивные химические вещества, вызывающие коррозию, растворители и т. д. Весы нельзя помещать у наружных стен здания, так как перепад температур воздуха может отразиться на точности взвешивания. Весы нельзя устанавливать в местах, где происходит вибрация в результате движения транспорта или работы вибрирующего оборудования.
Аналитические весы всегда содержатся в застекленном футляре с поднимающейся передней и открывающимися боковыми стенками. Все дверки автоматических весов во внерабочем состоянии должны быть закрыты.
Аналитические разновесы для взвешивания на аналитических весах — набор гирь в специальном футляре, где для каждой гири имеется свое гнездо. Миллиграммовый разновес находится в специальном отделении, прикрыт стеклом, которое открывают по необходимости. В каждом футляре должен быть пинцет. Гири и разновесы берут и ставят на место только пинцетом.
Техника взвешивания
Взвешивание — важнейшая операция в количественном анализе.
В зависимости от задачи, стоящей перед аналитиком, используют весы разных типов. Для приближенного взвешивания масс до 1 кг с точностью 0,1-0,01 г используют технохимические весы. Для аналитических работ — аналитические весы с предельной нагрузкой 100 или 200 г и точностью 0,2 мг. Аналитические весы — высокоточный прибор, требующий осторожного обращения. В учебных лабораториях получили широкое распространение аналитические весы марки ВЛР-200 с наибольшим пределом взвешивания 200 г. Схема устройства данных весов представлена на рис. 6.15.
Для анализа взвешивают определенную массу вещества, называемую навеской. В химическом анализе принято выражение «взять навеску», т.е. взвесить на аналитических весах определенное количество вещества. Величина навески зависит от свойств вещества и методики анализа.
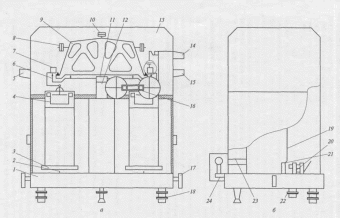

Рисунок 6.15. Устройство лабораторных аналитических весов ВЛР-200
Химическое вещество нельзя взвешивать на чашке весов непосредственно. Для взвешивания его помещают в бюкс (рис. 6.16) — стаканчик с притертой крышкой или на часовое стекло.
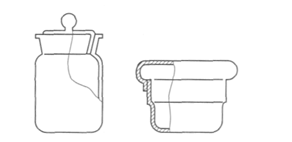
Рисунок 6.16. Стаканчики для взвешивания (бюксы)
Работая на аналитических весах, необходимо соблюдать следующие основные правила:
использовать только приданный этим весам свой аналитический разновес;
все взвешивания проводить на одних и тех же весах и одним и тем же разновесом;
установленные весы в ходе работы не сдвигать с места. После перестановки выставить весы по уровню;
приступая к взвешиванию, проверить равновесие ненагруженных весов, т.е. определить нулевую точку;
не выполнять грубых взвешиваний, проводимых на технохимических весах. Добавлять или удалять взвешиваемое вещество вне шкафа весов;
изменять нагрузку только после арретирования (выключения) весов;
взвешиваемый предмет должен находиться в температурном равновесии с весами, он должен быть сухим и не иметь загрязнений на поверхности;
во время взвешивания открывать только боковые дверцы весов;
не нагружать весы свыше их предельной нагрузки;
разновес брать только пинцетом и помещать в центре правой чашки весов;
твердые вещества взвешивать только на часовом стекле, в пробирке или в стаканчике. Жидкости, летучие и гигроскопичные вещества взвешивать в бюксе с закрытой крышкой;
перед взвешиванием установить нулевую точку весов и уровень;
взвешиваемый предмет помещать на левую чашку весов, а разновесы — на правую;
разновесы подбирать равномерно, последовательно;
кольцевой разновес подбирать последовательно (сначала десятые, затем сотые);
записать в журнал массу взвешиваемого вещества, выключить весы; убрать разновесы, выставить лимбы в нулевое положение, проверить нулевую точку весов.
Анализ газов
Газовые смеси анализируют на содержание основных составляющих компонентов. Анализируют природные и промышленные газовые смеси, а также воздух производственных помещений. К промышленным газовым смесям относятся: горючие газовые смеси (природный, генераторный, колошниковый газы — отход доменного процесса), производственные смеси (азото-водородная смесь в синтезе аммиака, газ колчедановых печей, содержащий диоксид серы), отходящие газы (дымовые газы, содержащие азот, диоксид углерода, пары воды и др.).
Воздух производственных помещений содержит примеси газов, характерных для данного производства. Аналитическими методами контролируют состав выбрасываемого в атмосферу воздуха производственных помещений. Чаще всего состав газовых смесей анализируют газометрическими методами с поглощением компонентов смеси жидкими поглотителями. Объем поглощенного компонента определяется по разности объемов до и после поглощения.
Горючие газы предварительно сжигаются в атмосфере кислорода или воздуха в присутствии катализатора в трубчатой печи при различных температурах. В качестве катализаторов используют оксиды металлов. Продукты сгорания поглощаются соответствующими поглотителями.
Обычно результаты анализа газов выражают в объемных процентах. Так как объем газа зависит от атмосферного давления и температуры, то измеренный объем газа необходимо приводить к нормальным условиям (давление 760 мм рт. ст., или 1011 гПа, и 0°С). Объем приводят к нормальным условиям, исходя из уравнения Менделеева — Клапейрона:
![]()
где V0 — объем газа при нормальных условиях;
V — измеренный объем газа, мл;
P1 — барометрическое давление, мм рт. ст.;
P2 — давление насыщенного водяного пара при Т°С, мм рт. ст.
После преобразования уравнение принимает упрощенный вид
![]()
Расчет сводится к умножению измеренного объема на фактор f, который можно найти по номограмме (рис. 6.17) для сухого или влажного (хранящегося над водой) газа. На номограмме соединяют линейкой точки, соответствующие давлению и температуре в момент проведения анализа; точка пересечения линейки со шкалой справа показывает значение коэффициента. Если измерение давления по манометру произведено в гПа, то пользуются шкалой гПа по номограмме.
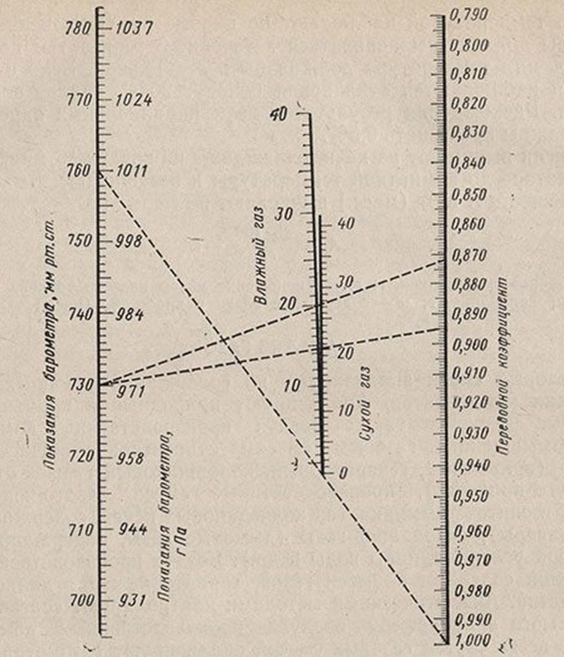
Рисунок 6.17. Монограмма для приведения объема газа к нормальным условиям
Приготовление поглотительных растворов
Поглощение CO2. Проводится 30-35%-ным раствором едкого кали KOH. Для приготовления раствора 1 ч. твердого KOH растворяют в 2 ч. воды. Раствору дают отстояться 2-3 суток. Один объем раствора KOH поглощает примерно 40 объемов CO2. Поглощение протекает в результате реакции
![]()
Поглощение непредельных углеводородов. Готовят раствор сульфата ртути (II) в серной кислоте или раствор бромида калия с бромом. Для приготовления раствора сульфата ртути в 22%-ной серной кислоте (125 мл конц. H2SO4 в 780 мл воды) растворяют 22% сульфата ртути HgSO4. Можно готовить раствор из оксида ртути (II), растворяя 16% его в 29%-ной серной кислоте. Это даст раствор той же концентрации. Перед заправкой в газоанализатор к 200 мл раствора добавляют 96 г сульфата магния MgSO4-7H2O. После отстаиваний раствор декантируют (без взмучивания).
Для приготовления раствора бромида калия с бромом взбалтывают 100 мл 20%-ного раствора бромида калия с 1-2 мл брома. Один объем раствора бромида с бромом поглощает до 7 объемов непредельных углеводородов. Реакция присоединения протекает по уравнению
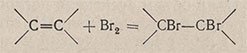
Поглощение кислорода. Используют раствор пирогаллола или аммиачный раствор хлорида меди (I). Раствор пирогаллола готовят растворением 10 г пирогаллола (тригидроксибензола) в 30 мл дистиллированной воды при слабом нагревании на водяной бане в поглотительном сосуде. Раствор пирогаллола доводят до объема 200 мл 60%-ным раствором едкого кали. Для приготовления 60%-ного раствора KOH 3 ч. KOH растворяют в 2 ч. воды. После отстаивания в течение 2-3 суток он осветляется и может быть использован для разбавления раствора пирогаллола. Необходимо оберегать щелочной раствор пирогаллола от соприкосновения с кислородом воздуха. Реакция поглощения кислорода пирогаллолом протекает по уравнению
![]()
Для приготовления аммиачного раствора хлорида меди (I) растворяют 250 г хлорида аммония в 750 мл воды, добавляют 200 г хлорида меди (I) и переводят раствор в склянку. Выбирают склянку такого объема, чтобы она была почти полностью заполнена раствором. В склянку с раствором опускают спирали из металлической меди (для предохранения раствора от окисления) и плотно закрывают ее резиновой пробкой. Раствор должен быть бесцветным. Перед применением к раствору прибавляют порциями раствор концентрированного аммиака в соотношении 1:3; 1 мл такого раствора поглощает 16 мл оксида углерода (CO) или 18 мл кислорода.
Можно приготовить раствор другим способом: смешивают 1 л концентрированного аммиака с 1 л воды и растворяют в этой смеси 60 г хлорида аммония. Раствор наливают в поглотительную пипетку, заполненную медной стружкой, обезжиренную промыванием 20%-ной HNO3 и водой.
Поглощение оксида углерода (CO)
Используют раствор сульфата меди (I) в концентрированной серной кислоте с добавкой b-нафтола или солянокислый раствор хлорида меди (I). Для приготовления раствора (суспензии) сульфата меди (I) к 25 мл воды осторожно добавляют 200 мл концентрированной H2SO4. В фарфоровой ступке тонко растирают 20 г сухого оксида меди (I) Cu2O, к порошку добавляют 50 мл приготовленного раствора и снова растирают смесь до получения однородной массы. Содержимое ступки переносят в колбу с притертой пробкой вместимостью 300 мл. Оставшимся раствором ополаскивают ступку и раствор переводят в колбу. К раствору в колбе при непрерывном размешивании порциями добавляют 25 г тонко растертого b-нафтола. Раствор плотно закрывают и дают стоять 1-2 дня. Присутствие b-нафтола обеспечивает получение более стойких соединений CO с солями меди. Один объем суспензии поглощает 5 объемов CO.
Солянокислый раствор хлорида меди (I) готовят растворением 35 г хлорида меди (I) и 65 г металлической меди в 200 мл 20%-ной соляной кислоты. Склянку выдерживают в темном месте в течение суток при частом взбалтывании, приливают 120 мл воды, дают жидкости отстояться и прозрачный раствор быстро сливают в другую склянку с притертой пробкой; 1 мл такого раствора поглощает 4 мл оксида углерода (CO). Реакция поглощения CO протекает по уравнению
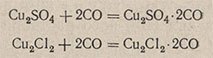
Кроме того, иногда газы поглощают следующими поглотителями:
Водород H2. Поглощают избытком кислорода O2 (реакцию проводят во взрывной пипетке), насыщенным водным раствором брома Br2; палладиевой чернью, которую готовят восстановлением хлорида палладия PdCl2 в щелочной среде с помощью этанола C2H5OH; раствором хлората натрия NaClO3 (готовят растворением 35 г хлората натрия NaClO3, 5 г бикарбоната натрия NaHCO3, 0,5 г хлорида палладия PdCl2 и 0,02 г оксида осмия OsO4 в 250 мл воды); насыщенным раствором перманганата серебра AgMnO4 (контактным носителем служит посеребренный гранулированный силикагель);
Кислород O2. Поглощают раствором 20 г триацетилоксигидрохинона (готовят взбалтывая с малым объемом воды (около 20 мл) и добавляя 40 г едкого кали, растворенного в 80 мл воды); водным 20%-ным раствором хлорида хрома (II) CrCl2; раствором 15 г сульфата хрома (II) CrSO4-5H2O в 10 мл 30%-ной H2SO4 (1 мл раствора поглощает 5 мл O2), раствором дитионита (гидросульфита) натрия Na2S2O4-2H2O, который готовят двумя способами: 1) смешивают 250 мл 20%-ного раствора Na2S2O4-2H2O с 40 мл раствора KOH (5:7) (1 мл раствора поглощает 10 мл O2); 2) растворяют 16 г Na2S2O4-2H2O, 13,3 г едкого натра NaOH и 4 г антрахинонсульфокислого натрия в 100 мл воды (1 мл раствора поглощает 7 мл 02), а также влажным белым фосфором;
Озон O3. Поглощают щелочным раствором иодида калия KI;
Хлор Cl2, бром Br2, иод I2. Поглощают водным раствором сульфата железа (II) FeSO4, содержащим 0,1 н. H2SO4; водным раствором мышьяковистого ангидрида As2O3, содержащим NaHCO3;
Оксид углерода CO. Поглощают смесью трех объемных частей раствора 200 г хлорида меди (I) Cu2Cl2 и 250 г хлорида аммония NH4Cl в 750 мл воды с одной объемной частью концентрированного водного аммиака NH4OH (плотностью 0,91 г/см3); раствором 15 г хлорида меди (I) Cu2Cl2 в 200 мл 20%-ной HCl, к которому добавляют 10 г сульфата меди (II) CuSO4-5H2O, 30 г солянокислого гидроксиламина NH2OH-HCl и 40 мл концентрированного водного аммиака в 500 мл воды; раствором 35 г хлорида меди (I) Cu2Cl2 в 250 мл концентрированной HCl, обесцвеченным стружкой металлической меди; суспензией 5 г оксида меди (I) Cu2O в 100 мл концентрированной H2SO4; смесью 25 г пентоксида йода I2O5 с 270 мл H2SO4 (с 10% избытка SO3);
Аммиак NH3. Поглощают 2 н. раствором HCl, водным раствором гипобромида натрия NaBrO;
Оксид азота (II) NO. Поглощают раствором 28 г сульфата железа (II) FeSO4-7H2 в 64 мл воды с 8,5 мл концентрированной H2SO4;
Сероводород H2S. Поглощают смесью растворов сульфата кадмия 3,2 г CdSO4-8/3H2O в 50 мл воды, 50 мл 1 н. водного аммиака и 50 мл 1 н. раствора хлорида аммония NH4Cl; 1 н. раствором ацетата свинца Pb(CH3COO)2-3H2O; смесью 50 мл 3%-ного раствора пероксида водорода H2O2 с 50 мл 1 н. раствора едкого натра; раствором 15 г калия железосинеродистого (красной кровяной соли) K3(Fe(CN)6) с 18,5 г карбоната натрия Na2CO3-10H2O в 100 мл воды;
Диоксид серы SO2. Поглощают 2 н. раствором едкого натра NaOH;
Цианид водорода HCN. Поглощают водным 10%-ным раствором карбоната натрия Na2CO3; азотнокислым или аммиачным 0,1 н. раствором нитрата серебра AgNO3;
Метан CH4. Поглощают избытком кислорода во взрывной пипетке;
Ацетилен C2H2. Поглощают бромной водой, насыщенным водным раствором брома Br2; концентрированной H2SO4 с 20% SO3; аммиачным раствором хлорида меди (I) Cu2Cl2; 20%-ным раствором цианида ртути (II) Hg(CN)2 в 2 н. растворе едкого натра; раствором йодида ртути (I): 25 г HgI, 30 г йодида калия KI в 100 мл 1 н. раствора KOH;
Бензол, его гомологи, тяжелые углеводороды. Поглощают концентрированной H2SO4 с 20-25% SO3; бромной водой, насыщенным водным раствором брома Br2.
Приготовление гранул на основе оксида меди для заполнения кварцевой трубки
Смешивают 99 г порошкообразного оксида меди (II) с 1 г оксида железа (III), затем 80 г этой смеси смешивают с 20 г чистого каолина и растирают с водой до тестообразного состояния. Из полученной пасты формируют гранулы, продавливая ее через сито с отверстиями 2-2,5 мм, гранулы высушивают и прокаливают при 600°С. Гранулами заполняют кварцевые трубки аппаратов ВТИ и ГИАП.
Газоанализаторы
При анализе газов применяются различные газоанализаторы, действующие по принципу поглощения и сжигания. Наиболее простыми являются ручные (неавтоматические) газоанализаторы типа ГХЛ и ВТИ, в которых применено поглощение компонентов анализируемых смесей соответствующими поглотителями, при необходимости проводится предварительное сжигание горючих компонентов смеси.
Газоанализатор ГХЛ-1
Используется при анализе природных и промышленных газов для определения кислорода, оксида углерода, суммы кислых газов (CO2, SO2, H2S), водорода, непредельных и предельных углеводородов и азота. Имеет пять поглотительных сосудов. Катализатором служит оксид меди (I).
Газоанализатор ГХЛ-2
Применяется для тех же анализов, что и ГХЛ-1. Имеет четыре поглотительных сосуда. Водород сжигают в печи при 80-100 °С в присутствии палладиевого катализатора.
Газоанализатор ГХП-3
Переносной стеклянный прибор предназначается для определения кислорода, оксида углерода, суммы кислых газов и непредельных углеводородов. Имеет три поглотительных сосуда.
Газоанализатор ВТИ-2
Используется для определения кислорода, водорода, оксида и диоксида углерода, предельных и непредельных углеводородов. Имеет шесть поглотительных сосудов. В качестве катализатора используется оксид меди (I).
Анализ галогенопроизводных. Хлороформ
Свойства. Хлороформ (трихлорметан) — бесцветная, прозрачная, подвижная и легколетучая жидкость, обладающая характерным запахом, сладковатого и жгучего вкуса. Со спиртом, эфиром, бензином и многими эфирными и жирными маслами смешивается во всех отношениях. Труднорастворим в воде (1:200), не смешивается с глицерином. Токсичен, обладает наркотическим действием. Температура кипения 59,5-620С, плотность 1,474-1,483 кг/м3 при 20 С, ПДК 20 мг/м3.
Технические требования. Хлороформ выпускается трех марок: А, Б и В. В технический хлороформ марок А и Б, который предназначается для транспортировки и хранения, вводится в качестве стабилизатора безводный этиловый спирт в количестве 0,5-1%, поэтому качество хлороформа проверяют после отмывки его от стабилизатора. Содержание хлороформа не менее 99,9%, метиленхлорида не более 0,002%, 1,1-дихлорэтана не более 0,002%, четыреххлористого углерода не более 0,03%, влаги не более 0,5%.
Отмывка от стабилизатора: 25 мл анализируемого хлороформа и 15 мл дистиллированной воды помещают в делительную воронку емкостью 50 мл. Содержимое встряхивают на механической мешалке с числом возвратно-поступательных движений (или вращательных) не менее 100 в минуту в течение 15 мин. Затем смеси дают отстояться в течение 3-5 мин и хлороформ отделяют от воды. Операцию по отмывке повторяют трижды. Затем хлороформ сушат безводным поташем в течение 30 мин.
Определение содержания хлороформа, метиленхлорида, 1,1-дихлорэтана и четыреххлористого углерода
В заводских условиях анализ хлороформа проводят при помощи газожидкостного хроматографа. Газ-носитель — гелий или водород, сорбент — сферохром I (ТНД-ТСМ), обработанный трикрезилфосфатом, или диатомитовый кирпич, измельченный до 0,25-0,5 мм и обработанный также трикрезилфосфатом.
Приготовление сорбента. Рабочую фракцию сферохрома отмывают от пыли дистиллированной водой, просушивают в сушильном шкафу при 100-150 С до постоянной массы и охлаждают в эксикаторе. Затем обрабатывают в фарфоровой чашке раствором трикрезилфосфата (25% от массы сферохрома) в метаноле. Массу выдерживают 30 мин, периодически осторожно перемешивая стеклянной палочкой. Затем растворитель упаривают на водяной бане в вытяжном шкафу, сушат 30 мин в сушильном шкафу при 100-120 0С и охлаждают в эксикаторе.
Измельченный диатомитовый кирпич при использовании его в качестве носителя отмывают от пыли, заливают концентрированной соляной кислотой и нагревают на водяной бане. Обработку кислотой проводят до отсутствия ионов железа в промывной кислоте (качественная реакция с роданидом калия). Затем промывают дистиллированной водой до нейтральной реакции. Кирпич отфильтровывают, просушивают в сушильном шкафу при 100-150°С, прокаливают в муфельной печи в течение 8 ч при 1000°С, охлаждают в эксикаторе, отбирают нужную фракцию и обрабатывают трикрезилфосфатом, как описано ранее.
После приготовления сорбента проводят подготовку хроматографической колонки. Для этого чистую сухую колонку заполняют сорбентом небольшими порциями, слегка постукивая по колонке, чтобы обеспечить равномерное уплотнение сорбента. Помещают колонку в термостат прибора и, не подсоединяя к детектору, продувают ее током газа-носителя при температуре 120°С 8 ч. Затем проводят калибровку прибора.
Режим калибровки и работы прибора. Количественное содержание примесей определяют методом внутреннего стандарта с учетом калибровочных коэффициентов. В качестве внутреннего стандарта используют нормальный гептан. Для калибровки прибора готовят несколько искусственных смесей, состоящих из основного компонента и определяемых примесей в различных концентрациях, близких по составу к анализируемому продукту с добавлением около 0,03% гептана. Для этого около 90 г чистого хлороформа взвешивают с точностью до 0,0002 г в стеклянных колбочках, снабженных притертыми пробками. В колбочки с хлороформом поочередно через резиновые пробки добавляют шприцами разные количества четыреххлористого углерода, метиленхлорида, 1,1-дихлорэтана и одинаковое количество гептана. После каждого добавления смесь взвешивают с той же точностью. Количество примесей и гептана берут с учетом дальнейшего разведения в 10 раз.
Затем из каждого раствора готовят калибровочные смеси. Для этого в мерную колбу емкостью 50 мл, снабженную пробкой, вносят 20-30 мл чистого хлороформа, туда же шприцем добавляют 5 мл одного из приготовленных растворов, перемешивают и объем смеси доводят до метки хлороформом. 0,025 мл калибровочной смеси вводят в испаритель, хроматографируют ее и определяют калибровочные коэффициенты детектора для каждого компонента при различных концентрациях. При этом вычисляют калибровочный коэффициент:
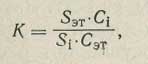
где Sэт, Si — площади стандарта и соответствующего компонента, см2;
Сэт, Ci — концентрации внутреннего стандарта и соответствующего компонента, %.
Ход анализа. 90 г хлороформа взвешивают (точная навеска) в колбе, добавляют нормальный гептан и шприцем емкостью 1-5 мл вносят в испаритель хроматографа 0,025 мл пробы. Затем снимают хроматограмму. Температура термостата 100 С, скорость газа-носителя 6 л/ч, скорость движения диаграммной ленты 400 мм/ч.
После снятия хроматограммы приступают к обработке результатов по формуле:
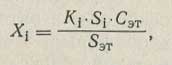
где Si, Sэт — площади пиков определяемого компонента и гептана, см2; Ki — калибровочный коэффициент.
За результат принимают среднее арифметическое из трех определений. Содержание хлороформа вычисляют по формуле:
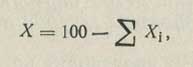
где EXi — сумма всех примесей, %.
Другой метод основан на реакции омыления хлороформа. При этом образуется хлорид калия, содержание которого определяют аргентометрически:
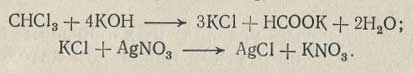
Ход анализа. Точную навеску хлороформа (около 0,1 г) взвешивают в конической колбе с притертой пробкой, приливают 30 мл 0,5 н. спиртового раствора едкого кали, соединяют колбу с обратным холодильником и омыляют на кипящей водяной бане в течение часа. До внесения навески в колбу рекомендуется добавить небольшое количество бензола или толуола. По окончании омыления холодный раствор нейтрализуют 2 н. раствором азотной кислоты, затем им же подкисляют и приливают из бюретки 30-40 мл 0,1 н. раствора нитрата серебра. Избыток нитрата серебра оттитровывают 0,1 н. раствором роданида аммония.
Содержание хлороформа в процентах определяют по формуле:
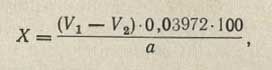
где V1 — количество 0,1 н. раствора нитрата серебра, мл; V2 — количество 0,1 н. раствора роданида аммония, мл; 0,03972 — количество хлороформа, соответствующее 1 мл 0,1 и. раствора нитрата серебра, г; а — навеска хлороформа, г.
Определение содержания альдегидов
Ход анализа. В стеклянный цилиндр, тщательно ополоснув его хлороформом, а затем дистиллированной водой, вносят 5 м хлороформа, 5 мл дистиллированной воды и три капли реактива Несслера. Содержимое цилиндра хорошо перемешивают и выдерживают 5 мин в темном месте при комнатной температуре. Хлороформ не содержит альдегидов, если раствор не окрасился.
Полярографический метод определения содержания четыреххлористого углерода в хлороформе
Определение CCl4 производят на фоне 0,05 н. раствора гидроокиси тетраэтиламмония в 75% этиловом спирте.
Дифференциальные полярограммы снимают от 0,2 В. Потенциал пика четыреххлористого углерода на этом фоне -0,8 В.
Четыреххлористый углерод и хлороформ способны восстанавливаться на ртутном капельном катоде:
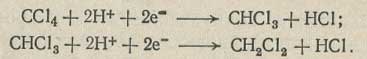
Ход анализа. 15 мл фона наливают в электролитическую ячейку 4 с мешалкой 1, гидрозатвором 2, капилляром 3 (рис. 6.18) и в течение 20 мин через раствор фона пропускают азот для удаления кислорода. Затем в фон добавляют 1 мл хлороформа, перемешивают 1-2 мин, выдерживают 1-2 мин и снимают полярограмму от 0,2 В при чувствительности 2*10в-8 или 1,5*10в-8 А/мм; компенсация 1 или 2. Интервал напряжения 1,5 В.
Измерив высоту полученной волны, по калибровочному графику находят количество четыреххлористого углерода в миллиграммах.
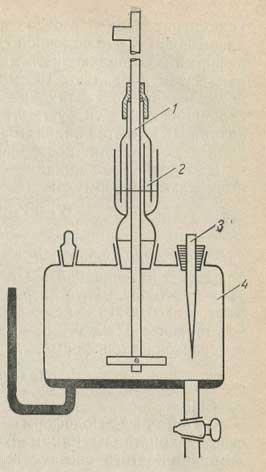
Рис. 6.18. Ячейка полярографа.
1 — мешалка; 2 — гидрозатвор; 3 — капилляр; 4 — электролитическая ячейка
Построение калибровочного графика. 15 мл фона наливают в электролитическую ячейку и в течение 20 мин пропускают через раствор азот для удаления кислорода. Затем вводят в фон 0,2-0,6 мл стандартного раствора четыреххлористого углерода (показатель преломления 1,4608) в эталоне концентраций 2,0-2,5 мг/мл и 1 мл полярографически чистого хлороформа, перемешивают в течение 1-2 мин, выдерживают раствор 1-2 мин и снимают полярограмму от 0,2 В при чувствительности 2*10в-8 или 1,1*10в-8 А/мм; компенсация 1 или 2. По 3-4 точкам строят калибровочный график зависимости высоты волны от концентрации четыреххлористого углерода (в мг). ССЦ в процентах (X) вычисляют по формуле:
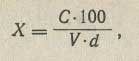
где С – количество четыреххлористого углерода в испытуемом хлороформе, найденное по калибровочному графику, г;
V – количество хлороформа, взятое для анализа, мг;
d – плотность хлороформа, г/см3.
Количественное определение спирта в хлороформе
В склянку с притертой пробкой емкостью 300-500 мл помещают 25 мл 0,1 н. раствора бихромата калия, 25 мл концентрированной азотной кислоты и охлаждают в ледяной воде. К охлажденной смеси прибавляют 1 мл хлороформа и оставляют на 5 мин, периодически перемешивая. Затем добавляют 100 мл воды, 5 мл 10% раствора йодида калия, оставляют на 5 мин в темном месте; выделившийся йод титруют 0,1 н. раствором тиосульфата натрия. В качестве индикатора применяют крахмал. Параллельно проводят контрольный опыт.
Процентное содержание спирта в хлороформе (X) вычисляют по формуле:
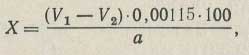
где V1 — количество 0,1 н. раствора тиосульфата натрия, пошедшее на основной опыт, мл;
V2 — количество 0,1 н. раствора тиосульфата натрия, пошедшее на контрольный опыт, мл;
0,00115 — количество этилового спирта, соответствующее 1 мл 0,1 н. раствора бихромата калия, г; а — навеска хлороформа, г.
Анализ кислот. Глутаминовая кислота
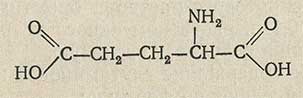
C5H9NO4 Мол. м. 147,13
Свойства
Белый кристаллический порошок кислого вкуса. Мало растворяется в холодной воде, лучше — в горячей, практически нерастворим в спирте и эфире. Температура плавления 190°С (с разложением). Удельное вращение от +30 до +34° (5% раствор в разведенной соляной кислоте).
Требования к препарату
Содержание глутаминовой кислоты в препарате не менее 98,5%, сульфатной золы не более 0,1%, тяжелых металлов не более 0,001%, мышьяка не более 0,0001%, хлоридов не более 0,05%. Потеря массы при высушивании при 100-105°С не должна превышать 0,5%.
Применение
При заболеваниях центральной нервной системы.
Определение основного продукта в препарате
Метод Кьельдаля
Основан на определении связанного азота.
Ход анализа
Около 0,1 г препарата (точная навеска) помещают в колбу Кьельдаля емкостью 200 мл и далее поступают, как описано ниже (Определение содержания азота в органических веществах по Кьельдалю).
Содержание общего азота в продукте не менее 9,4% и не более 9,55%.
Метод нейтрализации
Кислоту титруют раствором едкого натра в присутствии индикатора бромтимолового синего:
Ход анализа
Точную навеску (около 0,3 г) препарата помещают в коническую колбу емкостью 100 мл и при слабом нагревании растворяют в 50 мл свежепрокипяченной воды. К охлажденному раствору прибавляют 5 капель спиртового раствора бромтимолового синего и титруют 0,1 н. раствором едкого натра до перехода желтой окраски в голубовато-зеленую.
Процентное содержание глутаминовой кислоты в препарате (X) вычисляют по формуле:
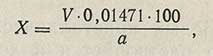
где V — количество 0,1 н. раствора едкого натра, пошедшее на титрование, мл;
0,01471 — количество глутаминовой кислоты, соответствующее 1 мл 0,1 н. раствора едкого натра, г;
а — навеска, г.
Метод титрования формальдегидной смесью
Основан на образовании N-метиленового производного, обладающего сильнокислым характером:
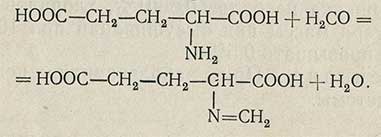
Ход анализа
Точную навеску (около 0,25 г) растворяют при нагревании в 20 мл воды, освобожденной кипячением от углекислого газа. Прибавляют несколько капель индикатора нейтрального красного и нейтрализуют раствор 0,2 н. раствором едкого натра до янтарно-желтой окраски. К раствору добавляют 20 мл смеси, приготовленной из 50 мл 40% формалина, пронейтрализованного 0,2 н. раствором едкого натра в присутствии 1 мл фенолфталеина до ясно-красной окраски. Затем титруют 0,2 н. раствором едкого натра до ярко-красной окраски (рН 9), сравнивая со «свидетелем» (20 мл воды, 3 капли раствора нейтрального красного, 10 мл формальдегидной смеси и 0,1 мл 0,2 н. раствора едкого натра).
Процентное содержание глутаминовой кислоты (А) вычисляют по формуле:
![]()
где V — количество 0,2 н. раствора едкого натра, пошедшее на титрование, мл; Т — титр кислоты, г/мл; а — навеска, г.
Определение содержания азота в органических веществах по Кьельдалю
Метод основан на окислении органических соединений, содержащих азот, концентрированной серной кислотой при нагревании в присутствии катализатора. При этом азот органического соединения переходит в сульфат аммония.
При действии концентрированного раствора щелочи на сульфат аммония выделяется аммиак, который поглощают определенным количеством титрованного раствора кислоты, а затем избыток кислоты титруют раствором щелочи. По количеству серной кислоты, вступившей в реакцию с аммиаком, определяют содержание азота в анализируемом веществе. По видоизмененной методике аммиак поглощают борной кислотой, а затем титруют соляной.
Метод достаточно прост и позволяет производить несколько параллельных определений, однако он не применим для определения азота в некоторых органических соединениях, содержащих азот в ядре (например, пиридин). В некоторых случаях при анализе методом Кьельдаля необходимо производить дополнительную обработку анализируемых веществ.
Так, например, при окислении в серной кислоте нитросоединений (R-NO2), нитрозосоединений (R-NO), азосоединений (R-N = N-R), азоксисоединений, гидразосоединений (R-NH-NH-R) и некоторых других, кроме аммиака, образуются свободный азот и окислы азота, что приводит к неправильным результатам. Поэтому при анализе таких соединений их предварительно восстанавливают до аминов (-NH2), так как азот аминогруппы при анализе по методу Кьельдаля количественно превращается в аммиак. ГФХ рекомендует следующую методику выполнения анализа.
Навеску испытуемого вещества, эквивалентную 0,014-0,034 г азота, взятую с точностью до 0,0002 г, помещают в круглодонную колбу Кьельдаля емкостью 200 мл, прибавляют 1 г растертой смеси, состоящей из сульфата калия и сульфата меди, взятых в отношении 10: 1, и 7 мл концентрированной серной кислоты. Колбу неплотно закрывают полой стеклянной пробкой грушевидной формы, помещают на асбестовую сетку и нагревают сначала на маленьком пламени, а затем более интенсивно, пока жидкость не начнет кипеть. Кипячение продолжают до тех пор, пока содержимое колбы не станет прозрачным, светло-зеленого цвета. После этого кипятят еще 30 мин. Затем колбу охлаждают и осторожно вливают в нее 20 мл воды, снова охлаждают и присоединяют к установке для отгонки аммиака (рис. 6.19).
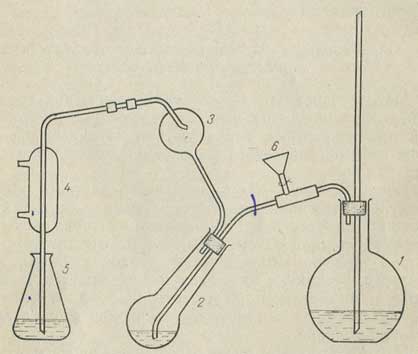
Рис. 6.19. Схема установки для определения содержания азота методом Кьельдаля.
1 — парообразователь; 2 — колба Кьельдаля; 3 — брызгоуловитель; 4 — холодильник; 5 — приемник; 6 — капельная воронка
Установка для отгонки аммиака состоит из парообразователя 1, брызгоуловителя (ловушки) 3 с соответственно изогнутыми трубками, капельной воронки 6, холодильника 4 длиной 10-12 см и конической колбы-приемника 5. Колбу Кьельдаля закрывают пробкой, имеющей два отверстия. В одно из них вставляют трубку, которая соединена с капельной воронкой и парообразователем, в другое — ловушку. Ловушку при помощи изогнутых трубок соединяют с холодильником, конец которого погружен в коническую колбу (приемник), содержащую 15 мл раствора борной кислоты. В капельную воронку наливают 45 мл 30% раствора едкого натра. Когда прибор собран и в холодильник пущена вода, начинают нагревать воду в парообразователе. Для равномерного кипения в парообразователь бросают несколько капилляров, запаянных с одной стороны. После того как вода в парообразователе закипит, в колбу через воронку осторожно прибавляют 40 мл едкого натра. Затем кран капельной воронки закрывают и продолжают перегонку до получения 100 мл отгона. Реакционную колбу при этом обогревают так, чтобы объем жидкости в ней оставался постоянным. Затем опускают приемник, трубку холодильника выводят из жидкости, промывают кончик трубки сверху водой и продолжают отгонку еще 1-2 мин. Промывные воды собирают в тот же приемник. Отгон титруют 0,1 н. раствором соляной кислоты. Параллельно проводят контрольный опыт. Разность между количествами миллилитров 0,1 н. раствора соляной кислоты в основном и контрольном опытах, умноженная на 0,0014, соответствует числу граммов азота во взятой навеске.
Содержание азота можно определять также по методу Дюма, сжигая вещество в токе чистого С02 с окисью меди. Весь азот вещества при этом выделяется в виде элементарного азота (N2), который определяют по объему.
Анализ лекарственных веществ и промежуточных продуктов, производных фенола и анилина. Резорцин (м-Диоксибензол)
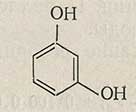
C6H6O2 Мол. м. 110,11
Свойства
Белый, с желтоватым или сероватым оттенком кристаллический порошок. Температура кристаллизации не ниже 109,1 °С. На воздухе в присутствии влаги и на свету приобретает вследствие окисления розовую, а затем бурую окраску.
Технические требования
Содержание м-диоксибензола в продукте не менее 99%. Водный раствор бесцветный, прозрачный; раствор в едких щелочах — желтоватый или зеленоватый, прозрачный.
Применение
Резорцин медицинский применяют в составе мазей для лечения кожных заболеваний, экземы, а также в качестве антисептика.
Определение содержания резорцина
Содержание резорцина можно определить методом нитрозирования, титруя его раствором нитрита натрия в кислой среде.
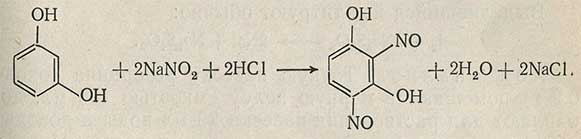
Ход анализа
Точную навеску резорцина (около 3,2 г) помещают в мерную колбу емкостью 250 мл, растворяют в 100-200 мл воды, затем доводят объем до метки, тщательно перемешивают. С помощью пипетки переносят 50 мл раствора в толстостенный стакан, приливают 30 мл концентрированной соляной кислоты, 500 мл воды и ставят стакан в водяную баню при 37-40°С. При температуре 30-35°С раствор резорцина титруют 0,5 н. раствором нитрита натрия. Конец реакции определяют по появлению синего пятна на йодкрахмальной бумаге, сохраняющегося при повторном нанесении пробы через 15 мин. Параллельно проводят контрольный опыт с 50 мл воды.
Процентное содержание резорцина (X) вычисляют по формуле:
![]()
где V1 — количество 0,5 н. раствора нитрита натрия, пошедшее на титрование основного опыта, мл;
V2 — количество 0,5 н. раствора нитрита натрия, пошедшее на титрование контрольного опыта, мл;
0,027528 — количество резорцина, соответствующее 1 мл 0,5 н. раствора нитрита натрия, г; а — навеска резорцина, г.
Резорцин, используемый в медицинской практике, количественно можно определить броматометрически.
Броматометрический метод
Определение резорцина основано на реакциях:
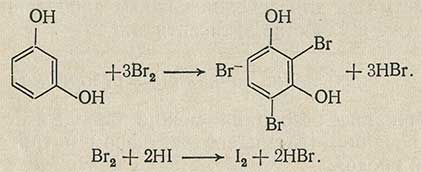
Выделившийся йод титруют обычно:
![]()
Ход анализа
Точную навеску резорцина (около 0,2 г) помещают в мерную колбу емкостью 100 мл, добавляют для растворения навески 20 мл воды и доводят объем раствора водой до метки. 20 мл этого раствора переносят в склянку для бромирования емкостью 250 мл, прибавляют 40 мл 0,1 н. раствора бромата калия, 10 мл 10% раствора бромида калия, 10 мл 50% раствора серной кислоты, перемешивают и оставляют на 15 мин. Затем к смеси прибавляют 20 мл 10% раствора йодида калия, смесь сильно взбалтывают и ставят в темное место на 10 мин, после чего добавляют 2-3 мл хлороформа и титруют выделившийся йод 0,1 н. раствором тиосульфата натрия в присутствии раствора крахмала, который прибавляют в конце титрования, когда раствор станет соломенно-желтым. Параллельно проводят контрольный опыт.
Процентное содержание резорцина (X) вычисляют по формуле:

где V1 — количество 0,1 н. раствора тиосульфата натрия, пошедшее на титрование контрольного опыта, мл;
V2 — количество 0,1 н. раствора тиосульфата натрия, пошедшее на титрование основного опыта, мл;
0,001835 — количество резорцина, соответствующее 1 мл 0,1 и. раствора бромата калия, г; а — навеска, г.
Вещества, требующие осторожного обращения
Аммиак. Бесцветный газ с острым запахом. Водные растворы обладают сильно щелочной реакцией. Высокие концентрации аммиака в воздухе вызывают слезотечение и боли в глазах, сильные приступы кашля, головокружение, боли в желудке и рвоту. Поражение (ожог) глаз аммиаком проявляется не сразу, а через 3-7 дней, ожог сопровождается поражением конъюнктивы, роговицы и помутнением хрусталика. Может наблюдаться сильное расстройство дыхания и кровообращения; смерть наступает вследствие сердечной слабости. Попадание разбавленных растворов на кожу вызывает раздражение, концентрированных — ожоги и образование пузырей.
При отравлении через дыхательные пути рекомендуется свежий воздух, при удушье — кислород; вдыхать водяные пары, прибавив в воду несколько кристалликов лимонной кислоты; пить теплое молоко с боржомом или содой. При поражении кожи необходимо обильно промывать водой, затем прикладывать примочки из 5%-ного раствора уксусной кислоты (можно лимонной или винной). При случайном попадании раствора аммиака внутрь нужно промыть желудок. Для этого используют большие количества 1%-ного раствора лимонной, винной или уксусной кислоты; пить небольшими глотками, затем нужно выпить молока, лимонного сока или растительного масла. При попадании раствора аммиака в глаза их необходимо обильно промыть водой. При резких болях в глаза вводят 1-2 капли 1%-ного раствора новокаина.
Азотная кислота. Концентрированная азотная кислота вызывает сильные ожоги кожи. Разбавленная кислота при частом попадании на кожу может вызвать экзему. Вдыхание паров азотной кислоты вызывает раздражение слизистых оболочек, головокружение, шум в ушах, сонливость, легкий отек. Пораженная кожа окрашивается в желтый цвет. Попадание в рот и пищевод вызывает тяжелые ожоги.
При попадании на кожу требуется немедленное обильное промывание водой до полного удаления кислоты. При ожогах слизистой рта, языка и глотки после полоскания водой необходимо смазывание 2%-ным раствором кокаина. При поражении глаз требуется обильное промывание струей теплой воды. При случайном попадании внутрь — осторожное, но обильное промывание желудка. Необходимо пить взвесь жженой магнезии (10:100) по столовой ложке через каждые 5 мин; известковое молоко (стаканами); яичный белок, молоко, слизистые отвары; глотать кусочки сливочного масла (несоленого) и кусочки чистого мелкого льда; класть холод на область живота (пузырь со льдом); делать содовые ингаляции. Не следует принимать рвотные средства и растворы бикарбонатов щелочных металлов. При поражении парами кислоты пострадавшего следует вывести на свежий воздух; дать теплого молока с содой или боржомом; сделать содовые ингаляции, банки, горчичники. При удушье — давать кислород.
Концентрированная азотная кислота способна взрываться при соприкосновении с веществами-восстановителями: сероводородом, скипидаром, этанолом. При соприкосновении с горючими веществами может произойти воспламенение, сопровождающееся выделением ядовитого диоксида азота. Поэтому при тушении пожара необходимо пользоваться противогазом. Не следует допускать соприкосновения азотной кислоты со скипидаром, карбидами, порошками металлов, солями пикриновой и хлорноватой кислот, а также с горючими материалами.
Азота оксиды. Обильно выделяются при разложении проб металлов и сплавов в азотной кислоте. Главная составная часть — диоксид азота NO2. Признаки отравления вначале выражены слабо: головная боль, кашель, першение в горле. Опасные явления развиваются через 6-12 ч и позже: одышка, учащенное дыхание (40-50 дыханий в минуту), чувство стеснения и сжатия в области груди, сильный кашель с большим количеством пенистой мокроты с примесью крови. Ослабление сердечной деятельности, учащение пульса, отек легких. При оказании помощи требуется снять стесняющую и затрудняющую дыхание одежду, требуется свежий воздух, покой, при необходимости — кислород.
Ацетон. Летучая жидкость. Пары его образуют с воздухом горючие и взрывоопасные смеси. Для тушения загоревшегося ацетона применяют воду в распыленном состоянии, а также углекислотный огнетушитель. Ацетон хранят в стеклянных бутылях, тщательно оберегая их от повреждений. Удобно помещать эти бутыли в железные ящики. На складах, где хранится ацетон, необходима безопасная в отношении пожара электрическая проводка. При вдыхании паров ацетона и попадании его внутрь появляется состояние легкого опьянения, головная боль, головокружение, общая слабость, шатающаяся походка, тошнота, слезотечение, першение в горле. Для помощи пострадавшему необходим свежий воздух, кислород, крепкий сладкий чай или кофе. При поражении глаз следует немедленно промыть их струей чистой воды. При случайном попадании внутрь — обильное промывание желудка, сердечные средства.
Бария нитрат (барий азотнокислый), а также карбонат бария и хлорид бария очень опасны при попадании внутрь организма (в желудок). Признаки отравления: головная боль, головокружение, слюнотечение, жажда, жжение во рту и пищеводе, тошнота, рвота, коликообразные боли в животе и обильный понос, пульс сначала замедлен, затем учащен, артериальное давление повышено, обильный холодный пот, двоение в глазах, шум в ушах, расстройство походки, судороги.
При попадании внутрь необходимо немедленно обильно промыть желудок раствором глауберовой соли MgSO4 (1 столовая ложка на 1 л воды); принять слабительное (1 столовая ложка английской Na2SO4 или глауберовой MgSO4 соли на 1 стакан воды), затем пить по 1 столовой ложке через каждые 5 мин 10%-ный раствор глауберовой соли. Нужно искусственно вызвать рвоту для удаления образовавшегося сульфата бария или повторно промыть желудок, давать пить белковую воду или молоко. Нитрат бария является сильным окислителем. Не разрешается хранить его вместе с горючими веществами.
Бром. Жидкий бром обжигает кожу. Пары брома раздражают дыхательные пути. При вдыхании паров и попадании внутрь появляется головная боль, головокружение, общая слабость, шум в ушах, насморк, чихание, носовое кровотечение, жжение и царапанье в горле, охриплость голоса, спазмы в груди, сильный кашель, горький вкус и сухость во рту, тошнота, рвота, боль и резь в глазах, слезотечение, светобоязнь, отек век.
При отравлении парами пострадавшего нужно немедленно вывести на свежий воздух, он должен вдыхать водяные пары (в воду рекомендуется добавить несколько капель аммиака или соду) или кислород, пить теплое молоко с боржомом (2:1). Пораженную кожу обильно промывают водой и затем смазывают ланолином. При соприкосновении брома с органическими веществами может возникнуть пожар. Хранить бром следует изолированно, в стеклянных или глиняных сосудах в негорючей упаковке.
Водорода пероксид. Вызывает ожоги кожи, особенно концентрированные растворы. Очень опасно попадание в глаза. При соприкосновении с некоторыми металлами или соединениями происходит бурная реакция; при соприкосновении с органическими веществами возможно их возгорание. Хранят в склянках из темного стекла с притертой пробкой (неплотно закрытые) вдали от органических веществ. Пораженное место на коже немедленно обильно промывают водой до исчезновения белых пятен. При тушении применяют воду.
Дихлорэтан. Бесцветная сильно летучая жидкость. Пары дихлорэтана вызывают головную боль, общую слабость, чувство жжения в зеве, кашель, замедленный пульс, тошноту и рвоту, болезненность в подложечной области и в области правого подреберья. Для оказания помощи пострадавшего следует немедленно вывести на свежий воздух. При необходимости делают искусственное дыхание, дают сердечные (кофеин) и успокаивающие (валериана) средства.
При случайном попадании дихлорэтана внутрь появляется слабость, слюнотечение, тошнота, сильная рвота с примесью желчи, понос, падение сердечной деятельности, судороги, потеря сознания. Для оказания помощи — обильно промывать желудок водой, искусственно вызвать рвоту, дать слабительное (1 столовая ложка английской или глауберовой соли на 1 л воды).
Едкие щелочи (едкое кали и едкий натр). Сильно действуют на кожу и слизистые оболочки. Особенно опасно попадание даже мельчайших частиц щелочи в глаза. Работать со щелочами следует в защитных очках. Хранить щелочи необходимо в сухом месте вдали от источников тепла и воды.
При попадании на кожу вызывают ожоги, язвы и дерматиты. Необходимо обильное промывание водой до прекращения омыления кожи, ванны или примочки 5%-ным раствором лимонной, уксусной или винной кислоты. При поражении глаз возникает боль, слезотечение, конъюнктивит. Необходимо обильное промывание широко раскрытого глаза струей чистой воды и 5%-ным раствором винной или лимонной кислоты.
При случайном попадании щелочей внутри происходит ожог слизистой рта, языка, пищевода, желудка и кишечника, возникает сильная боль во рту, в глотке и по ходу желудочно-кишечного тракта, колики, слюнотечение, рвота, часто бурого цвета (с примесью крови), понос, иногда с кровью, сильная жажда, бледность, падение сердечной деятельности, задержка мочи, похолодание конечностей.
Для оказания помощи необходимо осторожное промывание желудка водой, подкисленной уксусной кислотой, обильное питье 1%-ного раствора лимонной, винной или уксусной кислоты, теплые водные ингаляции с несколькими кристалликами лимонной кислоты; надо глотать кусочки чистого льда; необходимо обильное питье молока, белковой воды, слизистого отвара, масляных эмульсий; при сильных болях показан холод на область живота (пузырь со льдом). При ухудшении состояния пострадавшему дают сердечные средства (кофеин).
Калия перманганат (калий марганцевокислый). Взрывается при обработке концентрированной серной кислотой в присутствии этанола, эфира, горючих материалов и воспламеняющихся газов. Следует хранить вдали от веществ, способных воспламеняться. При попадании кристаллов в глаза — удалить ватой, не промывать водой!
Калия персульфат (калий надсернокислый). Взрывается при соприкосновении с огнем. Следует хранить в сухом месте.
Калия хлорат (калий хлорноватокислый, бертолетова соль) и хлорат натрия. Сильные яды, поражающие кровь. При попадании внутрь вызывает тошноту, рвоту черно-зеленой массой, боли в животе, понос, головные боли и боли в области почек, удушье, серый цвет лица. Для оказания помощи дают активный уголь, затем слабительные средства. Рекомендуется также принимать 4,5%-ный раствор глюкозы и 10 мл 20%-ного раствора тиосульфата натрия. При соприкосновении с горючими веществами могут взрываться. Тушить лучше всего водой. Хранить реактив следует изолированно от горючих веществ, а также от кислот и серы.
Калия перхлорат (калий хлорнокислый). Образует горючие смеси с органическими веществами. Взрывается при соприкосновении с концентрированной серной кислотой. При тушении применяют воду. Перхлорат калия следует хранить в сухом месте вдали от кислот и горючих материалов.
Кальция оксид (негашеная известь). Вызывает раздражение слизистых оболочек и кожи, обжигая их (очень опасна при попадании в глаза!). Работать с ним необходимо в защитных очках.
При вдыхании пыли извести появляются царапание и першение в горле, боли в груди, затрудненное дыхание, кашель. Для оказания помощи необходима ингаляция водяными парами (в воду добавляют кристаллики лимонной кислоты), теплое сладкое молоко» банки, горчичники, сердечные и успокаивающие средства. При обливании оксида кальция водой происходит разогревание и увеличение в объеме, что может привести к разрыву сосуда. Хранить оксид кальция следует в сухом месте.
Калия нитрат, натрия нитрат, магния нитрат, кобальта нитрат (калий азотнокислый, натрий азотнокислый, магний азотнокислый, кобальт азотнокислый) могут вызывать раздражение кожи. Мешки или бочки, пропитанные распылившимся реактивом, способны воспламеняться. После воспламенения происходит очень интенсивное горение. Если в сфере огня находится небольшое количество реактива, то огонь можно залить водой. Если же в сфере огня находится большое количество реактива, воду применять не следует, так как это может привести к опасному сильному разбрызгиванию расплавленной соли. Тушить следует песком. Реактив хранить нужно в сухом месте, не допуская соприкосновения с горючими материалами. Удобнее хранить в стеклянной посуде.
Калия нитрит, натрия нитрит (калий азотистокислый, натрий азотистокислый). При подкислении растворов выделяются оксиды азота. При случайном попадании этих веществ внутрь наблюдается общая слабость, головная боль, головокружение, пульсация в висках, тошнота, рвота, боли в подложечной области, покраснение кожи лица, учащение пульса, понижение артериального давления, обильное потоотделение, оглушенное состояние, бред, потеря сознания. Для оказания помощи необходимо немедленно промыть желудок водой с активным углем; принять слабительное — столовая ложка английской или глауберовой соли на 1 л воды. Дают кислород.
Натрия гидросульфит. Натрий гидросернистокислый. Самопроизвольно разогревается на воздухе и при соприкосновении с влагой. Тушат песком или пеной из огнетушителя. Хранить следует в стеклянных банках небольшой емкости, поставленных в металлические ящики, в сухом месте, вдали от горючих материалов.
Натрия пероксид, калия пероксид, бария пероксид. Могут вызвать ожоги кожи подобно металлическому натрию или калию. Сами по себе пероксиды не горят и не взрываются, но в смеси с горючими веществами взрывчаты и могут легко воспламеняться при трении, ударе или смачивании небольшим количеством воды. Большие количества пероксидов бурно реагируют с водой, и может произойти взрыв. Тушат сухим песком или кальцинированной содой, но ни в коем случае не водой. Хранить пероксиды следует вдали от органических веществ и воды.
Магний металлический, сплавы магния (с высоким содержанием магния). Опасны при пожаре — возможен взрыв и разброс горящих частиц, которые, попадая на кожу, сильно поражают ее. Дым, образующийся при горении магния, может явиться причиной заболевания «литейной лихорадкой». Магний особенно горюч в виде порошка или стружки. Распаленный в воздухе порошок дает взрыв от искры. В компактном состоянии металл трудно воспламеняется. Тонкий порошок при соприкосновении с водой выделяет водород. Опасно соприкосновение порошка магния с хлором, бромом, йодом, окислителями, кислотами и щелочами.
Горящий магний засыпают большим количеством сухого графита. Небольшой очаг огня можно тушить песком. Нельзя применять воду или огнетушитель (как пенный, так и углекислотный). При тушении горящего магния следует находиться на достаточно безопасном расстоянии и особенно предохранять глаза и лицо. Магниевую стружку и порошок хранят в металлических, герметически закрывающихся сосудах вдали от воды, окислителей, хлора, брома, йода, кислот и щелочей.
Меди соединения (сульфат, нитрат, ацетат, карбонат, хлорид). При случайном попадании внутрь вызывает неприятный, металлический и вяжущий привкус во рту, повышенное слюноотделение, потерю аппетита, тошноту, обильную и повторяющуюся рвоту зеленого или сине-зеленого цвета, схваткообразные боли в животе, частый кровянистый стул. Наблюдается редкий пульс слабого наполнения, сильная жажда, общая слабость, головокружение, похолодание конечностей, судороги, потеря сознания; мочи мало, черного цвета.
Для оказания помощи нужно вызвать рвоту и искусственно поддерживать ее. Необходимы повторные и энергичные промывания желудка раствором перманганата калия (1:1000). Рекомендуется пить суспензию оксида магния (1:100), белковую воду, слабительное (1 столовую ложку английской или глауберовой соли на 1 л воды). На живот накладывают горячие припарки (смоченное горячей водой и отжатое полотенце или марлю). Не следует принимать масла, жиров, молока, кислот, касторового масла, при ухудшении состояния дать кофеин.
Мышьяк и его соединения (мышьяковистая кислота, мышьяковая кислота, арсенаты, арсениты, мышьяковистый ангидрид). При вдыхании пыли или заглатывании раствора наблюдается сильная головная боль, головокружение, общая слабость, сухость, чувство жжения в зеве и в пищеводе, затрудненное глотание, металлический привкус во рту, слюнотечение, тошнота, повторная не проходящая рвота, боли в животе; частые поносы, жажда, бледность, холодная кожа, падение сердечной деятельности, желтуха, судороги, потеря сознания.
Для оказания помощи необходимо обильно промыть желудок водой с углем или взвесью жженой магнезии (1 столовая ложка на 1 л воды), искусственно вызвать рвоту. Пить свежеприготовленное противоядие от мышьяка (Antidotum arsenici) с теплой водой по 1 столовой ложке каждые 5 мин до прекращения рвоты или взвесь (150:100) жженой магнезии через каждые 15 мин по 1 столовой ложке. Принять слабительное — 1 столовую ложку английской или глауберовой соли. Необходимо тепло (грелка на область живота). Надо пить молоко, масло, жиры, белковую воду, масляные эмульсии; принять сердечное средство — кофеин; при судорогах — растирать конечности, тепло; не давать кислых напитков.
Муравьиная кислота. Вызывает ожоги колеи. Пары раздражают дыхательные пути; с воздухом образуют взрывоопасные смеси. При попадании кислоты на кожу следует немедленно смыть ее большим количеством воды.
Натрия сульфид, калия сульфид (натрий сернистый, калий сернистый). Умеренно горючее вещество. При горении образуются газы (SO2), раздражающие дыхательные пути и глаза. При взаимодействии с минеральными кислотами обильно выделяют сероводород. Действуют на организм, как сероводород.
Салициловая кислота. Горючее вещество. Температура воспламенения 545°С. В мелкораздробленном состоянии образует с воздухом взрывчатые смеси. Для тушения применяют воду, песок и любые огнетушители. Хранить салициловую кислоту следует в сухом месте.
Свинца соединения (нитрат, ацетат, оксиды). Признаки отравления при попадании внутрь: металлический вкус и сухость во рту, белый налет на языке и слизистой оболочке рта, головная боль и боль в подложечной области, рвота, колики, черный или кровянистый стул, понос или спазматический запор, бред, судороги, паралич. Пульс замедленный. Коматозное состояние.
Для оказания помощи нужно подкожно ввести апоморфин и одновременно внутрь принять 20-30 г сульфата натрия или магния с водой. Необходимо промыть желудок раствором сульфата натрия, водой взвесью угля, принять противоядие от металлов – Antidotum metallorum, солевое слабительное, теплую ванну.
Серебра нитрат (серебро азотнокислое). Прижигает кожу и слизистые оболочки, давая почернение. При нагревании разлагается с выделением оксидов азота. Хранят в темном месте в банках оранжевого стекла. При попадании внутрь вызывает боли в животе. Слизистые оболочки рта становятся белого или серого цвета. Появляются рвота белыми, темнеющими на свету массами, головокружение, судороги, паралич.
Для оказания помощи промывают желудок 2%-ным раствором хлорида натрия, затем вводят слабительное. Необходимо пить 5%-ный раствор хлорида натрия по столовой ложке через каждые 10 мин, белковую воду, молоко, масляные эмульсии, слизистые отвары; делают клизмы из молока и раствора хлорида натрия и масляные. Лед на живот (в целлофановом мешочке через сухое полотенце).
Серная кислота. При попадании на кожу вызывает тяжелые ожоги. В случае пожара серная кислота образует опасные пары, которые раздражают и прижигают слизистые оболочки, особенно верхних дыхательных путей. Кислота разъедает металлы. Может вызвать пожар при соприкосновении с горючими веществами. Тушить следует песком или золой, воду применять нельзя. Серную кислоту хранят в стеклянных сосудах, оберегая их от повреждений. При хранении кислоту изолируют от металлических порошков, карбидов, солей азотной, хлорноватой, пикриновой кислот и от горючих материалов.
При попадании на кожу разбавленной кислоты после высыхания воды появляются ожоги, как и от концентрированной кислоты. Особенно опасно попадание кислоты в глаза. Попадание в рот и в пищевод вызывает тяжелые поражения.
Для оказания помощи при попадании кислоты на кожу немедленно следует смыть кислоту большим количеством воды, затем в тяжелых случаях сделать танниновые примочки. При попадании кислоты внутрь необходимо как можно скорее обильно промыть желудок водой. Принять внутрь жженую магнезию (MgO, 20:200), известковое молоко, яичный белок, слизистые отвары. Обожженную слизистую оболочку рта и глотки смазывают 2%-ным раствором кокаина. Показаны лед на живот, ингаляция содовым раствором. Надо глотать кусочки чистого льда. При поражении глаз немедленно промыть струей воды широко раскрытые глаза.
Диоксид серы (сернистый газ), триоксид серы (серный газ). Вызывают насморк, чихание, першение и царапание в горле, хрипоту, чувство стеснения и боли в груди, кашель, затрудненное дыхание, жжение в глазах и слезотечение. Для оказания помощи необходимо снять стесняющую и затрудняющую дыхание одежду. Рекомендуются покой и тепло, влажные ингаляции 2-3%-ным раствором соды; теплое молоко с боржомом, маслом, медом; кислород, сердечные и успокаивающие средства; банки, горчичники. При затрудненном дыхании ввести в нос 5 капель 2-3%-ного раствора эфедрина в смеси с раствором адреналина. При поражении глаз — промывание струей воды и затем прохладные примочки.
Сероводород. Очень ядовит. Пребывание от 30 мин до 1 ч в атмосфере, содержащей 0,05-0,07% (об.) сероводорода, вызывает опасное отравление. В лаборатории работы с сероводородом проводятся только под тягой. Сероводород способен гореть. С воздухом и кислородом образует горючие и взрывоопасные смеси (при содержании от 4,3 до 46% сероводорода смесь взрывается). Температура воспламенения 346-349°С.
При отравлении сероводородом появляются головная боль, головокружение, общая слабость, понижение аппетита, тошнота, рвота, частый, иногда аритмичный пульс, пошатывание при ходьбе, расстройство координации движений, судороги, состояние возбуждения на фоне общего оглушенного состояния, иногда отек легких. Для оказания помощи пострадавшего следует вывести на свежий воздух, дать кислород; снять стесняющую и затрудняющую дыхание одежду, обеспечить покой и тепло. При необходимости делают искусственное дыхание, ставят грелки к ногам, дают сердечные средства.
Соляная кислота. Вызывает ожоги кожи. Пары вызывают сильное раздражение слизистых оболочек глаз и носа. При соприкосновении со многими металлами выделяет водород, который с воздухом образует взрывчатую смесь. При тушении пожара применяют воду, соду или известь. Необходимо оберегать сосуды с кислотой от повреждений. Хранят в отдалении от окислителей, особенно от азотной кислоты и солей хлорноватой кислоты. Недопустимо соприкосновение с металлами.
При вдыхании паров соляной кислоты появляется удушье, кашель, катар дыхательных путей. Разрушающе действует на зубы, ведет к расстройству пищеварения, вызывает сердцебиение. При систематических попаданиях растворов кислоты на кожу появляются тяжелые ожоги. При отравлении парами соляной кислоты обеспечить свежий воздух, вдыхание распыленных водяных паров с примесью аммиака. При попадании кислоты на кожу — обильно промыть ее водой, затем обработать кашицей из соды; при попадании паров или растворов в глаза — немедленно обильно промыть водой, затем 1%-ным раствором соды.
Синильная кислота и ее соли (цианид калия, цианид натрия). Сильные яды. Признаки легкой и средней тяжести отравлений: головная боль, головокружение, общая слабость, ощущение горького, неприятного, металлического привкуса во рту; тошнота, рвота, чувство жжения и царапания в полости рта, носу, глотке. Дыхание учащено; ощущается биение пульса в височной области (в артериях). При непосредственном действии паров синильной кислоты явления отравления протекают очень быстро: при 2-3 вдохах наступают общие судороги, иногда сопровождаемые непроизвольным криком, потеря сознания и смерть через 1-3 мин от паралича дыхания.
При отравлении (путем вдыхания) немедленно удалить пострадавшего из отравленной атмосферы. Необходимы свежий воздух, покой, тепло, вдыхание 0,3 мл амилнитрата. Принимать средства, возбуждающие дыхание и кровообращение: лобелин, кордиамин, адреналин, эфедрин, вдыхать кислород. При необходимости пострадавшему делают искусственное дыхание. При случайном попадании внутрь — немедленное промывание желудка раствором перманганата калия (1:1000) или 1-3%-ным раствором пероксида водорода или 5%-ным раствором тиосульфата натрия.
Ртути соли (сулема, каломель, киноварь, нитраты ртути). Ртуть металлическая при приеме внутрь, даже в больших количествах, почти не дает отравлений. При случайном попадании солей ртути внутрь появляются общая слабость, сильная головная боль, понижение аппетита, тошнота, рвота, металлический вкус во рту, боли в подложечной области, понос, иногда с кровью, насморк, кашель, хрипота, боль при глотании. Подчелюстные железы увеличены и резко болезненны. Раздражение почек — в моче эритроциты, белок, почечные элементы, соли ртути; кровотечения из половых органов; поражение крови — лейкоцитоз, моноцитоз, ускоренное РОЭ.
Для оказания помощи — полоскание рта 5%-ным раствором хлорида цинка и смазывание десен вяжущими средствами. Немедленно принять внутрь 100 мл противоядия от металлов – Antidotum metallorum, после чего через 10 мин промыть желудок водным раствором этого же противоядия (100 мл противоядия в 2-4 л воды). При отсутствии противоядия промыть желудок водной взвесью активного угля или жженой магнезии с водой, пить молоко, белковую воду, слизистые отвары.
Уксусная кислота (ледяная). Вызывает тяжелые ожоги кожи. Пары сильно раздражают слизистые оболочки. Опасно соприкосновение с хромовым ангидридом, пероксидом натрия и азотной кислотой — может произойти воспламенение. Тушат водой. Уксусную кислоту хранят в стеклянных сосудах при температуре выше 16°С. Ниже 16 °С она переходит в твердое состояние и может разорвать сосуд при расширении. Уксусную кислоту хранят изолированно от окислителей — хромового ангидрида, пероксида натрия и азотной кислоты.
При случайном попадании внутрь вызывает побеление языка, слизистой оболочки рта, сильные боли в животе, рвоту, затрудненное дыхание, замедление пульса, понижение температуры, расширение зрачков. На коже вызывает появление желтых пятен вследствие распада эритроцитов. Для оказания помощи рекомендуются внутрь известковая вода, молоко, слабительные средства. Пораженную кожу обильно промывают водой, делают примочки известковым молоком.
Фтористоводородная кислота (плавиковая кислота). Кислота и ее пары чрезвычайно ядовиты — вызывают раздражение кожи, глаз и дыхательных путей. Дым, образующийся в присутствии аммиака, также ядовит. Разрушающе действует на стекло и многие другие вещества. Не действует на платину. Если фтористоводородная кислота оказалась в сфере огня, то для тушения можно применять воду. Если в воздухе содержится фтористый водород, необходимо применять изолирующий противогаз (кислородную маску).
При отравлении парами этой кислоты появляется слезотечение, резь в глазах, першение в горле, охриплость голоса, боль в груди, сильный кашель и повышенное слюноотделение. Для оказания помощи — содовые ингаляции, теплое молоко с боржомом, горчичники, банки, кислород. При ожогах кислотой немедленно промывают кожу проточной водой несколько часов до тех пор, пока побелевшая поверхность кожи не покраснеет. Затем накладывают свежеприготовленную 20%-ную суспензию оксида магния в глицерине.
Диэтиловый эфир (этиловый эфир). Обладает наркотическим действием. С воздухом и кислородом образует горючие и взрывчатые смеси. Температура воспламенения 180°С. Пары эфира в 2,6 раза тяжелее воздуха и могут растекаться на значительные расстояния, достигая отдаленного источника огня. Тушат песком или огнетушителем. Небольшие количества горящего эфира удается потушить тетрахлоридом углерода.
Хранят в стеклянных бутылях или жестяных сосудах, помещенных в железные ящики. Сосуды следует оберегать от повреждений. Большие количества эфира хранят в неотапливаемом помещении, защищая от действия солнечного света и источников огня (пламени). Электропроводка должна быть безопасной в пожарном отношении.
При вдыхании наблюдается сонливость, полная потеря чувствительности, гиперемия (покраснение) лица, сужение зрачков, затем при асфиксии (удушье) зрачки расширены, упадок сердечной деятельности и дыхания. Для оказания помощи показаны свежий воздух, кислород с 5% диоксида углерода, искусственное дыхание.
Ожоги
Ожоги могут быть вызваны горячими и раскаленными предметами, а также веществами с очень низкой температурой (например, жидким или твердым диоксидом углерода, жидким кислородом) и едкими веществами (щелочами, кислотами, бромом и др.).
Меры предосторожности:
При переноске сосуда с горячей жидкостью необходимо держать его обеими руками, отстранив от себя, поддерживая одной рукой дно сосуда, под которое подложено полотенце. Для переноски большого числа сосудов следует пользоваться деревянным подносом с высокими закраинами;
Едкие жидкости, кислоты, аммиак и др. нужно разливать с помощью стеклянного сифона с грушей или специального наклоняющегося штатива. Если нет сифона и штатива, то жидкости разливают обязательно вдвоем. Для этого бутыль помещают в корзину с двумя ручками. Разливают жидкости в специальной одежде — резиновом переднике и перчатках. Глаза необходимо предохранять защитными очками;
При разбавлении серной кислоты необходимо приливать кислоту тонкой струйкой в холодную воду и при этом хорошо размешивать смесь. Нельзя вливать воду в концентрированную серную кислоту;
Кислоты или щелочи можно нейтрализовать только после разбавления;
Куски щелочи следует брать пинцетом, щипцами или фарфоровой ложечкой. Необходимо работать в резиновых перчатках;
Нельзя засасывать едкие жидкости в пипетку ртом. Засасывают жидкости с помощью груши или специального приспособления;
Перед нагреванием фильтраты необходимо перемешать, так как или из-за различной плотности верхнего (промывной жидкости) и нижнего слоя вследствие местного перегрева может произойти внезапное вскипание жидкости, что может вызвать разбрызгивание или выброс жидкости из стакана;
Вскрывать склянки с бромом, пероксидом водорода, фтористоводородной кислотой и другими едкими жидкостями необходимо очень осторожно, чтобы не повредить тару; при открывании пробки горло склянки следует держать в направлении «от себя».
Первая помощь при ожогах:
При ожоге от огня, пара, горячих предметов не следует смачивать обожженное место водой. Ни в коем случае нельзя вскрывать образовавшиеся пузыри и перевязывать обожженное место бинтом.
Различают три степени ожогов. Первая степень — покраснение. Обожженное место обрабатывают ватой, смоченной этиловым спиртом. Вторая степень — образование пузырей. Обожженное место обрабатывают спиртом, как и при ожоге первой степени. Можно обрабатывать также 3%-ным раствором перманганата калия или 5%-ным водным раствором таннина. Третья степень — омертвение кожной ткани. Накрывают рану стерильной повязкой (марлей) и вызывают врача. При слабых ожогах применяют специальную мазь от ожогов;
При ожогах кислотами (серной, соляной, азотной, фосфорной), а также бромом обожженный участок кожи промывают большим количеством воды, затем 5%-ным раствором бикарбоната натрия или 10%-ным раствором карбоната аммония, а затем снова водой.
При ожогах щелочами обожженное место промывают большим количеством воды, затем 3-6%-ным (по объему) раствором уксусной кислоты или 1-2%-ным раствором соляной кислоты, после чего снова промывают водой.
При ожогах глаз щелочами промывают глаза струей воды. При этом глаз (или оба глаза) должны быть по возможности широко раскрыты. Затем промывают глаза 2%-ным раствором борной кислоты или 3%-ным раствором уксусной кислоты. При поражении глаз кислотами промывают 3-5%-ным раствором бикарбоната натрия.
При ожогах полости рта растворами щелочей необходимо полоскание 3%-ным раствором уксусной кислоты или 2%-ным раствором борной кислоты. При ожогах кислотой — полоскание 5%-ным раствором бикарбоната натрия.
При попадании кислоты в дыхательные пути необходимо дышать распыленным с помощью пульверизатора 10%-ным раствором бикарбоната натрия, при попадании щелочи — распыленным 3%-ным раствором уксусной кислоты.
Первая помощь при ранениях
Сначала очищают рану от осколков стекла стерильным пинцетом или стерильной марлей, а затем смазывают края раны (но не саму рану!) настойкой йода. Если порез небольшой, то можно промыть рану водой с мылом и присыпать белым стрептоцидом или порошком другого сульфамидного препарата и перевязать рану стерильным бинтом. Не следует допускать попадания ваты в рану.
При ранениях с одновременным поражением кислотой или щелочью быстро очищают рану от осколков стекла и промывают ее соответствующим раствором (3%-ной уксусной кислотой или 3-5%-ным раствором бикарбоната натрия), затем рану смазывают по краям настойкой йода и забинтовывают стерильным бинтом или марлей. В случае серьезного поражения и сильного кровотечения накладывают тугую повязку (жгут) выше раны для остановки кровотечения. До прихода врача рана должна быть накрыта стерильной повязкой (марлей). Жгут можно держать не более двух часов.
Отравления
Меры предосторожности при работе с ядовитыми веществами:
Все работы, связанные с выделением ядовитых газов, выполняют в вытяжном шкафу. К таким работам относятся: а) растворение металлов и руд в азотной кислоте с выделением оксидов азота; б) обработка солянокислых растворов хлоратом калия с выделением хлора; в) выпаривание и обработка фтористоводородной кислотой и ее солями, выделяющими фтор или его соединения; г) действие кислоты на технический цинк, обычно содержащий мышьяк, сопровождающееся выделением мышьяковистого водорода; д) подкисление растворов, содержащих цианиды; е) подкисление растворов, содержащих роданиды; ж) сильное подкисление растворов, содержащих ферроцианид калия (или натрия); з) подкисление растворов сульфидов; и) подкисление растворов, содержащих соли брома; к) выпаривание сероводородных растворов; л) осаждение сульфидов металлов сероводородом; м) очистка и заправка аппаратов для получения сероводорода; и) прокаливание осадков, содержащих ртуть и мышьяк; о) разливка аммиака, брома и других едких жидкостей.
В тех случаях, когда изоляция от выделяющихся ядовитых газов по условиям работы невозможна, следует работать в специальных защитных масках;
Работать с ядами необходимо в халатах и резиновых перчатках. После работы с ядами следует тщательно вымыть руки. Место, где проводились работы с ядами, тщательно протирают несколько раз тряпкой, смоченной теплой водой. Работа с ядами регламентируется специальными постановлениями и инструкциями, утвержденными соответствующим порядком, которые размещены на рабочих местах;
Ядовитые вещества хранят в хорошо закупоренной посуде с надписью на этикетке «яд» в отдельном, запирающемся на замок шкафу.
Первая помощь при отравлениях
При отравлении ядовитыми газами пострадавшего следует немедленно вывести на свежий воздух и дать вдыхать кислород из кислородной подушки. При заметном ослаблении дыхания делают искусственное дыхание с применением кислорода.
Кислород можно вдыхать из любого источника (баллона, газометра). Для этого на трубку воронки диаметром примерно 12 см надевают резиновую трубку и соединяют ее с источником кислорода. Осторожно открыв кран или вентиль редуктора и отрегулировав требуемый ток кислорода, покрывают воронкой рот и нос пострадавшего. Пострадавшему дают пить большое количество молока (в некоторых случаях — кофе) и предоставляют покой.
Некоторые лекарственные вещества, применяемые при отравлениях
Белковая вода. Один яичный белок размешать в стакане воды. Обволакивающее средство.
Известковая вода. (Aqua calis). Принимают внутрь по одной столовой ложке через 5-10 мин 100 мл известковой воды, разбавленной водой до 1 л, для промывания желудка. Обезвреживает яды.
Карбоген (Carbogenium). Смесь диоксида углерода (5-7%) с кислородом. Возбуждает дыхание и улучшает кровообращение.
Магнезия жженая MgO (Magnesia usta). Принимают внутрь 30-50 г в стакане воды на один прием, повторно через 1-2 ч. Взвесь 50-70 г в 600-800 мл воды для промывания желудка. Обезвреживает и адсорбирует яды.
Магния сульфат (Magnesium sulfuricum). Принимают внутрь 20-30 г на 1-2 стакана воды или в виде раствора вводят в желудок через зонд. Слабительное.
Меди сульфат (Sol. Cuprum sulfuricum). 1%-ный раствор. Принимают внутрь чайными ложками каждые 5 мин до наступления рвоты. Рвотное.
Натрия бикарбонат (Sol. Natrii bicarbonici). Принимают внутрь 2-2,5%-ный раствор столовыми ложками, 1-2%-ный раствор используют для промывания желудка. Обезвреживает яды.
Натрия хлорид (Sol. Natrii ohlorati). Используют 2,5%-ный раствор для промывания желудка или для питья столовыми ложками каждые 10 мин (при отравлении нитратом серебра).
Противоядие от металлов (Antidotum metallorum). После разбавления в 300 мл воды принимают внутрь 50-100 мл или 200 мл для промывания желудка. Нейтрализует яды (тяжелые металлы, мышьяк).
Противоядие от мышьяка (Antidotum arsenici). Принимают внутрь по столовой ложке каждые 5 мин до прекращения рвоты. Состав: а) Lig Ferri sulfurici oxidati 100,0 + Aq. destill., 300,0 и б) Magnesia usta 20,0 + Aq. destill. 300,0. Оба состава смешивают перед употреблением и принимают каждые 5 мин по столовой ложке с теплой водой до прекращения рвоты. Перед употреблением взбалтывать. Нейтрализует яды.
Слизистые отвары (Mucilago salep или Mucilago gummi arabici). Принимают внутрь по 15-20 мл, разведя в 200 мл воды и добавив 15-20 г сахара, т.е. столовыми ложками через каждые 5-10 мин. Можно применять отвар льняного семени, риса или овсяной крупы (1 столовая ложка крупы на стакан воды). Обволакивающее.
Тиосульфат натрия (Sol. Natrii hyposulfurosi). Применяют 0,5%-ный раствор для промывания желудка, 700-1000 мл. Обезвреживает яды.
Уголь активный (Carbo activatus). Принимают внутрь взвесь из одной столовой ложки активного угля в двух стаканах воды; для промывания желудка — взвесь из одной столовой ложки угля и 500 мл воды. Обезвреживает яды. Можно применять таблетки активного угля.












