Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа № 2»
Коркинский муниципальный район
Водород как альтернативный вид топлива
Тип проекта: исследовательский
Выполнил
Ученик 9 Д класса
Грознецкий Павел Сергеевич
Проверил наставник:
учитель химии
Воробьёва Ирина Ивановна
Допускается к защите Дата сдачи:______________________
Наставник ____________________ Дата защиты:____________________
«_____» декабря 2018г Оценка:_________________________
2018 год
СОДЕРЖАНИЕ
I. ВВЕДЕНИЕ 3
II. ОСНОВНАЯ ЧАСТЬ
2.1 Теоретическая часть 4
2.1.1 Водородная технология 4
2.1.2 Получение водорода 5
2.1.3 Получение водорода – будущая технология 6
2.1.4 Водородные двигатели 7
2.2 Практическая часть 8
III. ЗАКЛЮЧЕНИЕ 9
СПИСОК ЛИТЕРАТУРЫ 10
ПРИЛОЖЕНИЯ 11
I. ВВЕДЕНИЕ
В миллионы новых моделей автомобилей, которые сейчас выпускаются, заливают такое топливо, которое выпускает в атмосферу углекислый (СО2) и угарный (СО) газы. Дышать таким воздухом и постоянно находиться в такой атмосфере представляет очень большую опасность для здоровья.
Влияние и польза водорода в наши дни очень велика. Практически все известные сейчас виды топлива, за исключением водорода, загрязняют окружающую среду.
Цели: Изучить самое экологически чистое топливо, и его применение.
Задачи: Предложить замену загрязняющим видам топлива.
Объект исследования: Свойства водорода, как топлива.
Предмет исследования: Водородная технология.
Гипотеза: Водород можно использовать как самый экологически чистый вид топлива.
II. ОСНОВНАЯ ЧАСТЬ
2.1 Теоретическая часть
Водород – один из наиболее распространённых элементов и на Земле. Он составляет примерно 0,88 % от массы земного шара. Если вспомнить, что массовая доля водорода в воде составляет 11,19 %, то становится ясно, что сырья для получения водорода на Земле – неограниченное количество. Водород входит в состав нефти (10,9 – 13,8 %), древесины (6 %), угля (бурый уголь – 5,5%), природного газа (25,13 %). Водород входит в состав всех животных и растительных организмов. Основная масса водорода попадает в атмосферу в результате биологических процессов. Этот водород в атмосфере быстро рассеивается и диффундирует в верхние слои атмосферы.
2.1.1 Водородная технология
Под водородной технологией подразумевается совокупность промышленных методов и средств, для получения, транспортировки и хранения водорода, а также средств и методов его безопасного использования на основе неисчерпаемых источников сырья и энергии.
Переход транспорта, промышленности, быта на сжигание водорода – это путь к радикальному решению проблемы охраны воздушного бассейна от загрязнения оксидами углерода, азота, серы, углеводородами.
Переход на водородную технологию и использование воды в качестве единственного источника сырья для получения водорода не может изменить не только водного баланса планеты, но и водного баланса отдельных её регионов.
Водород, получаемый из воды, - один из наиболее энергонасыщенных носителей энергии. Ведь теплота сгорания 1 кг H2 составляет (по низшему пределу) 120 МДж/кг, в то время как теплота сгорания бензина или лучшего углеводородного авиационного топлива в 2,5 раза меньше, к тому же водород – легковозобновляемое топливо.
Но водород как топливо и химическое сырьё обладает и рядом других ценнейших качеств. Универсальность водорода заключается в том, что он может заменить любой вид горючего в самых разных областях энергетики, транспорта, промышленности, в быту. Он заменяет бензин в автомобильных двигателях, керосин в реактивных авиационных двигателях, ацетилен в процессах сварки и резки металлов, природный газ для бытовых и иных целей, метан в топливных элементах, кокс в металлургических процессах (прямое восстановление руд), углеводороды в ряде микробиологических процессов. Водород легко транспортируется по трубам и распределяется по мелким потребителям, его можно получать и хранить в любых количествах. В то же время водород – сырьё для ряда важнейших химических синтезов (аммиака, метанола, гидразина), для получения синтетических углеводородов.
Вобщем, переход транспорта, промышленности, быта на сжигание водорода – это путь к радикальному решению проблемы охраны воздушного бассейна.
2.1.2 Получение водорода
В распоряжении современных технологов имеются сотни технических методов получения водородного топлива, углеводородных газов, жидких углеводородов, воды. Выбор того или иного метода диктуется экономическими соображениями, наличием соответствующих сырьевых и энергетических ресурсов. Например, в странах, где имеется дешёвая избыточная электроэнергия, вырабатываемая на гидроэлектростанциях, можно получать водород электролизом воды (Норвегия); где много твёрдого топлива и дороги углеводороды, можно получать водород газификацией твёрдого топлива (Китай); где дешёвая нефть, можно получать водород из жидких углеводородов (Ближний Восток). Однако больше всего водорода получают в настоящее время из углеводородных газов конверсией метана и его гомологов (США, Россия).
В процессе конверсии метана водяным паром, диоксидом углерода, кислородом и водяным паром протекают следующие каталитические реакции. Рассмотрим процесс получения водорода конверсией природного газа (метана).
Получение водорода осуществляется в три стадии. Первая стадия – конверсия метана в трубчатой печи:
CH4 + H2O = CO + 3H2↑ – 206,4 кДж/моль
или
CH4 +CO2 = 2CO + 2H2↑ – 248, 3 кДж/моль.
Вторая стадия связана с доконверсией остаточного метана первой стадии кислородом воздуха и введением в газовую смесь азота, если водород используется для синтеза аммиака. (Если получается чистый водород, второй стадии принципиально может и не быть).
CH4 + 0,5O2 = CO + 2H2↑ + 35,6 кДж/моль.
И, наконец, третья стадия – конверсия оксида углерода водяным паром:
CO + H2O = СO2 + H2↑ + 41,0 кДж/моль.
Для всех указанных стадий требуется водяной пар, а для первой стадии – много тепла, поэтому процесс в энерготехнологическом плане проводится таким образом, чтобы трубчатые печи снаружи обогревались сжигаемым в печах метаном, а остаточное тепло дымовых использовалось для получения водяного пара.
Таким образом, водород получают из метана, электролизом воды и газификацией твёрдого топлива.
2.1.3 Получение водорода – будущая технология
Современная технология обеспечивает ежегодное получение во всём мире десятков миллионов тонн молекулярного водорода. Более 90% его получается каталитической конверсией метана, жидких углеводородов, газификацией твёрдого топлива. Совершенно ясно, что в будущем при переходе на водородную технологию такие источники получения водорода, кроме твёрдого топлива, будут в основном исключены. В качестве основного источника сырья будет использоваться вода. В качестве источника энергии для разложения воды – атомная энергия в различных её видах (тепло, электроэнергия) и энергия воды, ветра в виде электрической энергии, энергия солнечного излучения.
Водород получают в газообразном виде и, если для использования необходим жидкий водород, его подвергают глубокому охлаждению и ожижению.
Производство молекулярного водорода в 1985 году достигло примерно 57 млн. тонн, а в 1990 году уже 95.
Водород используется:
Во-первых, в азотной промышленности, для получения синтетического аммиака.
Во-вторых, для получения метанола из СО и Н2, Значительное количество водорода используется в нефтехимической промышленности, для гидрирования тяжелых нефтяных фракций и повышения выхода легких фракций, в ряде нефтехимических синтезов, для гидрирования жиров, для восстановления руд черных и цветных металлов, для бытовых целей, жидкий водород необходим в авиации и космонавтике.
Мы, здесь не раскрываем широкое использование водорода в промышленности (водородная сварка и резка металлов, микроэлектроника и т. д.), в сельском хозяйстве. Особо стоит вопрос об использовании изотопов водорода в атомной и термоядерной энергетике.
В будущем потребление водорода будет расти более высокими темпами. Возникнет промышленность синтетического жидкого и газообразного топлива на базе твердых горючих ископаемых.
Водород - очень перспективный энергоноситель, позволяющий одновременно решить сложные экологические проблемы. При его сгорании (быстро протекающей экзотермической реакции окисления кислородом) получаются лишь вода и тепло. Да, образуются еще окислы азота, количество которых зависит от температуры сгорания смеси в цилиндре двигателя. И, здесь важно, что в водородных двигателях, температура сгорания топлива, на режимах городской эксплуатации, существенно ниже, чем в углеводородных (бензиновых, спиртовых, метановых, пропан-бутановых и т.д.).
"Водородное будущее" автотранспорта эксперты связывают, прежде всего, с топливными элементами. Их притягательность признают все.
Ford, General Motors, Toyota, Nissan и многие другие компании наперебой щеголяют "топливоэлементными" концепткарами и собираются вот-вот "завалить" всех водородными модификациями некоторых из своих обычных моделей.
Водородные заправки уже появились в нескольких местах в Германии, Японии, США. В Калифорнии строят первые станции по электролизу воды, использующие ток, выработанный солнечными батареями. Аналогичные эксперименты проводят по всему миру.
Между тем, есть ещё один путь внедрения водорода на автотранспорте — сжигание его в ДВС. Такой подход исповедуют BMW и Mazda. Японские и немецкие инженеры видят в этом свои преимущества.
Прибавку в весе машины даёт лишь водородная топливная система, в то время, как в авто на топливных элементах прирост (топливные элементы, топливная система, электромоторы, преобразователи тока, мощные аккумуляторы) — существенно превышает "экономию" от удаления ДВС и его механической трансмиссии.
Итак, мы убедились, что водород - очень перспективный вид топлива, который уже используется в автотранспорте.
2.2 Практическая часть
2.2.1.Получение водорода в лабораторных условиях
В лабораториях водород получают большей частью электролизом водных растворов гидроксидов натрия и калия (NaOH, KOH)
или же выделяют из растворов серной или соляной кислот действием на них цинка. Например:
Zn + H2SO4 = ZnSO4 + H2↑ ;
Кроме этого водород выделяется в ходе реакции:
Ca + 2H2O = Ca(OH)2 + H2↑ ;
NaH + H2O = NaOH + H2↑ ;
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑ ;
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2↑;
Также, с помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O + 2e- = 2H2O + H2↑ ;
III. ЗАКЛЮЧЕНИЕ
В результате написанной работы я очень много узнал о таком важном, незаменимом, и интереснейшем веществе на нашей планете, как водород. Сколько бесценной информации уже смогли открыть учёные, изучая его, и сейчас, остаётся только гадать, что ещё можно открыть и узнать.
Я узнал, что у нашего мира ещё есть возможность хоть как то наладить экологическую обстановку, но захотят ли это сделать остальные, и будет ли им интересны дальнейшие разработки учёных этой отрасли, которые, тоже являются людьми этой планеты имеющие прямую заинтересованность в этом вопросе.
Переход транспорта, промышленности, быта на сжигание водорода – это путь к радикальному решению проблемы охраны воздушного бассейна. Водород получают из метана, электролизом воды и газификацией твёрдого топлива, без вреда окружающей среды.
В будущем потребление водорода будет расти более высокими темпами. Возникнет промышленность синтетического жидкого и газообразного топлива на базе твердых горючих ископаемых.
Как мы видим из всех доказательств, приведённых в работе, по тому, что мы узнали, мы теперь уверены, что водород – это не просто элемент, водород – топливо будущего.
СПИСОК ЛИТЕРАТУРЫ
Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов. — М.: Издательство «Экзамен», 2005.
Учебный справочник школьника. Учебное издание. — М.: Дрофа, 2001.
Дигонский С. В., Тен В. В. Неизвестный водород. — СПб: Наука, 2006. ISBN 5-02-025114-3
Рифкин Дж. Если нефти больше нет... Кто возглавит мировую энергетическую революцию? = The Hidrogen Economy: The Creation of the World-Wide Energy Web and the Redistribution of Power on Earth. — М.: Секрет фирмы, 2006. — 416 с. — 3 000 экз. — ISBN 5-98888-004-5.
Козлов С. И. Водородная энергетика: современное состояние, проблемы, перспективы. - М.: Газпром ВНИИГАЗ, 2009. - 520 с. -ISBN 5-89754-062-4;
Кузык Б. Н., Яковец, Ю. В. Россия: стратегия перехода к водородной энергетике. - М.: Институт экономических стратегий, 2007. - 400 с. - ISBN 978-5-93618-110-8;
Клямкин С. Н. Водородная энергетика: достижения и проблемы / С. Н. Клямкин, Б. П. Тарасов // Возобновляемые источники энергии. Вып. 5 : 6 Всерос. науч.-молодежная школа, Москва, 26-27 нояб. 2008 г. – М., 2008. – С. 147-157.
Кузык Б. Партнерство государства и бизнеса : перспективы в сфере возобновляемых источников энергии // Проблемы теории и практики управления. – 2008. – № 7. – С. 8-19.
Водород // Химическая энциклопедия: в 5 т / Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1: Абл—Дар. — С. 400—402. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
Водород // Химическая энциклопедия: в 5 т / Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1: Абл—Дар. — С. 400—402. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
Канило П. М., Костенко К. В. Перспективы становления водородной энергетики и транспорта // Автомобильный транспорт (Харьков). - 2008. - № 23. - С. 107-113.
ПРИЛОЖЕНИЯ
Лабораторная работа
Тема: Получение водорода
Цель: Получить водород, используя лабораторное оборудование.
Оборудование: Аппарат Киппа, аппарат Кирюшкина, штатив, пробирка, спиртовка.
|  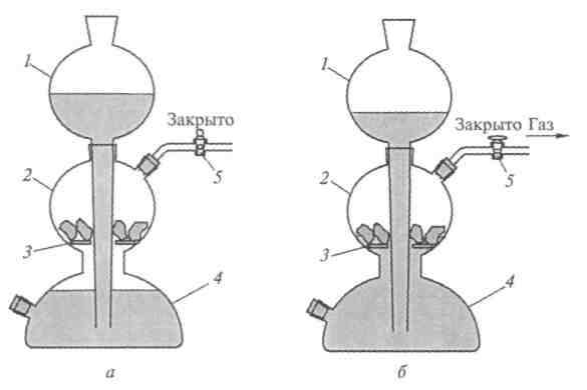
| Аппарат Киппа
В собранный прибор через боковой отвод реактора насыпают твердый реактив. Реактив должен быть в виде кусочков, а не мелкого порошка (порошок вступает в реакцию слишком быстро). Потом на отвод надевается резиновая трубка с открытым краном или зажимом.
Следующий шаг — залить через воронку жидкий реактив, так чтобы его уровень достиг твердого реактива в реакторе и началась химическая реакция.
Примерно в течение 5 минут ждут, чтобы газ полностью вытеснил воздух из аппарата, и закрывают кран (зажим) на газоотводной трубке. Давление газа вытеснит всю жидкость из реактора обратно в воронку и реакция прекратится.
Аппарат готов к работе. Стоит открыть газоотводную трубку, как давление газа уменьшится, жидкость поднимется до реактора, химическая реакция запустится вновь и газ будет генерироваться до тех пор, пока не закончится весь реактив. Чтобы прекратить выделение газа, достаточно перекрыть газоотводную трубку, поэтому этот газогенератор и называют аппаратом автоматического действия. |
| 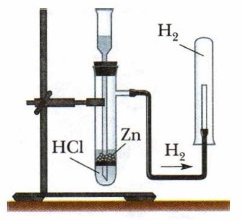 
| Аппарат Кирюшкина В пробирку с газоотводной трубкой, помещают гранулы цинка, а в воронку заливается кислота.
Чтобы привести аппарат в рабочее состояние, надо залить через воронку жидкий реактив, так чтобы его уровень достиг твердого реактива в реакторе и началась химическая реакция.
Примерно в течение 5 минут ждут, чтобы газ полностью вытеснил воздух из аппарата, и закрывают кран (зажим) на газоотводной трубке. Давление газа вытеснит всю жидкость из реактора обратно в воронку и реакция прекратится.
Аппарат готов к работе. Стоит открыть газоотводную трубку, как давление газа уменьшится, жидкость поднимется до реактора, химическая реакция запустится вновь и газ будет генерироваться до тех пор, пока не закончится весь реактив.
Чтобы собрать водород, можно поступить методом вымещения газа, так как водород легче воздуха, и методом вытеснения воды |
|  
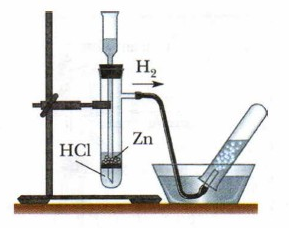
| Получение водорода в пробирке
Осторожно опускаем в пробирку 3-4 кусочков цинка, закрепим пробирку в штативе.
Наливаем соляную кислоту (2–3 см.). Пробирку закрываем пробкой с газоотводной трубкой. На верхний конец трубки надеваем сухую пробирку.
Проверка водорода на чистоту. Через минуту снимаем пробирку с трубки и, не переворачивая, поднесем её отверстием к пламени. Если водород сгорит с легким глухим хлопком, то это доказывает, что он чистый. Если раздастся свистящий звук, то водород смешан с кислородом воздуха. |
Вывод: В лаборатораторных условиях для получения небольшого количества водорода, используют специальные приборы.
12























