| Строение атома элемента и распространение в природе Ι группа ПС | +3Li ﴿﴿ | 1 увеличиваются свойства: металлические восстановительные уменьшается: Электроотрицательность s22s1
| | +11Na ﴿﴿﴿ | 1s22s22p63s1 | | +19K ﴿﴿﴿﴿ | 1s22s22p63s23p64s1 | | +37Rb﴿﴿﴿﴿﴿ | 1s22s22p63s23p64s23d104p65s1 | | +55Cs ﴿﴿﴿﴿﴿﴿ | 1s22s22p63s23p64s23d104p65s24d105p66s1 | Me0 - 1e → Me+1, сильные восстановители, СО = 0, 1 | Основные природные соединения | Распространение | | Li | Li2O*Al2O3*4SiO2 | (28 место), 3,2*10-3 % по m | | Na | NaСl, Na2SO4 *10H2O, NaСl* KСl | (6 место), 2,5% по m | | K | KСl, NaСl* KСl, KСl*MgCl2 *6 H2O | (7 место), 2,5% по m | | Rb | В качестве примесей в минералах калия | (20 место), рассеян,1,5*10-2 % по m | | Cs | 4Cs2O* 4Al2O3*18SiO2*2 H2O | редкий металл, 3,7*10-4 % по m |
| С Металлическая связь - осуществляют относительно свободные электроны и положительно заряженные ионы металла троение и физические свойства Металлическая связь - осуществляют относительно свободные электроны и положительно заряженные ионы металла 
Все элементы существуют в виде твердых металлов. Высокая тепло - и электропроводность, пластичны; Низкие tпл.; tкип; ρ tпл. Li =189,50 C; tкип Li. =13170 C; ρL i= 0,534г/см tпл. Na =97,830 C; tкип. Na = 882,90 C; ρNa = 0,968г/см tпл. K =63,550 C; tкип. K = 7600 C; ρK = 0,962г/см tпл. Rb =38,90 C; tкип. Rb =7030 C; ρRb =1,525г/см tпл. Сs =28,50 C; tкип. Сs = 7050 C; ρСs = 1,90г/см С Na, K - мягкие, серебристые (режутся ножом) Na K Сs Rb    Li оединения окрашивают пламя: |
| Химические свойства Взаимодействие с простыми веществами 2Ме + Г2 → 2МеГ (написать соответствующие реакции, указать окислитель, восстановитель); 2Ме+ H2 → 2МеH (гидриды) 2Ме + S → Ме2S (сульфиды) 3Ме +P → Ме3P (фосфиды) 2Ме + N2 → Ме3N (нитриды) (написать соответствующие реакции, указать окислитель, восстановитель); С кислородом литий образует оксид, остальные металлы - пероксиды. 4Li + O2 → 2 Li2O; 2 Na + O2 → Na2O2; Взаимодействие со сложными веществами С водой 2Ме+ H2O → 2Ме OH + H2 ↑(указать окислитель, восстановитель); C кислотами - сильными окислителями 8 Na + 10 HNO3( конц) → 8 NaNO3 + N2O↑ + 5 H2O 8 Na + 5 H2SO4( конц) → 4 Na2SO4 + H2S↑ + 4 H2O (указать окислитель, восстановитель) | Применение Соли Na, K( KСl, KNO3, NaNO3) широко используются в качестве удобрений Расплавы К и Na - в качестве теплоносителя в атомных реакторах и в авиационных двигателях. Пероксиды К и Na - используются в подводных лодках и космических кораблях для регенерации воздуха 2Na2O2+2CO2 →2Na2 CO3 + O2↑;Na2O2 +2KO2+ 2CO2 →Na2CO3 +K2CO3 + 2O2↑ Na служит катализвтором в производстве каучука Получение Электролиз расплавов солей или щелочей 2Ме Cl →эл. ток→ 2 Me + Cl2↑; 4МеOH →эл. ток→ 4 Me + O2↑ + 2 H2O Калий получают, вытесняя его избытком натрия из расплавов хлорида или гидроксида KСl + Na → NaCl + K, KOH + Na → NaOH + K |

















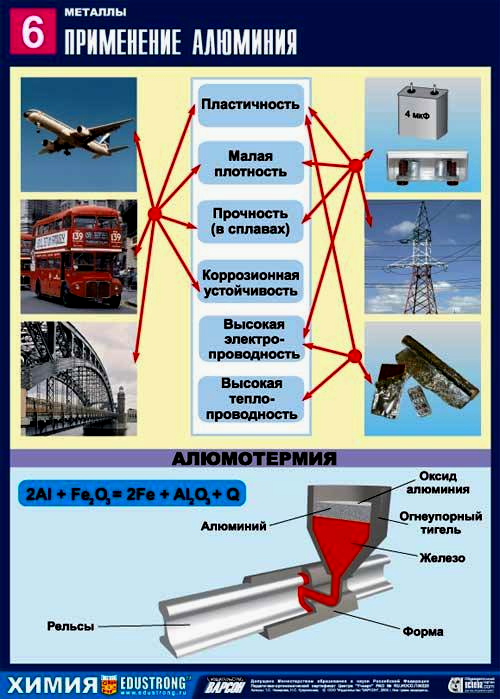
 люминия
люминия