Հալոգենների ընդհանուր բնութագիրը:
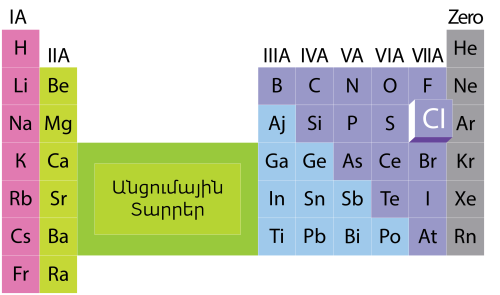
Քիմիական տարրերի պարբերական համակարգի VIIA խմբի տարրերը (ֆտոր` F, քլոր` CI, բրոմ` Br, յոդ` I) անվանվում են հալոգեններ: Հալոգենների խմբին է պատկանում նաև ռադիոակտիվ աստատ` At տարրը, որի քանակը երկրակեղևում անչափ փոքր է: Նրա հատկությունների վերաբերյալ մեզ շատ քիչ բան է հայտնի, և այն չենք դիտարկելու:
Հալոգենների ատոմներն արտաքին էլեկտրոնային շերտում պարունակում են 7-ական էլեկտրոն՝
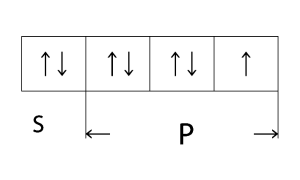
արտաքին շերտի էլեկտրոնային բանաձևն է ns2np5
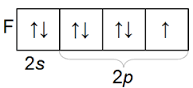
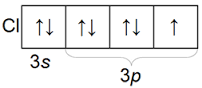
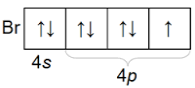
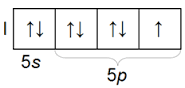
Հալոգենների արտաքին էլեկտրոնային շերտի կառուցվածքը
Հալոգենների ատոմներին միայն մեկ էլեկտրոն է պակասում` համապատասխան պարբերությունը եզրափակող իներտ գազի ատոմի ns2np6 էլեկտրոնային կառուցվածքը ստանալու համար: Քիմիական միացություն առաջացնելիս հալոգենների ատոմներն ընդունակ են հեշտությամբ միացնելու մեկ էլեկտրոն, և այդ պատճառով հալոգենների ատոմների առավել բնութագրական օքսիդացման աստիճանը –1 է: Մասնավորապես մետաղի հետ փոխազդելիս հալոգենի ատոմը նրանից մեկ էլեկտրոն է վերցնում և փոխարկվում 1– լիցքով իոնի: Հալոգենի և մետաղի ատոմների միջև ծագում է իոնային կապ, և առաջանում է աղ: Այստեղից էլ ծագել է ենթախմբի «հալոգեններ» ընդհանուր անվանումը` «աղածիններ» (hունարեն թարգմանությամբ halos` աղ, genos` ծնող):
Հալոգենների քիմիական ակտիվությունը բավականին մեծ է, որի պատճառով բնության մեջ ազատ վիճակում չեն հանդիպում:
Քլոր պարունակող հանքանյութերն են հալիտը (քարաղ)՝ NaCI, սիլվինը` KCI, սիլվինիտը` NaCI⋅KCI, կառնալիտը՝ NaCl⋅MgCl2⋅6H2O


Հալիտ Սիլվին


Սիլվինիտ Կառնալիտ
Ֆտոր պարունակող հանքանյութերն են ֆտորապատիտները` Ca3(PO4)⋅CaF22 և պլավիկյան սպաթը` CaF2


Ֆտորապատիտ Պլավիկյան սպաթ
Բրոմը և յոդը սեփական հանքանյութեր չեն առաջացնում: Քլորի հանքանյութերը պարունակում են քիչ քանակներով բրոմ և յոդ: Այդ տարրերի աղբյուրներ են որոշ «դառը» լճեր, օրինակ` Ղրիմի աղային լիճը և Կասպից ծովի Կարա Բողազ Գյոլ ծոցը:
Յոդի միացություններ առկա են նաև նավթահորային ջրերում և ծովային ջրիմուռներում:






























