Химия
План занятия 33
Тема: Ядерная модель строения атома. Периодический закон и периодическая система
Обучающая цель: закрепить представление об атоме как мельчайшей частице вещества; познакомить учащихся с основными историческими этапами развития представлений о строении атома; изучить основные качественные и количественные характеристики атома, сформировать умение характеризовать электронное строение атома по его положению в периодической системе химических элементов
Воспитательная цель: продолжить формирование коммуникативных умений и навыков
Развивающая цель: продолжить развитие умений учащихся сравнивать и обобщать изучаемые объекты и явления, развивать химическую речь учащихся
Методическая цель: активизация познавательной деятельности учащихся на занятиях через использование интерактивной доски
Междисциплинарные связи: физика, астрономия, математика
Тип урока: комбинированный урок
Оснащение урока: периодическая система химических элементов Д.И. Менделеева, учебный ОМС-модуль по теме занятия, проектор, интерактивная доска, сборники задач
ХОД УРОКА
ОРГАНИЗАЦИОННЫЙ МОМЕНТ (1-3 мин) – проверка присутствующих, вопросы о готовности группы к уроку, постановка целей урока
АКТУАЛИЗАЦИЯ И ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ
Тема нашего занятия сегодня звучит так «Строение атома. Периодический закон и периодическая система химических элементов». Мы с вами вспомним все, что вы знаете об атомах, но прежде вспомним основные понятия изаконы химии(устные ответы учащихся по теме «Основные понятия и законы химии»)
ИЗЛОЖЕНИЕ НОВОГО МАТЕРИАЛА
План:
Строение атома
Переходим к изучению нашей темы. Начнем с истории открытия строения атома. Изучим учебный модуль слайд 1.
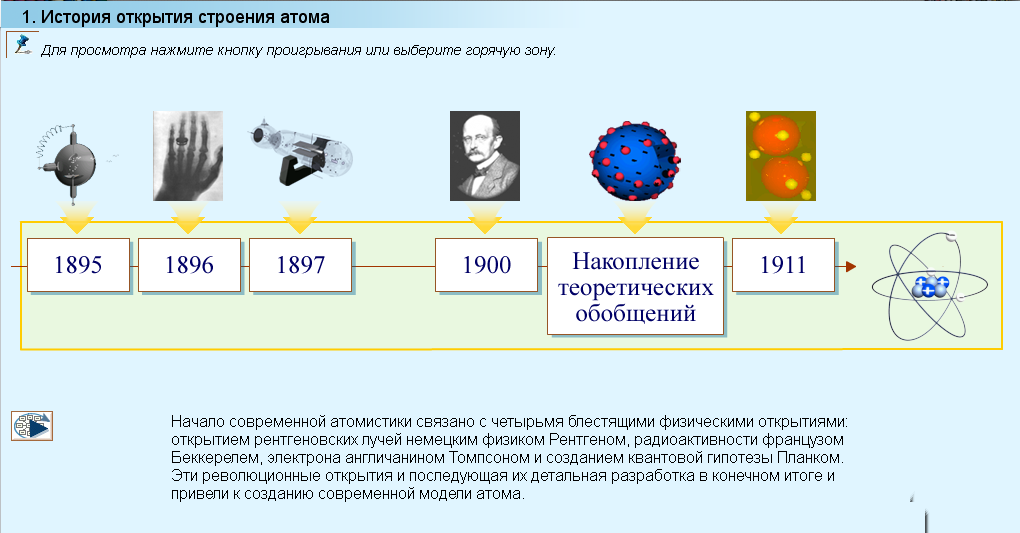
Какая частица вещества называется атомом?
В курсе физики вы уже изучали этот вопрос. Вспомните, пожалуйста, из каких элементарных частиц состоит атом?
На интерактивной доске представлена таблица, которую я предлагаю вам заполнить. Для проверки правильности выполнения задания прослушайте, пожалуйста, следующую информацию (учебный модуль, слайд 2).
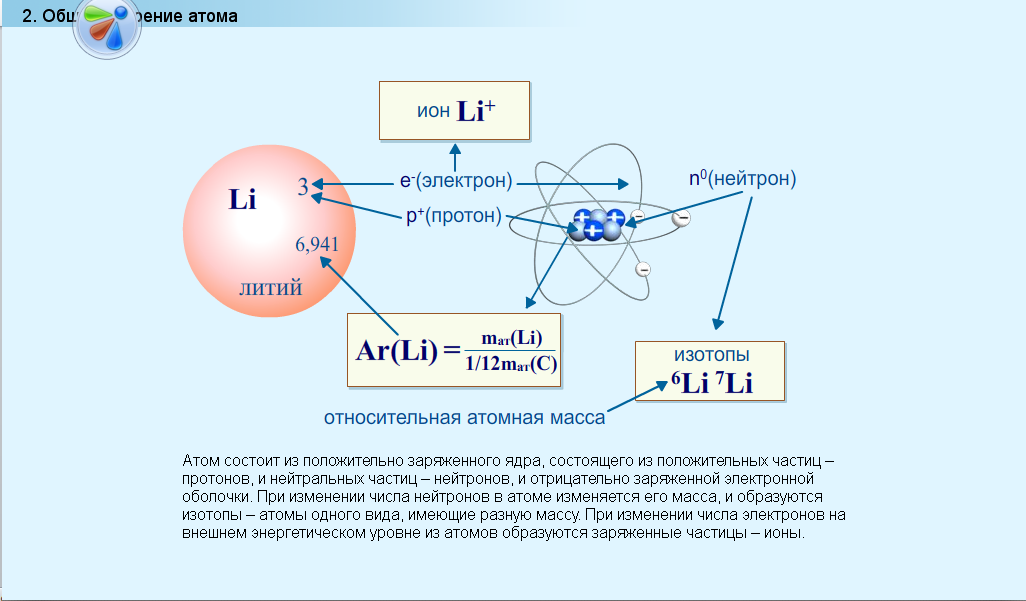
Обратите внимание на новое понятие «изотоп». Например, 15О, 16О, 17О – это изотопы кислорода. Чем они отличаются?
Электронное строение атома
Помните ли вы, как определяется число элементарных частиц в атоме?
№ элемента = Zядра = число протонов в атоме = число электронов в атоме.
Т.к. масса атома сосредоточена в ядре, то она зависит от количества протонов и нейтронов. Это можно представить формулой А=Z+N, где А-атомная масса, Z-число протонов, N-число нейтронов.
Электронные конфигурации атомов
А сейчас подробнее об электронах в атоме. Как распределены электроны вокруг ядра? Знаете ли вы, какое количество электронов находится на каждом электронном слое?

Периодический закон и периодическая система элементов
Вы уже несколько раз сегодня ссылались на периодическую систему, она является графическим изображением периодического закона. Но самое интересное то, что закон был сформулирован Д.И. Менделеевым до создания теории строения атома. Д.И. взял за основу классификации элементов их атомную массу. В настоящее время за основу классификации элементов взят заряд атомного ядра.

Многие вопросы о строении атома находят свои ответы в периодической системе.
Число протонов и число электронов
Число нейтронов
Число электронных слоев в атоме
Число электронов на последнем слое
ЗАКРЕПЛЕНИЕ
Фронтальный опрос
Дайте определение понятию «атом».
Какие элементарные частицы образуют атом?
Назовите принцип объединения элементов в группы.
Назовите принцип объединения элементов в периоды.
В чем заключается физический смысл номера периода?
В чем заключается физический смысл номера группы?
Выполнение заданий по сборнику задач по химии 10 класс (В.Н. Хвалюк, 2003) 104, 105, 116, 117, 118, 113, 115, 106, 123, 126.
ПОДВЕДЕНИЕ ИТОГОВ РАБОТЫ
Комментирование и выставление отметок
ВЫДАЧА ДОМАШНЕГО ЗАДАНИЯ
[3] §10-13, стр.62 в. 1-4
[4] § 10-13, стр. 65 в. 1-4





















