Интеллектуальная игра по химии «Химический калейдоскоп»
Для учащихся 10 класса
Цель игры:
выявление знаний, умений и навыков обучающихся с высоким уровнем интеллектуального развития, полученных ими в процессе обучения;
повышение мотивации учеников к процессу обучения;
развитие коллективного способа деятельности;
углубление знаний учащихся по химии;
повышение интереса к изучаемому предмету;
Участники:
Команды по 2 человека – учащиеся 10 класса.
1тур. История развития органической химии
Кто впервые получил органическое вещество из неорганического, тем самым опровергнув доводы «виталистов» о том, что органические вещества могут образовываться только в живых организмах, за счет «жизненной силы»
Ф. Велер
А.М. Бутлеров
А.В. Кольбе
М. Бертло
2. Шведский химик, президент Королевской шведской Академии Наук, впервые ввёл современные обозначения химических элементов и первые формулы химических соединений. Он определил органическую химию как химию растительных и животных веществ, ввёл понятия "органические вещества" и "органическая химия".
Ф. Вёлер
Ф.А. Кекуле
Й.Я. Берцелиус
Э. Франкленд
3. По словам очевидцев того времени этот учёный был "творцом в химии и подмастерьем в музыке". Русский химик, ученик Н. Н. Зинина, врач-токсиколог, изобрёл один из способов получения бромзамещённых жирных кислот, впервые получил фтористый бензоил и многое другое. Одновременно этот человек был музыкантом, автором исполняемых перед европейской публикой симфонических произведений (автор опер "Богатыри", "Млада" , "Князь Игорь").
А. М. Бутлеров
И. М. Сеченов
Д. И. Менделеев
А. П. Бородин.
4. Немецкий химик-органик, создатель "теории валентности , указал на способность атомов углерода при насыщении своих "единиц сродства" образовывать цепи. Он ввёл в употребление понятие "ароматические соединения" (предложил циклическую структурную формулу бензола), был несколько лет президентом Немецкого химического общества, автор "Учебника органической химии" , иностранный член-корреспондент Петербургской Академии Наук.
Ю. Либих
А. Кекуле
Ж. Мореско
А. Байер.
5. Русский химик-органик , академик , один из основоположников органического гетерогенного катализа и нефтехимии , создатель научной школы учёных , организатор и член Всесоюзного химического общества имени Д. И. Менделеева. Он разработал метод получения бензина из солярового масла и мазута , предложил способ получения толуола из бензола и метана , синтезировал свыше 25 различных циклоалканов и изучил на индивидуальных соединениях их свойства , синтезировал ряд аминокислот и оксиаминокислот , изучал процессы гидролиза белковых тел , создал угольный противогаз
С. В. Лебедев
В. В. Марковников
Н. Д. Зелинский
Н. Н. Семёнов.
6. Русский химик-органик, воспитавший целую плеяду замечательных русских химиков, среди которых были Д. И. Менделеев, Н. Н. Бекетов и другие известные учёные. Его заслуга в деле подготовки химических кадров России огромна , недаром за ним закрепилось почётное имя – "дедушка русских химиков". Он сформулировал правила о направлении реакций замещения, отщепления, присоединения по месту разрыва двойной связи и изомеризации в зависимости от химического строения. Исследовал состав нефти , заложил основы нефтехимии как самостоятельной науки. Открыл новый класс органических веществ – циклопарафины. О каком учёном идёт речь?
В.В. Марковников
Н.Н.Бекетов
С.В. Лебедев
Ф.Ф. Бельштейн.
7. Этот ученый в 1858 году ввел понятие валентного штриха. С тех пор и по настоящее время химики используют язык так называемых структурных формул молекул органических соединений, в которых связи между отдельными атомами обозначаются с помощью одного (простая, или одинарная, связь), двух (двойная) или трех (тройная) валентных штрихов.
А.Купер
Ю. Либих
А. Кекуле
Ж. Мореско
8. Идея неразрывной связи химической и физической свойств молекулы с ее строением, идея единственности этого строения впервые была высказана этим ученым в 1861 году
А. М. Бутлеровым
И. М. Сеченовым
Д. И. Менделеевым
А. П. Бородиным.
9. Русский химик, академик, получил в1928 году синтетический каучук, а в 1932 году разработал метод получения бутадиена из этилового спирта
В.В. Марковников
Н.Н.Бекетов
С.В. Лебедев
И. М. Сеченов
10. Кому принадлежит фраза о неразумности использования нефти только в качестве топлива: «Топить можно и ассигнациями»?
А. М. Бутлерову
И. М. Сеченову
Д. И. Менделееву
А. П. Бородину.
2тур. Гомологи и изомеры
Выберите пары гомологов и изомеров
СН3-СН2-СН3 | СН2=СН-СН3 |
СН3-С(СН3)2-СН3 | СН3-СН(СН3)-СН3 |
СН2=СН- СН2-СН3 | СН2=СН2 |
СН3- СН2-С(СН3)2-СН3 | СН≡С-СН2-СН3 |
СН3-СН(СН3)-СН2-СН3 | СН2=СН-СН=СН2 |
СН3-СН2- СН2- СН2- СН2-СН3 | СН3-СН=СН- СН3 |
3 тур. Номенклатура
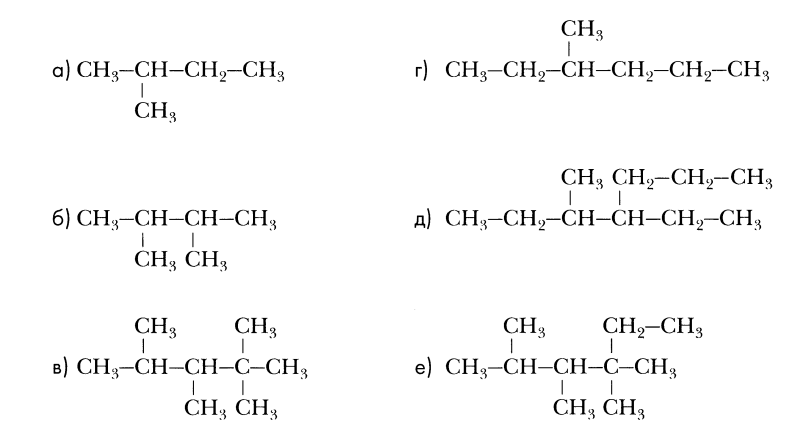
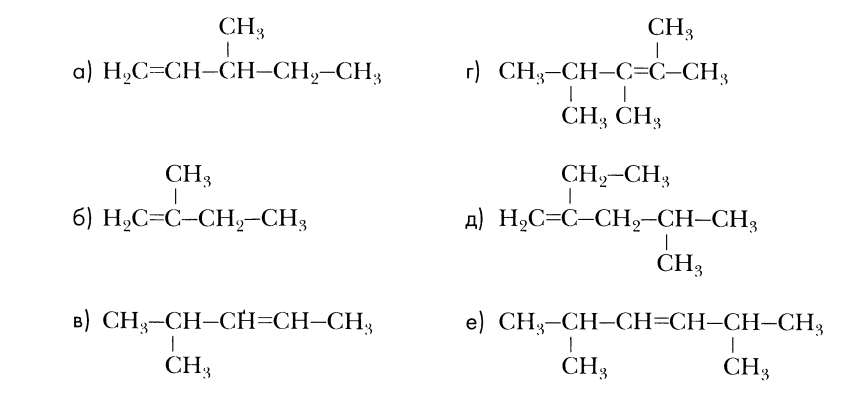
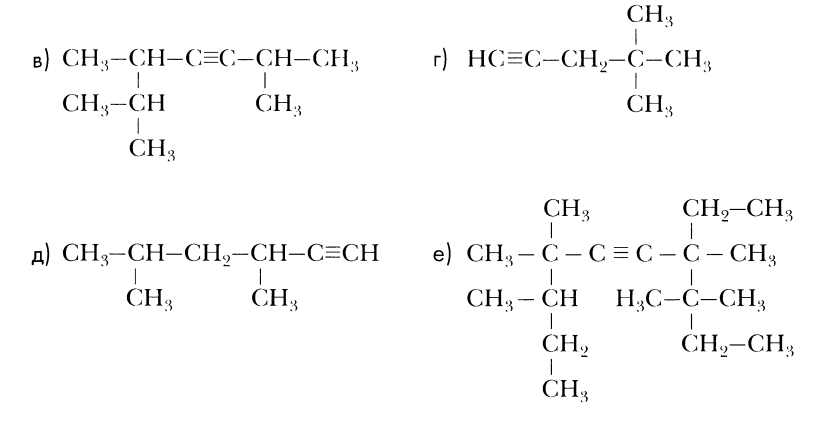
Назовите углеводороды:
4тур. Свойства, получение и применение углеводородов
1.Метан в лаборатории получают:
а) из природного газа б) гидротацией этилена
б) из ацетата натрия в) реакцией Вюрца
2. Пентан при нормальных условиях
а) жидкость б) газ в) твердое вещество
3.Для диеновых углеводородов не характерна реакция:
а) горения б) замещения с галогенами в) гидрирования г) гидрогалогенирования
4. При гидрировании СН2=СН-СН3 можно получить:
а) пропин б) этан в) пропан г) 2- хлорпропан
5. Бензол не применяется:
а) в качестве топлива
б) для производства фенола
в) как растворитель
г) для производства ядохимикатов
6. Алкены не взаимодействуют
а) с водородом
б) с галогенами
в) с галогеноводородами
г) с азотной кислотой
7.В результате присоединения 1 молекулы бромоводорода к пропину получается:
а) 2-бромбутен-1
б) 1-бромпропен
в) 2-бромпропен
г) 2,2-дибромпропан.
8. Разложение углеводородов при температуре более 10000С называется
а) крекинг б) пиролиз в) гидрирование г) дегидрирование
9.Для метана характерны:
а) реакция гидрирования
б) наличие π-связи в молекуле
в) sp3 гибридизация электронных облаков
г) реакция с галогеноводородами
д) реакция горения
ж) реакция дегидрирования
10.Для ацетилена характерны
а) sp 2 гибридизация электронных облаков
б) реакция гидрирования
в) наличие только σ-связей в молекуле
г) горение на воздухе
д) реакция нитрования
ж) реакция галогенирования
5тур. Простые задачи
Заполните таблицу
| вещество | формула | Молярная масса | Количество вещества | Масса | Число частиц | Объем |
| метан |
|
| 2 моль |
|
|
|
| ацетилен |
|
|
| 13г |
|
|
| пропен |
|
|
|
|
| 56 л. |
6 тур. Лабораторное оборудование
Назовите лабораторное оборудование
|  пробирка пробирка
|  химический стакан химический стакан
|
|  мерный цилиндр мерный цилиндр
|  коническая колба коническая колба
|
|  ступка с пестиком ступка с пестиком
|  коническая воронка коническая воронка
|
|  тигельные щипцы тигельные щипцы
|  делительная воронка делительная воронка
|
|  пипетка пипетка
|   спиртовка спиртовка
|
|  лабораторный штатив с кольцом лабораторный штатив с кольцом
|
 лапка для штатива лапка для штатива
|
7 тур. Сложные задачи
1.Выведите формулу углеводорода, содержащего 81,8 % углерода. Плотность паров этого вещества 1,97 г/л.
2.При сгорании углеводорода массой 3,9 г. образовалось13,2 г. углекислого газа и 2,7 г. воды. Относительная плотность этого вещества по водороду равна 39. Выведите молекулярную формулу углеводорода.
8 тур. Техника безопасности
Составьте инструкцию по технике безопасности по картинкам
| 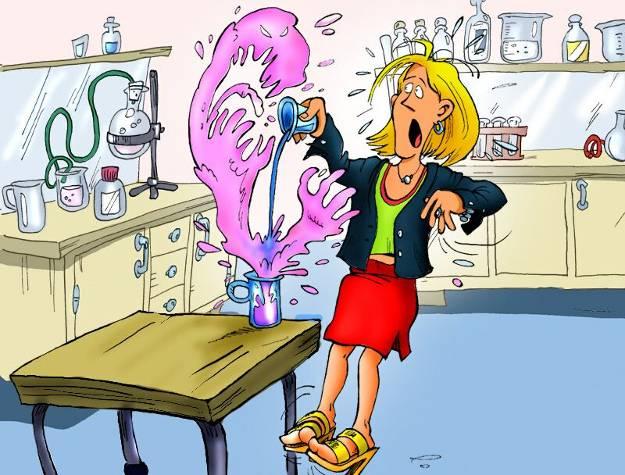
| При разбавлении или укреплении растворов кислот льют кислоту большей концентрации в сосуд с кислотой меньшей концентрации; при изготовлении смеси кислот необходимо вливать жидкость большей плотности в жидкость с меньшей плотностью.
|
| 
| Нюхать вещества можно, лишь осторожно направляя на себя их пары или газы лёгким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
|
| 
| При нагревании реактивов в отверстие пробирки должно быть направлено в сторону от себя и от других людей |
| 
| Перед выполнением работы внимательно прочитай инструкцию |
| | Запрещается хранить продукты рядом с реактивами |
| | Учащимся запрещается выливать в канализацию растворы и органические жидкости.
|
| | При использовании пипетки необходимо использовать грушу для всасывания жидкости, ни в коем случае не пользоваться ртом. |
| | Не наклоняйся над кипящей жидкостью |
| | Используемая лабораторная посуда должна быть чистой |
Ответы
1тур. История развития органической химии
(1 балл за каждый правильный ответ)
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| ответ | 1 | 3 | 4 | 2 | 3 | 1 | 1 | 1 | 3 | 3 |
2тур. Гомологи и изомеры
(1 балл за каждый правильный ответ)
Гомологи: 1-11, 2-5, 3-7, 4-9, 5-6
Изомеры: 3-9, 5-12, 7-11, 8-10
3 тур. Номенклатура
(1 балл за каждый правильный ответ)
2,2,3,4-тетраметилпентан
2,3,44-тетраметилгексан
2,3,4-триметилпентен-2
2-этил4-метилпентен-1
2,5-диметилгексен-3
4,4-диметилпентин-1
2-метилбутадиен-1,3
3,3,4,7,7,8-гексаметил4-этилдекин-5
4тур. Свойства, получение и применение углеводородов
(1 балл за каждый правильный ответ)
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| ответ | б | а | б | в | а | г | в | б | в,д,ж | б,г,ж |
5тур. Простые задачи
Заполните таблицу
| вещество | формула | Молярная масса | Количество вещества | Масса | Число частиц | Объем |
| метан | СН4 | 16 г/моль | 2 моль | 32 г | 12,04·1023 | 44,8 л |
| ацетилен | С2Н2 | 26 г/моль | 0,5 моль | 13 г | 3,01·1023 | 11,2 л |
| пропен | С3Н6 | 42 г/моль | 2,5 моль | 105 г | 15,05·1023 | 56 л |
6 тур. Лабораторное оборудование
(0,5 балла за каждый правильный ответ)
|  пробирка пробирка
|  химический стакан химический стакан
|
|  мерный цилиндр мерный цилиндр
|  коническая колба коническая колба
|
|  ступка с пестиком ступка с пестиком
|  коническая воронка коническая воронка
|
|  тигельные щипцы тигельные щипцы
|  делительная воронка делительная воронка
|
|  пипетка пипетка
|   спиртовка спиртовка
|
|  лабораторный штатив с кольцом лабораторный штатив с кольцом
|
 лапка для штатива лапка для штатива
|
7 тур. Сложные задачи
(5 баллов) С3Н8
8 тур. Техника безопасности
(1балл за каждый правильный ответ)






 пробирка
пробирка













