Просмотр содержимого документа
«Карта-инструкция №2 ПР Получение аммиака и изучение его свойств 9кл»
Карта-инструкция №2
Практическая работа № 2
Тема: Получение аммиака и изучение его свойств.
Цель: Получить аммиак и доказать его свойства опытным путем.
Оборудование: Лист бумаги или фарфоровая чашка, ложечка для сжигания веществ, стеклянная палочка, пробирки, пробка с Г-образной изогнутой газоотводной трубкой, лабораторный штатив с лапкой, спиртовка, спички, вата, кристаллизатор, пробирочный зажим, штатив для пробирок, пипетка, шпатель.
Реактивы: Хлорид аммония, гидроксид кальция, соляная кислота (конц.), вода, водный раствор аммиака, раствор фенолфталеина, раствор соляной кислоты, индикаторная бумажка, хлорид алюминия.
Ход работы:
Получение аммиака
Соберите прибор как показано на рисунке 1.
На лист бумаги или в небольшую фарфоровую чашку (можно ступку) н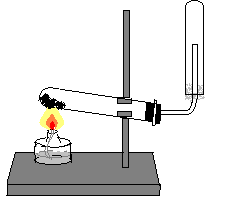 асыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ). Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой с
асыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ). Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой с
Рис. 1. Получение аммиака газоотводной трубкой и укрепите в лапке
штатива.
На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Нагрейте пробирку со смесью хлорида аммония и гидроксида кальция, соблюдая правила нагревания. Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку. Обнаружив аммиак, поднесите к отверстию пробирки стеклянную палочку, смоченную концентрированной соляной кислотой. Что вы наблюдаете?
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, осторожно снимите с газоотводной трубки, держа ее вверх дном (конец газоотводной трубки сразу же после снятия с нее пробирки с аммиаком закройте кусочком мокрой ваты).
Отверстие снятой пробирки закройте большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Снова закройте пальцем отверстие пробирки под водой и выньте ее из сосуда.
Изучение свойств водного раствора аммиака
1. В пробирку налейте 2 – 3 мл водного раствора аммиака и добавьте 2 – 3 капли раствора фенолфталеина. Каков цвет раствора? Нагрейте этот раствор до кипения. Что вы наблюдаете?
2. Налейте в пробирку 2 – 3 мл водного раствора аммиака. Добавьте 2 – 3 капли раствора фенолфталеина и приливайте по каплям раствор соляной кислоты. Что вы наблюдаете?
3. В пробирку налейте 2 – 3 мл водного раствора хлорида алюминия и добавьте еще столько же водного раствора аммиака. Что вы наблюдаете?
Отчет:
Заполните пустые колонки в таблице, приведенной ниже, и сделайте общий вывод, ответив на вопрос: какие свойства аммиака и его водного раствора вы подтвердили в ходе работы?
| Содержание опыта (ход работы) | Уравнение реакций | Наблюдения, рисунок | Выводы |
| 1. Получение аммиака |
| а) Нагреем смесь хлорида аммония и гидроксида кальция.
|
|
|
|
|
| NH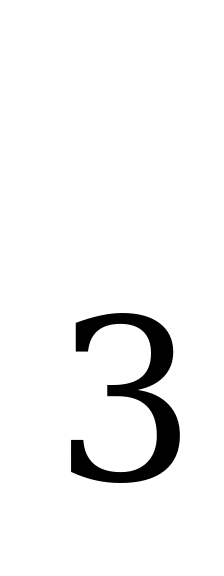 +H +H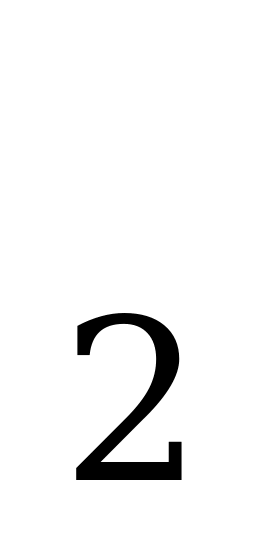 O= NH O= NH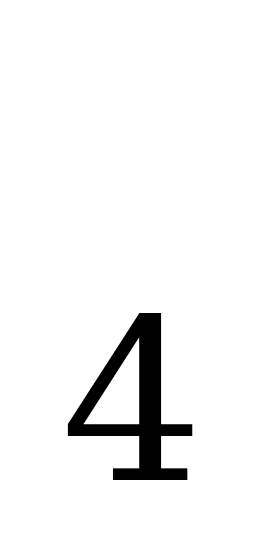 OH OH гидроксид аммония NH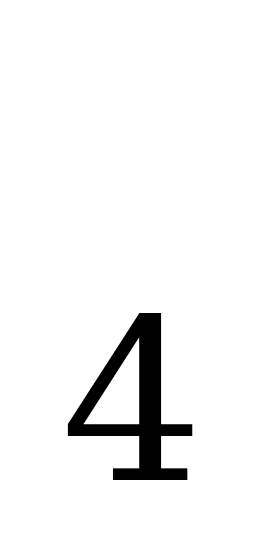 OH OH NH NH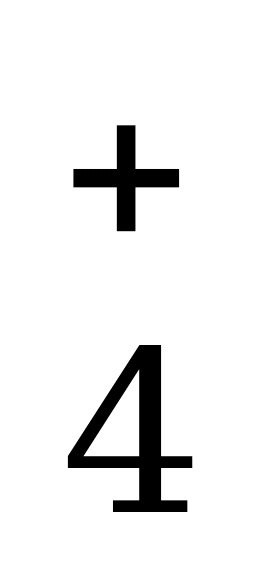 +OH +OH
|
|
|
|
|
| Наблюдается образование белого дыма – хлорида аммония.
|
|
|
|
|
| Аммиак растворяется в воде с образованием гидроксида аммония. |
| 2. Изучение свойств водного раствора аммиака |
| а)Добавим в пробирку с водным раствором аммиака фенолфталеин.
|
|
|
|
|
| NH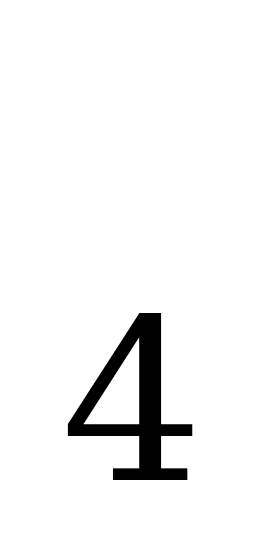 OH OH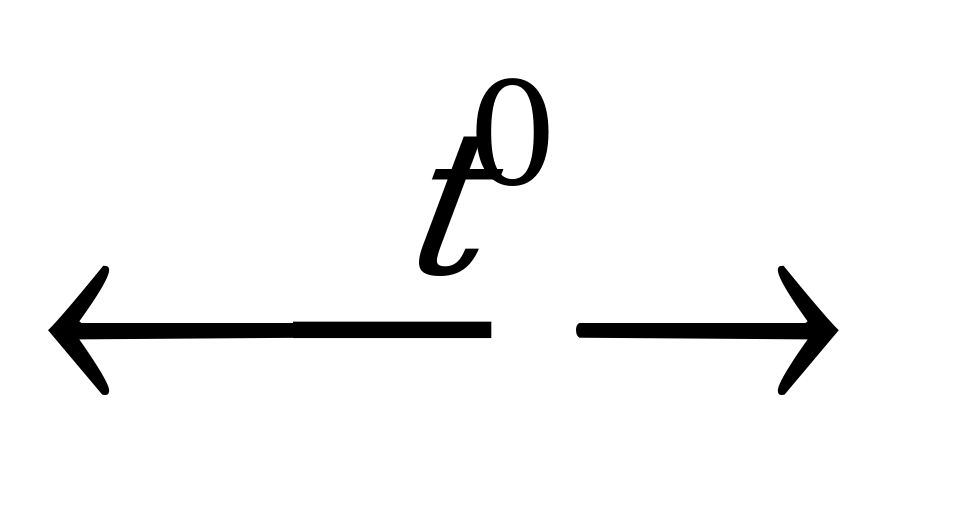 NH NH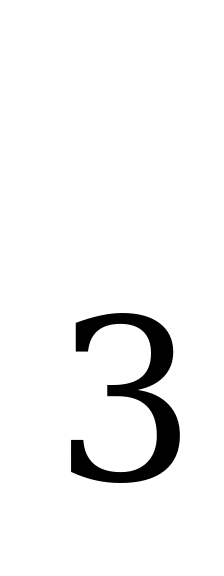 ↑+H ↑+H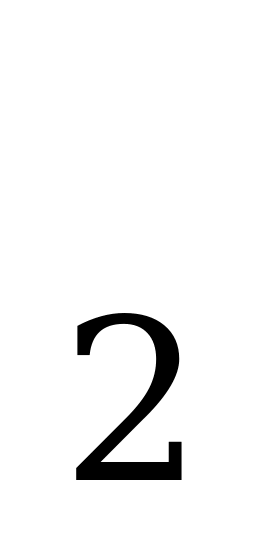 O O |
|
|
|
|
| Окраска индикатора постепенно исчезает. |
|
|
|
|
| В результате взаимодействия водного раствора аммиака с хлоридом алюминия образуется хлорид аммония и гидроксид алюминия. |







 асыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ). Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой с
асыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ). Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой с 









