Выступление на районном МО учителей-химиков
учителя МБОУ ООШ №38 им. И.Х.Баграмяна с. Гойтх Биджосян Л.А.
по теме: «Кейс-технология как условие продуктивного обучения на уроках химии в условиях реализации ФГОС ООО»
2021г.
Кейс-метод (технология)
Название метод получил от английского слова "case" - случай, ситуация и от понятия "кейс" - чемоданчик для хранения бумаг, документов, синтез проблемного обучения, ИКТ, метода проектов, метод проблемных ситуаций.
Кейс – совокупность учебных материалов, в которых сформулированы практические проблемы, предполагающие коллективный или индивидуальный поиск их решения, это описание проблемной ситуации на основе реальных фактов, случаев, которые можно перевести в статус задачи, и затем решать с последующей рефлексией хода и ресурсов решения.
Цели при использовании кейс-технологии:
1) развитие аналитического, творческого мышления;
2) формирование практики поиска и выработки альтернативных решений;
3) формирование способности и готовности к оценке и принятию решения;
4) развитие социальных компетенций: оценка поведения людей, умение слушать, поддерживать дискуссии или аргументировать противоположное мнение, контролировать себя.
Кейсы бывают
1)практическими (для закрепления ЗУН),
2)обучающими (для решения учебных и воспитательных задач),
3)научно-исследовательскими (для осуществления исследовательской деятельности и формирования исследовательской компетентности).
Структура кейса в школьной практике может быть описана тремя основными ситуациями:
1)создание кейс - проблемной ситуации на основе фактов из реальной жизни;
2)к ситуации должны быть заданы вопросы, т.е. правильно поставленная учебная задача;
3)информационный материал - это может быть материал учебника, статьи, сайты, видео.
Решение кейса: индивидуальное, групповое, в парах
Формирование УУД в кейс – методе
Личностные:
1) готовность и способность обучающихся к саморазвитию, познавательной деятельности
2) способность ставить цели и строить жизненные планы
3) формирование ответственного отношения к учению
Метапредметные:
1) самостоятельность планирования и осуществления учебной деятельности
2) организация учебного сотрудничества с педагогами и одноклассниками
3) умение самостоятельно планировать пути достижения целей, в том числе альтернативные
4) владение основами самоконтроля, самооценки при принятии
Предметные:
1) формирование представлений о химии как о методе познания действительности, позволяющим описывать и изучать реальные процессы и явления
2)развитие умений работать с учебным химических текстом, точно и грамотно выражать свои мысли с применением химической терминологии и символики, проводить классификации, логические обоснования, доказательства химических экспериментов
3)овладение простейшими способами представления и анализа результатов эксперимента, формирование понятий, аналитический эффект , качественный анализ и использование их в дальнейшем в реальном мире
4)развитие умений применять изученные химические понятия, результаты , методы для решения задач практического характера и задач межпредметных дисциплин.
Кейс: «Физические и химические свойства вещества» 8 класс
Тип кейса: обучающий
Задание:
Содержание кейса
В одном из пособий для трудовой школы по химии (1927 год) было дано задание: "Проследите со всею внимательностью все явления, которые происходят в то время, когда "ставится" самовар. Запишите, какие из этих явлений вы отнесете к физическим и какие - к химическим, начиная от наливания в самовар воды и закладки углей, не забыв зажигания спички и явлений, происходящих при этом, и кончая заваркой чая, наливанием его в стакан и растворением сахара. Обратите внимание, во что превратится уголь, не получилось ли радужных полос на медной крышке самовара около кувшина (внутренней трубы самовара)". Дайте ответ и вы.
Разберите данную ситуацию, проведите ее анализ.
Какие явления называются физическими?
Какие явлениями называются химическими?
Составьте список последовательных действий при чаепитии.
Какие из перечисленных вами действий при чаепитии относятся к физическим, а какие – к химическим явлениям?
Информационный материал
Всё, что нас окружает: и живая, и неживая природа, находится в постоянном движении и непрерывно изменяется: движутся планеты и звёзды, идут дожди, растут деревья. И человек, как известно из биологии, постоянно проходит какие-либо стадии развития. Перемалывание зёрен в муку, падение камня, кипение воды, молния, свечение лампочки, растворение сахара в чае, движение транспортных средств, молнии, радуги – это примеры физических явлений.
И с веществами (железо, вода, воздух, соль и др.) происходят разнообразные изменения, или явления. Вещество может быть кристаллизировано, расплавлено, измельчено, растворено и вновь выделено из раствора. При этом его состав останется тем же.
Так, сахарный песок можно измельчить в порошок настолько мелкий, что от малейшего дуновения он будет подниматься в воздух, как пыль. Сахарные пылинки можно разглядеть лишь под микроскопом. Сахар можно разделить ещё на более мелкие части, растворив его в воде. Если же выпарить из раствора сахара воду, молекулы сахара снова соединяться друг с другом в кристаллы. Но и при растворении в воде, и при измельчении сахар остаётся сахаром.
В природе вода образует реки и моря, облака и ледники. При испарении вода переходит в пар. Водяной пар – это вода в газообразном состоянии. При воздействии низких температур (ниже 0˚С) вода переходит в твёрдое состояние – превращается в лёд. Мельчайшая частичка воды – это молекула воды. Молекула воды является и мельчайшей частичкой пара или льда. Вода, лёд и пар не разные вещества, а одно и то же вещество (вода) в разных агрегатных состояниях.
Подобно воде, и другие вещества можно переводить из одного агрегатного состояния в другое.
Характеризуя то или другое вещество как газ, жидкость или твёрдое вещество, имеют в виду состояние вещества в обычных условиях. Любой металл можно не только расплавить (перевести в жидкое состояние), но и превратить в газ. Но для этого необходимы очень высокие температуры. Во внешней оболочке Солнца металлы находятся в газообразном состоянии, потому что температура там составляет 6000˚С. А, например, углекислый газ путём охлаждения можно превратить в «сухой лёд».
Явления, при которых не происходит превращений одних веществ в другие, относят к физическим явлениям.
Физические явления могут привести к изменению, например, агрегатного состояния или температуры, но состав веществ останется тем же.
Со всеми предметами, которые нас окружают, происходят различные изменения.
Если нагреть медную пластину на воздухе, она потеряет свой блеск и покроется налётом черного цвета, который можно легко соскоблить. Повторяя этот процесс много раз, можно всю медь превратить в чёрный порошок, этот порошок называется оксид меди. Оксид меди – это новое вещество, которое обладает новыми свойствами. И при охлаждении чёрный порошок снова не станет медью.
Лента металла магния, если её поджечь, горит с ярким, ослепительным светом. Получается новое вещество – оксид магния.
Возьмём стеклянную трубку и будем продувать воздух через раствор извести – известковую воду. Жидкость станет мутной, потому что в ней образуется белый порошок, похожий на мел. Постепенно этот порошок осядет на дно сосуда. Этот осадок является новым веществом, которое образовалось из растворённой в воде извести и углекислого газа.
Если нагреть сахар в пробирке, мы увидим, как он плавится и постепенно приобретает коричнево-бурый цвет с выделением едкого запаха. На стенках пробирке появятся капельки воды, несмотря на то, что сахар был совершенно сухим. В конце опыта сахар превратится в вещество чёрного цвёта, безвкусное и нерастворимое в воде – это уголь.
При горении древесины происходит выделение воды и углекислого газа. Мы не можем этого видеть, но если провести ряд экспериментов это станет очевидным. Если поднести горящую спичку к перевёрнутому стакану, на стенках стакана изнутри осядут капельки воды.
Что же общего в описанных явлениях? Во всех случаях из одних веществ получаются другие вещества. Все рассмотренные нами явления – это примеры химических явлений.
Химическими явлениями называются такие явления, при которых из одних веществ образуются другие вещества. Химические явления называют химическими реакциями.
Кейс по теме «Разделение смесей веществ» 8 класс
Тип кейса: научно-исследовательский.
Содержание кейса:
В процессе жизнедеятельности современного человека образуется огромное количество бытовых отходов. Мусор на территории городского пляжа и парка г. Амурска содержит много ценных веществ: алюминий (крышки от молочных бутылок, фольга от чая, конфет), олова (консервные банки) и даже золото (негодные радиодетали, черепки тарелок с золотой каемкой). Однако переработкой мусора с целью выделения полезных материалов и веществ в городском хозяйстве почти не занимаются. Это связано с тем, что мусор – совершенно уникальная по количеству компонентов смесь. Выделение из нее веществ в чистом виде – дело очень трудоемкое и дорогое.
Пока не найдены эффективные и простые способы переработки мусора. Это дело будущего, однако, вы уже сейчас можете предложить методы разделения некоторых компонентов отходов.
Вам выдана смесь поваренной соли, песка, железного порошка, гранул полиэтилена, моделирующая мусор, а также смесь нефти и воды. Попытайтесь найти простые и эффективные методы разделения этой смеси. Сделайте выводы о способах разделения смеси и получения чистых веществ.
Дополнительное оборудование: стакан воды, магнит, предметное стекло, держатель, спиртовка, бумажный фильтр, воронка, стеклянная палочка, химический стаканчик, делительная воронка.
Кейс по теме «Соединения серы» 9 класс.
Тип кейса: обучающий
Предварительно учащимся дается информационный материал для знакомства с новой темой.
Сера и её соединения
| Сера | Соединения серы |
| оксиды серы | серная кислота |
| 1. При обычных условиях твёрдое жёлтое кристаллическое вещество. 2. Горит в кислороде:
S + O2 = SO2 (проявляет восстановительные свойства) 3. Взаимодействует с металлами и водородом:
Fe + S = FeS
H2 + S = H2S (проявляет окислительные свойства) В природе:
самородная сера S.
Сульфиды: FeS2 (пирит), CuS.
Сульфаты: CaSO4 * 2H2O (гипс), Na2SO4 | 1. При обычных условиях SO2 - газ, SO3 - твёрдое вещество. 2. Проявляют свойства кислотных оксидов, взаимодействуя с водой:
SO2 + H2O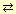 H2SO3 H2SO3
SO3 + H2O = H2SO4
щелочами:
SO2 + 2NaOH = Na2SO4 + H2O
SO3 + 2NaOH = Na2SO4 + H2O
основными оксидами:
SO3 + CaO = CaSO4 Получение:
1) оксида серы (IV) в промышленности:
горение серы:
S + O2 = SO2
обжиг пирита:
4FeS2 + 11O2 = 2Fe2O3
в лаборатории:
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O + H2O
2) оксида серы (VI) в промышленности: каталитическое окисление оксида серы (IV):
2SO2 + O2 = 2SO3
Содержание кейса
| 1. При обычных условиях бесцветная тяжёлая жидкость (p ~ 2 г/см3), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: H2SO4 = H+ + HSO4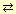 2H+ + SO42- 2H+ + SO42- 3. Взаимодействует с металлами: Zn + H2SO4 = ZnSO4 + H2
В концентрированной кислоте пассивируются Al и Fe. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O 5. Взаимодействует с основными и амфотерными оксидами:
H2SO4 + CuO = CuSO4 + H2O
H2SO4 + ZnO = ZnSO4 + H2O Получение в промышленности в соответствии со схемой: FeS2 (или S)  O2 SO2 O2 SO2  O2 SO3 O2 SO3  H2O H2SO4 H2O H2SO4
|

Это место без преувеличения можно назвать адским - здесь, в кратере вулкана Иджен на острове Ява, расположено большое горячее озеро, по берегам которого местные жители в нечеловеческих условиях добывают самый нужный для их деревень и поселков неметалл.
В чаше из базальтовых серых стен расположено яблочно-зеленое озеро, над поверхностью которого тянутся желтые шлейфы. Озеро находится на высоте 2 386 метров над уровнем моря. Глубина его невелика - 212 метров. По берегам вокруг черных отверстий, напоминающих раскрытые зевы чудовищ, отливают золотом валики этого вещества.Такие же отверстия существуют в дне озера, поэтому его температура на поверхности составляет 60 градусов, а в глубине - свыше 200 градусов по Цельсию. Но, самое удивительное, - в каждом литре этой смеси содержится ещё и 5 граммов растворенного алюминия. Ученые подсчитали, что всего в озере растворено свыше 200 тысяч тонн этого металла.
«Дуновение» газов с высоким содержанием различных соединений вещества не позволяет подолгу находиться в этом месте. Пары вызывают острые приступы кашля, если не одевать на лицо маску.
Тем не менее, в кратере вулкана оно вручную добывается для промышленных нужд. Носильщики набивают по 70 - 80 кг сырья в специальные корзины, неся их в одну ходку. Дневная зарплата работника - около 5 долларов. Средняя продолжительность жизни индонезийского добытчика составляет 30 лет.
Вопросы:
Проанализируйте текст и ответьте на следующие вопросы:
Что добывают местные жители?
Какие соединения образуются в «адском» озере? Как они образуются?
Запишите формулы этих соединений, их физические и химические свойства? (с кислородом, водой, металлами, гидроксидами, оксидами). Какие свойства проявляет сера в этих соединениях?
Можно ли лабораторным или промышленным способом получить эти соединения?
Какие еще знаете соединения серы, где могут в природе встретиться?
Как эти соединения влияют на организм человека и окружающую среду?
Как можно использовать эти соединения?
Результаты работы с кейсом
Учебные: 1. Освоение новой информации;
2. Освоение методов сбора данных;
3. Освоение методов анализа;
4. Умение работать с текстом;
5. Соотнесение теоретических и практических знаний.
Образовательные:
1. Создание авторского продукта;
2. Образование и достижение личных целей;
3. Повышение уровня профессиональной компетентности;
4. Появление опыта принятия решений, действий в новой ситуации, решения проблем.

















