
Основания
Помощник: Сайкум
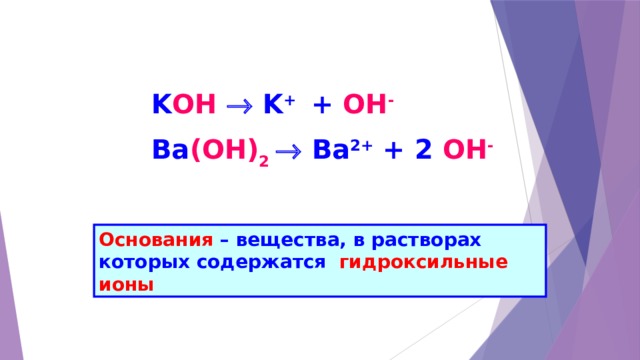
K OH K + + OH -
Ba (ОН) 2 Ba 2+ + 2 OH -
Основания – вещества, в растворах которых содержатся гидроксильные ионы
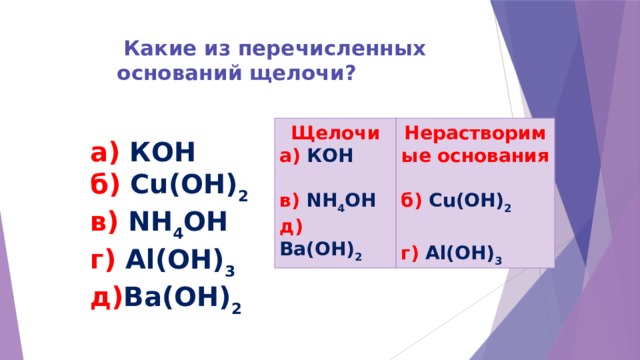
Какие из перечисленных оснований щелочи?
Нерастворимые основания
Щелочи
а) КОН
б) Cu(ОН) 2
в) NH 4 OH
д) Ba(ОН) 2
г) Al(ОН) 3
а) КОН
б) Cu(ОН) 2
в) NH 4 OH
г) Al(ОН) 3
д) Ba(ОН) 2

Сильные и слабые основания
Слабые основания
Сильные основания
щелочи
Все нерастворимые основания и NH 4 OH
LiOH гидроксид лития
NH 4 OH гидроксид аммония
NaOH гидроксид натрия
Mg(OH) 2 гидроксид магния
(едкий натр)
KOH гидроксид калия
Fe(OH) 2 гидроксид железа (II)
(едкое кали)
Zn(OH) 2 гидроксид цинка
Fe(OH) 3 гидроксид железа (III)
RbOH гидроксид рубидия
CsOH гидроксид цезия
Ca(OH) 2 гидроксид кальция Sr(OH) 2 гидроксид стронция Ba(OH) 2 гидроксид бария
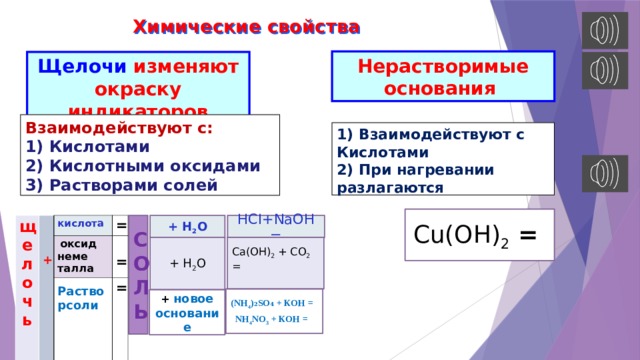
Химические свойства
Нерастворимые основания
Щелочи изменяют окраску индикаторов
Взаимодействуют с:
1) Кислотами
2) Кислотными оксидами
3) Растворами солей
1) Взаимодействуют с
Кислотами
2) При нагревании разлагаются
Cu(OН) 2 =
С
HСI+NaOH =
+ Н 2 О
О
Л
Ь
щелочь
кислота
=
оксид неме
+
талла
=
Растворсоли
=
+ Н 2 О
Ca(OH) 2 + CO 2 =
(NH 4 )₂SO₄ + КОН =
NH 4 NO 3 + КОН =
+ новое основание
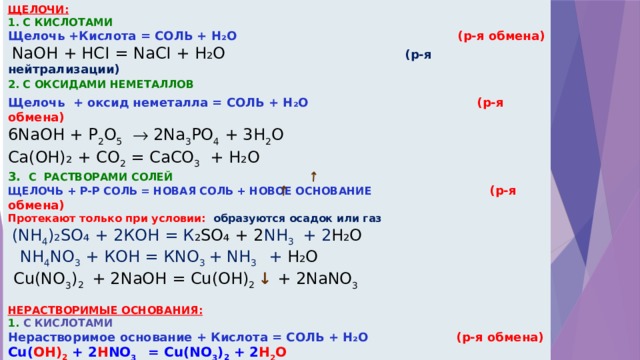
ЩЕЛОЧИ:
1. С КИСЛОТАМИ
Щелочь +Кислота = СОЛЬ + H₂O ( р-я обмена)
↓
NaOH + HСI = NaCI + H₂O (р-я нейтрализации)
↓
2. С ОКСИДАМИ НЕМЕТАЛЛОВ
Щелочь + оксид неметалла = СОЛЬ + Н₂О ( р-я обмена)
6NaOH + P 2 O 5 2Na 3 PO 4 + 3H 2 O
Ca(OН)₂ + CO 2 = CaCO 3 + H₂O
3. С РАСТВОРАМИ СОЛЕЙ
ЩЕЛОЧЬ + Р-Р СОЛЬ = НОВАЯ СОЛЬ + НОВОЕ ОСНОВАНИЕ ( р-я обмена)
Протекают только при условии: образуются осадок или газ
(NH 4 )₂SO₄ + 2КОН = К ₂SO₄ + 2 NH 3 + 2 H₂O
NH 4 NO 3 + КОН = КNO 3 + NH 3 + H₂O
Cu(NO 3 ) 2 + 2NaOH = Cu(OН) 2 ↓ + 2NaNO 3
НЕРАСТВОРИМЫЕ ОСНОВАНИЯ:
1. С КИСЛОТАМИ
Нерастворимое основание + Кислота = СОЛЬ + Н₂О ( р-я обмена)
Cu( OH) 2 + 2 H NO 3 = Cu(NO 3 ) 2 + 2 H 2 O
2. ПРИ НАГРЕВАНИИ РАЗЛАГАЮТСЯ ( р-я разложения)
Cu(OН) 2 = CuO + H₂O
2 Fe(OH) 3 = Fe 2 O 3 + 3 H 2 O
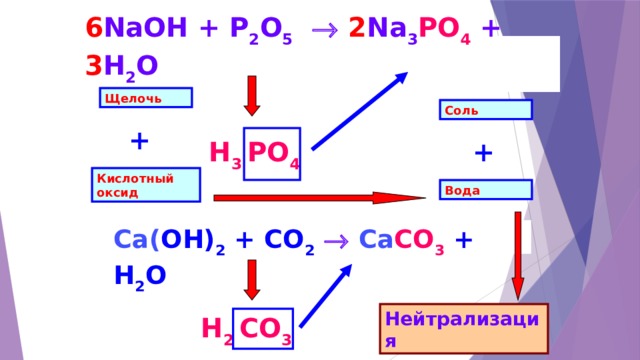
6 NaOH + P 2 O 5 2 Na 3 PO 4 + 3 H 2 O
Щелочь
Соль
+
+
Н 3 PO 4
Кислотный оксид
Вода
Ca( OH) 2 + CO 2 Ca CO 3 + H 2 O
Нейтрализация
Н 2 CO 3
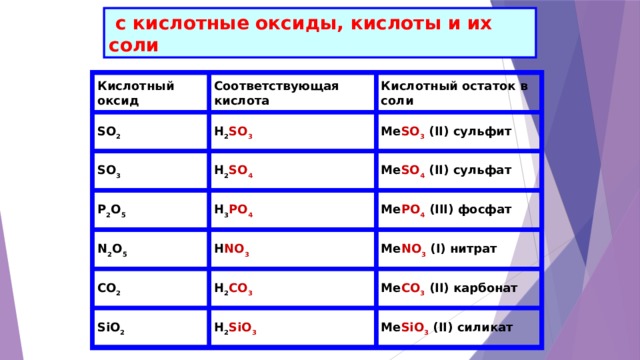
с кислотные оксиды, кислоты и их соли
Кислотный оксид
Соответствующая кислота
Кислотный остаток в соли
SO 2
H 2 SO 3
Me SO 3 (II) сульфит
SO 3
H 2 SO 4
Me SO 4 (II) сульфат
Me PO 4 (III) фосфат
H 3 PO 4
P 2 O 5
N 2 O 5
H NO 3
Me NO 3 (I) нитрат
Me CO 3 (II) карбонат
CO 2
H 2 CO 3
SiO 2
H 2 SiO 3
Me SiO 3 (II) силикат

Закрепление
- C какими из перечисленных веществ взаимодействует NaOH. Составьте уравнения возможных реакции.
1. SO 3 ;
2. LiOH;
3. Ва(NO)₃;
4. НСl;
5. FeCI 2 ;
6. LiNO₃;

Ответ
1. 2NaOH + SO 3 → Na 2 SO 4 + 2H₂O
2. NaOH + 2LiОН →
3. 2NaOH + Ba(NO₃)₂ →
4. NaOH + HCl → NaCI + H₂O
5. 2NaOH + FeCI 2 → Fe (OH)₂ ↓ + 2NaCI
6. NaOH + LiNO₃ →

Домашнее задание
Упражнение:
стр 162-163




































