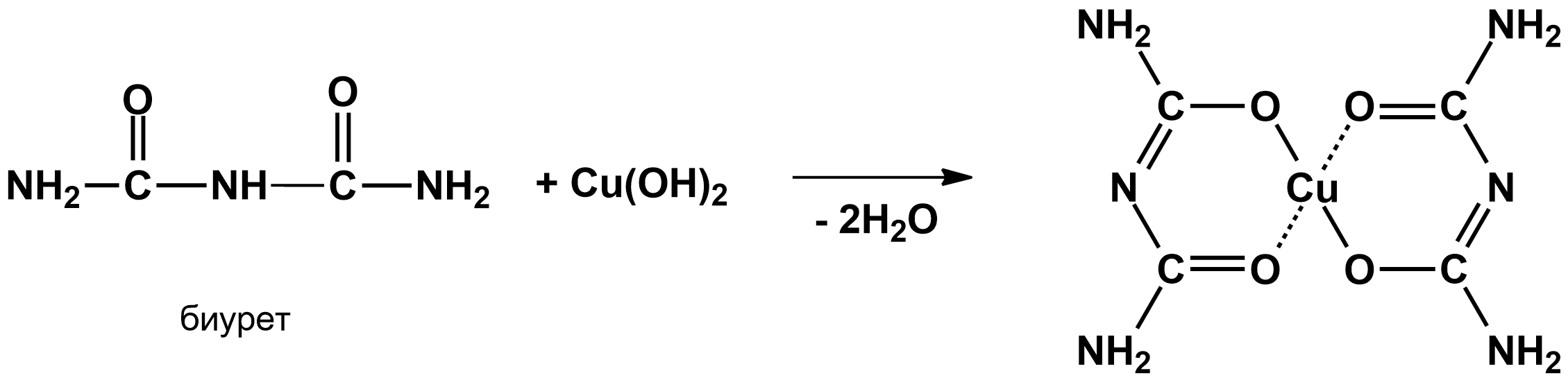ПРЕДМЕТ:ХИМИЯ ОДБ 06
21.04.2020. ВТОРНИК(151-152), 22.04.2020. СРЕДА(153-154),
23.04.2020. ЧЕТВЕРГ(155-156)
Преподаватель: Ибрагимов И.А.
УРОКИ №151-152,153-154,155-156
ТЕМА УРОКА:АМИНЫ.АМИНОКИСЛОТЫ.
Амины можно представить как производные аммиака, в молекулах которого один или несколько атомов водорода заменены на углеводородные радикалы
Номенклатура.
Вещества называют по тем радикалам, которые входят в состав молекулы, с прибавлением слова “амин”.
Назвать вещества.
CH3 – CH2 – CН2 – NH2
1 - аминпропан
CH3 – CН2 – CН2 – CН2 – NH2
1 – аминобутан
Физические свойства аминов.
Метиламин, диметиламин и триметиламин — газообразные вещества, с запахом аммиака, хорошо растворяются в воде, так как их молекулы образуют водородные связи с молекулами воды. Средние члены алифатического ряда – жидкости со слабым запахом тухлой рыбы, с постепенно повышающейся температурой кипения. Высшие амины (начиная с С16Н35N — твердые нерастворимые вещества, не имеющие запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества, практически нерастворимые в воде. Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой.
Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов:
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Химические свойства.
Взаимодействие анилина с соляной кислотой.
С6H5NH2 + HCl → (С6H5NH3)+ Cl- получился хлорид фениламмония
АМИНЫ представляют собой органические основания.
Амины – производные алканов – боле сильные основания, чем аммиак. Они отличаются от аммиака только углеводородными радикалами, которые, очевидно, оказывают влияние на атом азота.
Радикал отталкивает электронную плотность, следовательно, электронная плотность на атоме азота в амине больше, чем в молекуле аммиака. Значит, амин сильнее притягивает к себе протоны воды и кислот, то есть является более сильным основанием.
уравнение реакции горения аминов:
4CH3NH2 + 9O2 → 4CO2 + 2N2 + 10 H2O
Низшие амины из-за их запаха долгое время принимали за аммиак, пока в 1849 г. Ш. Вюрц не выяснил, что в отличие от аммиака они горят на воздухе с образованием углекислого газа
Галогенирование анилина.
уравнение реакции анилина с бромной водой:
C6H5NH2 + 3Br2 → C6H2NH2Br3 + 3HBr
2,4,6-Триброманилин
Получение аминов
С древних времен люди использовали природный краситель синего цвета – индиго. У данного продукта довольно высокая цена и химики ищут строение этого вещества, чтобы синтезировать промышленным способом.
В 1840г русский химик немецкого происхождения Фрицше обнаружил, что при нагревании со щелочью синяя окраска индиго исчезает и образуется вязкая масса. Очистив это вещество Фрицше получил жидкость с характерным запахом и назвал ее анилином (от арабского an-nil синий). В это же время Цнфердорбен нагреванием кристаллического индиго получил новый продукт, названный им кристаллином. В это же время немецкий химик Рунге в продуктах перегонки каменноугольной смолы открыл вещество, назвал его кианол. В 1841г русский химик Зинин открыл способ восстановления нитробензола до ароматического амина – бензидама.
В 1843г Гофман пришел к выводу, что все эти продукты – одно и тоже вещество. Химики остановились на названии анилин.
C6H5NO2 + 6[H] t,kat-Ni → C6H5-NH2 + 2H2O реакция Зинина.
Никола́й Никола́евич Зи́нин 1812 — 1880 — выдающийся русский химик-органик, академик Петербургской академии наук, первый президент Русского химического общества
При всём внешнем благополучии и несомненных творческих удачах Зинин, по воспоминаниям современников, был лишён душевного равновесия и раздражался в тех случаях, где другие учёные проявили бы искреннюю заинтересованность.
Немецкому ученому А.Гофману удалось модифицировать метод получения анилина из нитробензола, открытый Зининым. Гофман заменил сульфид аммония другим восстановителем — водородом в момент выделения. На основе модифицированного метода он организовал промышленное производство анилина, что вызвало раздраженную реакцию Зинина, приоритет которого никто не оспаривал: «Вечно немцы уводят открытия у нас из-под носа».
Исследуя нитропроизводные, Зинин вместе с В. Ф. Петрушевским начал работы над созданием взрывчатой композиции на основе нитроглицерина, безопасной при транспортировке. В итоге был найден хороший вариант — пропитка нитроглицерином карбоната магния. Об этом Зинин рассказывал своему соседу по даче Альфреду Нобелю, сыну Эммануила Нобеля — владельца завода по производству мин. Идея пригодилось А. Нобелю спустя несколько лет. Во время транспортировки нитроглицерина одна из бутылей разбилась, и жидкость пропитала инфузорную землю, насыпанную между бутылями для предупреждения возможного удара. Нобель, вероятно, вспомнивший рассказы Зинина о том, что нитроглицерином следует пропитывать порошкообразные вещества, достаточно быстро оценил свойства образовавшейся композиции, названной впоследствии динамитом и принёсшей ему громадные прибыли. Узнав все это, Зинин заметил: «Этот Альфред Нобель выхватил у нас динамит из-под носа».
Применение.
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Загрязнение окружающей среды.
Амины и окружающая среда.
а) предприятия, которые используют или производят эти соединения;
б) крупные животноводческие комплексы и птицефабрики;
в) автотранспорт (выхлопные газы);
г) бытовое загрязнение (при пользовании газом, стирке белья,
приготовлении пищи и т.д.);
Рассказываем о действии аминов на организм человека.
Задача.
Вычислите массу бромной воды с массовой долей брома 2%, которая потребуется для полного взаимодействия со 186г 1%-ного раствора анилина.
Дано:
W(С6Н5NH2)= 1%
W(Br2)= 2%
m(p-paС6Н5NH2)= 186г
Найти:
m(p-paBr2)-?
Решение:
С6Н5NH2 + 3Br2 = C6H2Br3NH2 + 3HBr
W(в-ва)= m(в-ва)/m(смеси)
m(С6Н5NH2) = m(p-paС6Н5NH2)*W(С6Н5NH2) = 186*0,01 = 1,86 г
n=m/M, M(С6Н5NH2) =93г/моль
n(С6Н5NH2) = m(С6Н5NH2)/M(С6Н5NH2) = 1,86/93 = 0,02 моль
По уравнению реакции: 3n(Br2) = n(С6Н5NH2) = 3*0,02моль = 0,06 моль
m(Br2) = n(Br2)*M(Br2) = 0,06*160 = 9,6 г
m(p-paBr2) = m(Br)/W(Br2) = 9,6/0,02 = 480 г.
Аминокислоты относятся к гетерофункциональным соединениям, т.е. вещества, проявляющим свойства двух классов соединений. В неорганической химии такие соединения называют амфотерными.
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений.
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной. α-аминокислоты являются амфотерными электролитами. Имея как минимум две диссоциирующие и противоположно заряженные группировки, аминокислоты в растворах с нейтральным значением рН практически всегда находятся в виде биполярных ионов, или цвиттер-ионов, в которых противоположные заряды пространственно разделены, например H3+N—CH2—CH2—COO−.
Именно амфотерность аминокислот обуславливает их наиболее характерные свойства.
1. Кислотные свойства аминокислот проявляются по карбоксильной группе в их способности взаимодействовать, например, с щелочами:
или вступать в реакцию этерификации со спиртами с образованием сложных эфиров:
2. Основные свойства аминокислот проявляются по аминогруппе в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно-акцепторному механизму:
3. Амфотерность аминокислот проявляется также в их способности образовывать в растворе в результате диссоциации биполярный ион — внутреннюю соль, а самое главное, за счет амфотерности аминокислоты могут вступать друг с другом в реакции поликонденсации. образуя полипептиды и белки:
КАЧЕСТВЕННЫЕ (ЦВЕТНЫЕ) РЕАКЦИИ НА АМИНОКИСЛОТЫ И БЕЛКИ
Качественные цветные реакции можно подразделить на два типа: универсальные и специфические. К универсальным реакциям относятся те, которые дают окрашивание в присутствии любых белков.
Специфические реакции доказывают наличие какой-то определенной аминокислоты. Все качественные реакции можно наблюдать на примере раствора яичного белка, представляющего собой многокомпонентную смесь аминокислот:
УНИВЕРСАЛЬНЫЕ ЦВЕТНЫЕ РЕАКЦИИ
1. Биуретовая реакция - универсальная реакция на все белки и пептиды, так как является реакцией на пептидную связь. Представляет собой взаимодействие щелочного раствора биурета ((H2NC(O))2NH с раствором сульфата меди в присутствии гидроксида натрия (реактив Фелинга).
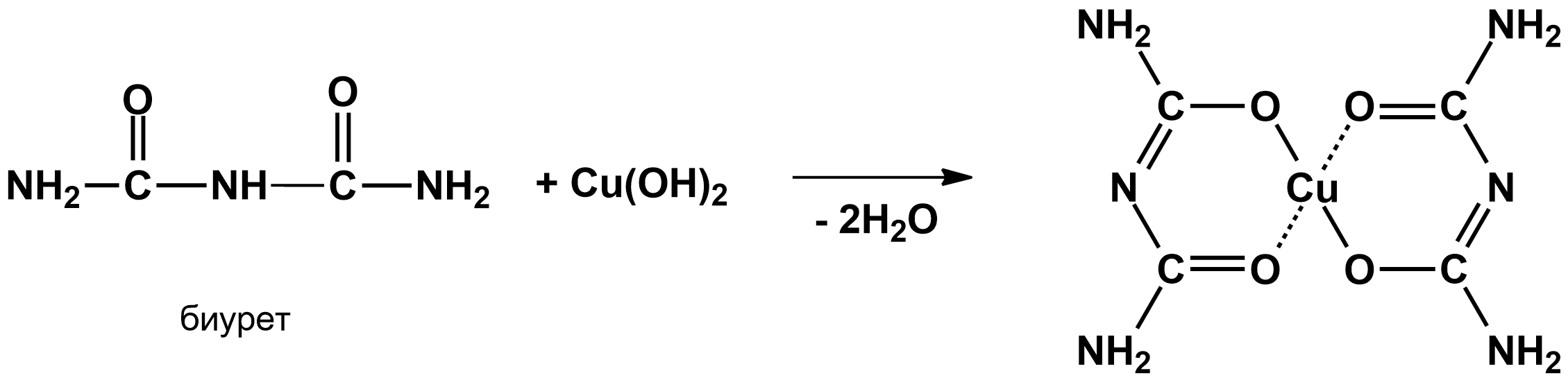
В реакцию, подобную биуретовой, вступают многие вещества, содержащие в молекуле не менее двух амидных группировок, амиды и имиды аминокислот и некоторые другие соединения. Продукты реакции в этом случае имеют фиолетовую или синюю окраску.
В условиях биуретовой реакции белки дают фиолетовую окраску, что используется для их качественного и количественного анализа. Биуретовая реакция обусловлена присутствием в белках пептидных связей, которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные солеобразные комплексы меди.
2. Нингидриновая реакция - цветная реакция на α-аминокислоты, которую осуществляют нагреванием последних в избытке щелочного раствора нингидрина (гидрата 1,2,3-индантриона).

Образующееся в результате реакции соединение (дикетогидринимин - на рисунке самый левый продукт реакции) имеет фиолетово-синюю окраску. Данную используют для колориметрического количественного определения α-аминокислот, в том числе в автоматических аминокислотных анализаторах.
СПЕЦИФИЧЕСКИЕ ЦВЕТНЫЕ РЕАКЦИИ
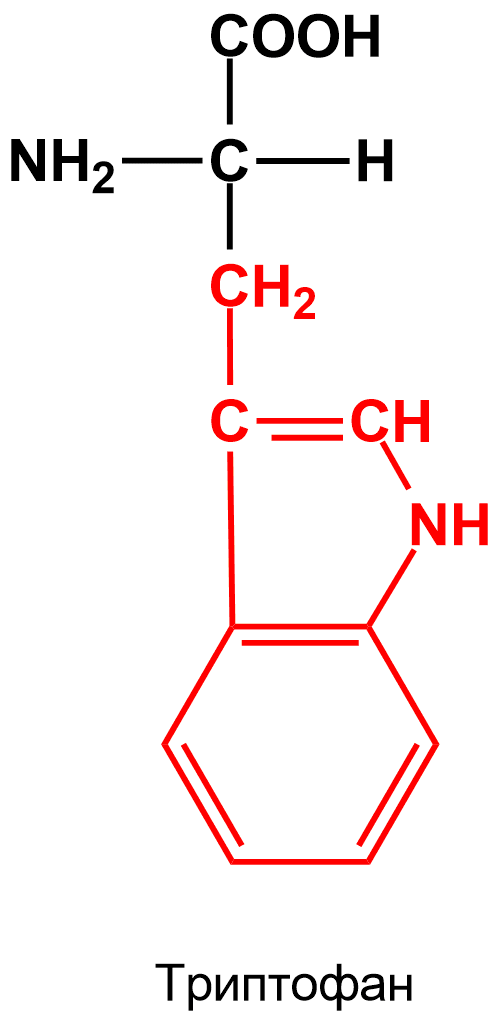
1. Реакция Щульца-Распайли (аналогично проводится реакция Адамкевича, только с добавлением глиоксиловой кислоты) - является специфической реакцией на аминокислоту триптофан - взаимодействие раствора яичного белка с 10% раствором сахарозы и равным объемом концентрированной H2SO4. На границе двух жидкостей образуется красно-фиолетовое кольцо (при нагревании на водяной бане реакция идет быстрее - главное не смешивать жидкости).

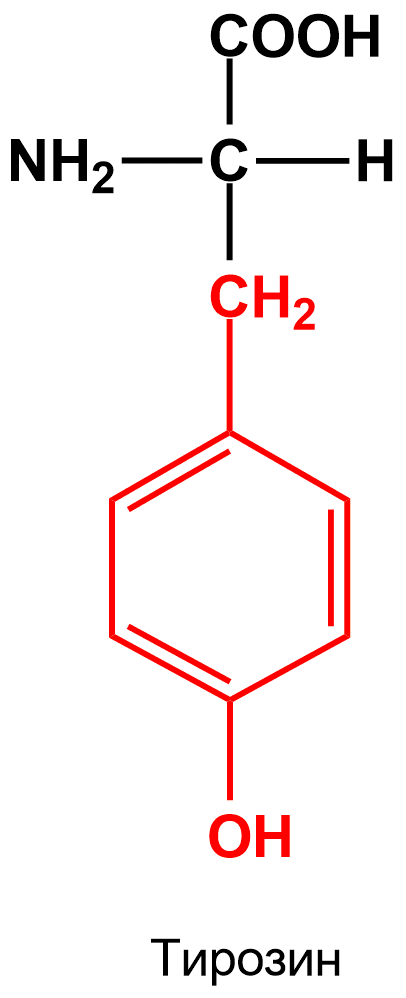
2. Реакция Милона - используется для обнаружения тирозина, в составе которого имеется фенольный гидроксил. При добавлении к раствору белка реактива Милона (раствор HgNO3 и Hg(NO3)2 в разбавленной азотной кислоты HNO3, содержащей примесь азотистой кислоты HNO2) образуется осадок, сначала окрашенный в розовый, а затем в пурпурно-красный цвет. Нагревание до 50∘C ускоряет эту реакцию.
3. Ксантопротеиновая реакция - является специфической реакцией и используется для обнаружения α-аминокислот, содержащих в радикале ароматический цикл, например фенилаланина. Для ее осуществления к раствору белка прибавляют концентрированную азотную кислоту HNO3 до тех пор, пока не прекратится образование осадка, который при нагревании окрашивается в желтый цвет. Окраска возникает в результате нитрования ароматических колец аминокислотных остатков белка (тирозина и триптофана). При добавлении к охлажденной жидкости избытка щелочи появляется оранжевое окрашивание, обусловленное образованием солей нитроновых кислот.
4. Реакция Фоля на серосодержащие аминокислоты (цистеин, метионин) - взаимодействие раствора яичного белка с 30% раствором NaOH и 5% раствором уксуснокислого свинца - Pb(CH3COO)2. При длительном нагревании жидкость буреет, выпадает черный осадок сульфида свинца.


Конспект отправить на этот адрес электронной почты, указав ФИО учащегося, № группы и номер урока.
[email protected]